
- •Конспекты
- •Соединения с открытой цепью
- •I. Углеводороды
- •Номенклатура алканов
- •1.2. Способы получения
- •Химические свойства
- •Алкены (этиленовые углеводороды, олефины)
- •2.1. Строение, изомерия и номенклатура
- •Способы получения
- •Химические свойства
- •Гидратация.
- •3. Галогенирование.
- •4. Гидрогалогенирование.
- •Гипогалогенирование.
- •3. Алкадиены.
- •Методы получения
- •Химические свойства.
- •4. Алкины (ацетиленовые углеводороды).
- •4.1. Методы получения.
- •4.2. Химические свойства.
- •Моногалогенпроизводные алканов.
- •Предельные одноатомные спирты.
- •Многоатомные предельные спирты.
- •Непредельные одноатомные спирты.
- •Альдегиды и кетоны.
- •I. Предельные альдегиды и кетоны.
- •2. Ненасыщенные альдегиды и кетоны.
- •2.1. Оксосоединения с сопряженными двойными связями.
- •2.2. Кетены.
- •3. Диальдегиды и дикетоны.
- •1. Предельные одноосновные кислоты.
- •1.2. Методы получения.
- •1.2. Физические свойства.
- •1.3. Химические свойства.
- •1.3.2. Образование ацилгалогенидов.
- •1.3.3. Образование ангидридов.
- •1.3.4. Этерификация. Сложные эфиры.
- •2. Амины.
- •1.2. Глюкоза.
- •1.3. Другие моносахариды.
- •4.2. Структура целлюлозы.
Предельные одноатомные спирты.
1.1. Изомерия и номенклатура. Для спиртов характерна структурная изомерия, обусловленная со строением углеродного скелета молекулы и положением гидроксильной группы.
В случае спиртов используется три номенклатуры. Рациональная номенклатура, которая названия соединений выводит от названия первого члена гомологического ряда, применяется довольно редко. При этом этот простейший алкоголь называется карбинол, а все другие спирты считаются происшедшими от него.
Гораздо чаще названия спиртов производят от названий углеводородных радикалов, с которыми связан гидроксил.
В более сложных случаях используется систематическая номенклатура. В этом случае как обычно выбирается главная цепь, обязательно включающая функциональную группу. Цепь нумеруется, начиная с того конца, куда ближе гидроксильная группа. Если группа ОН является старшей в данном соединении, то в названии она выражается суффиксом -ол. Если же гидроксил выступает в качестве заместителя, то он обозначается приставкой гидрокси- или окси.
Приведем структуры некоторых наиболее часто встречающихся спиртов и назовем их:
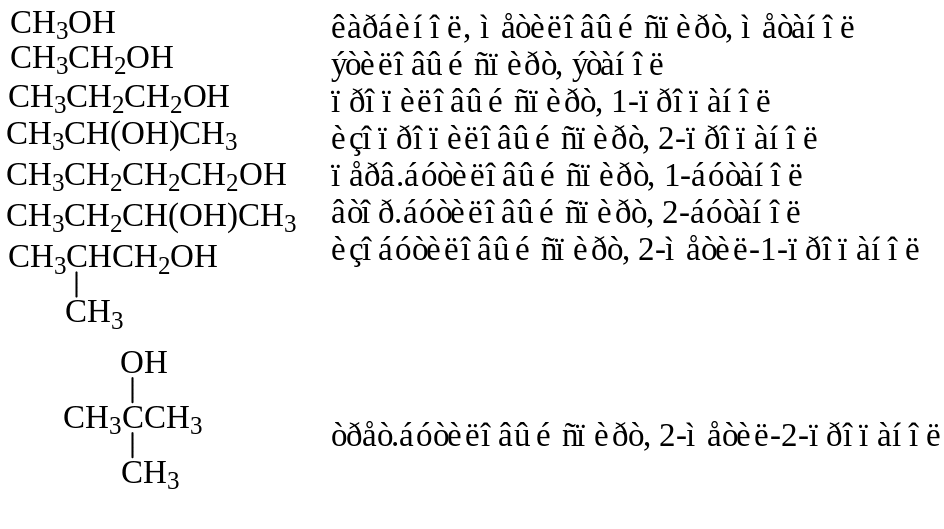

1.2. Методы получения. Некоторые из важнейших методов получения спиртов мы уже рассмотрели – это гидратация алкенов (см. реакции электрофильного присоединения к алкенам) и гидролиз галогенпроизводных (см. реакции нуклеофильного замещения в галогеналканах). Кроме них известен целый ряд других способов, делающих этот класс органических соединений весьма доступным.
1.2.1. Гидрирование альдегидов и кетонов. Гидрирование альдегидов и кетонов – удобный метод синтеза некоторых спиртов. При гидрировании альдегиды превращаются в первичные, а кетоны – во вторичные спирты:
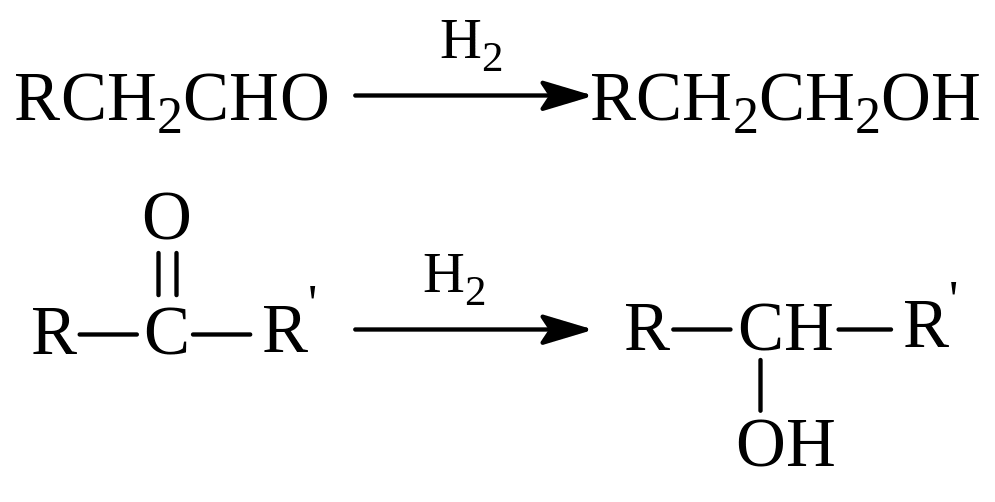
Производимый в значительных масштабах перв.бутиловый спирт получают гидрированием масляного альдегида – продукта оксосинтеза с участием пропилена, оксида углерода и водорода:
![]()
При каталитическом гидрировании в качестве катализатора чаще всего применяются никель, палладий, хромит меди, платина. Следует иметь в виду, что гетерогенное гидрирование у алкенов протекает легче, чем у карбонильных соединений. Поэтому возникает проблема избирательного гидрирования карбонильной группы у непредельных карбонильных соединений. Однако найдены условия и реагенты, позволяющие проводить селективное гидрирование. Оказалось, что прекрасным гидрирующим агентом являются неорганические гидриды – литийалюминийгидрид и натрийборгидрид.
Ход гидрирования литийалюминийгидридом можно представить следующей схемой:
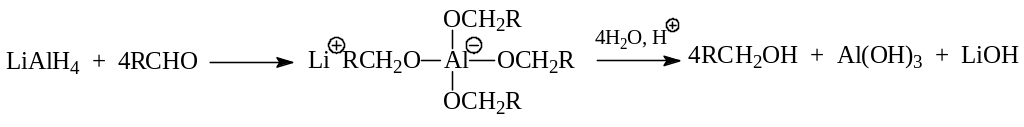
Рассматриваемая реакция сводится к нуклеофильному присоединению по поляризованной карбонильной группе
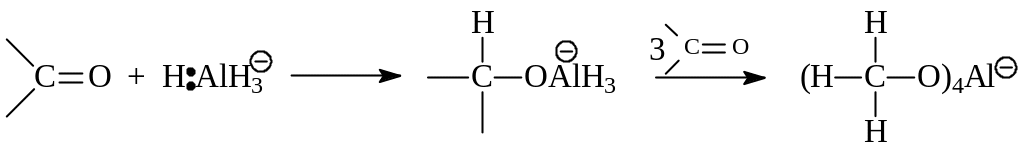
Литийалюминийгидрид, особенно натрийборгидрид, не гидрирует двойные углерод-углеродные связи. Это дает возможность получать непредельные спирты из ненасыщенных карбонильных соединений.
1.2.2.Магнийорганический синтез. В этом случае синтез спиртов осуществляется путем взаимодействия магнийорганических соединений с карбонильными соединениями и эпокисями. Вообще же это частный случай реакции металлорганических соединений с альдегидами, кетонами и сложными эфирами, который впервые был осуществлен Бутлеровым, Зайцевым и Вагнером на примере цинкорганических соединений.
Синтез спиртов через магнийорганические и карбонильные соединения
(Гриньяр) происходит по следующей общей схеме. В магнийгалогеналкилах углеводородный остаток ведет себя как нуклеофил, который легко присоединяется по карбонильной группе:
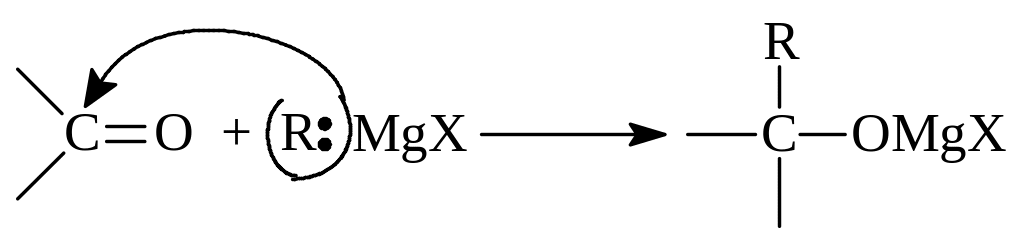
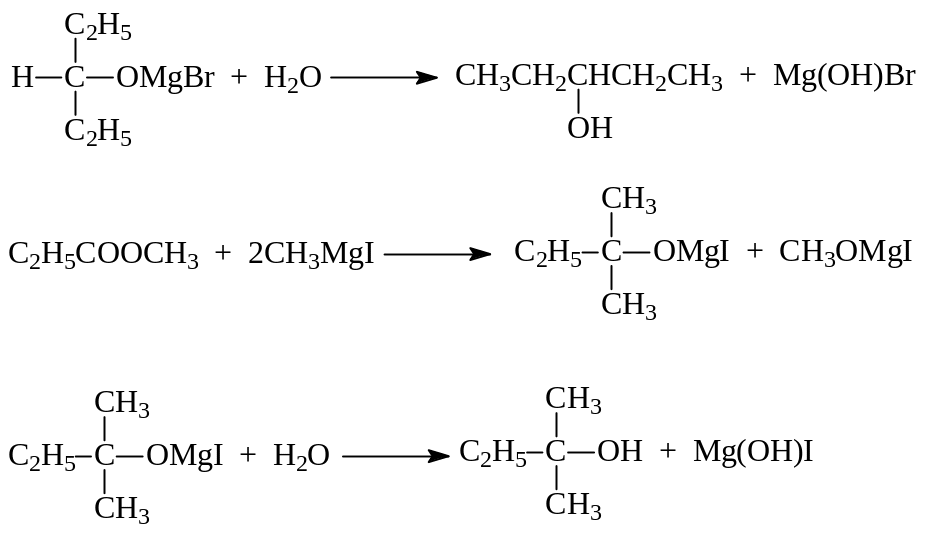
Образовавшиеся магнийгалогеналкоголяты при гидролизе образуют спирты:
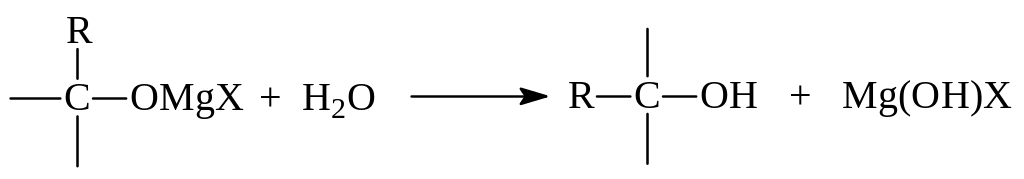
Ниже даны примеры синтеза спиртов рассматриваемым методом. При участии в реакции формальдегида получаются первичные спирты:
![]()
Вовлечение в реакцию любых других альдегидов приводит к вторичным спиртам:
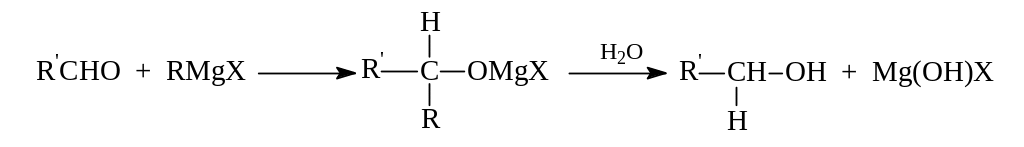
Кетоны по этому методу дают третичные спирты:
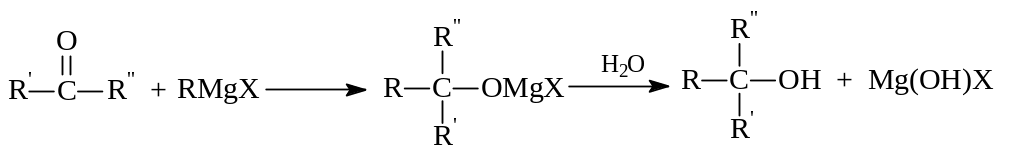
Сложные эфиры также содержат карбонильную группу, способную к взаимодействию с магнийорганическими соединениями. Поэтому их то же можно использовать для синтеза спиртов. При этом формиаты превращаются во вторичные спирты, эфиры других кислот дают третичные спирты, у которых два одинаковых углеводородных заместителя:
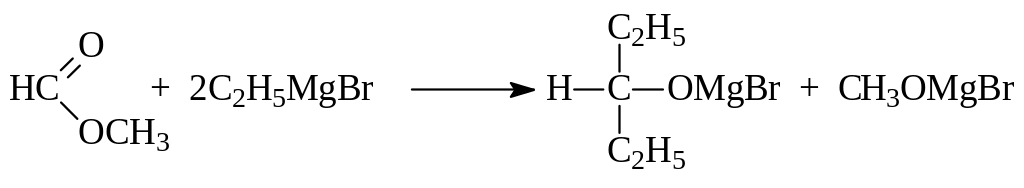
Взаимодействовать с магнийгалогеналканами могут и эпокиси. Гидролиз образовавшихся алкоголятов позволяет получить первичные спирты, в молекуле которых на два углерода больше, чем в алкильной группе реактива Гриньяра:
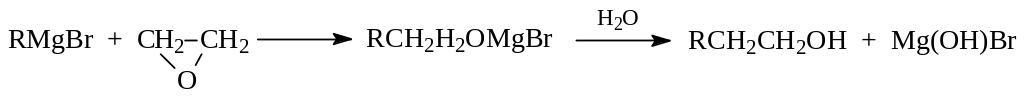
1.2.3. Восстановление карбоновых кислот и сложных эфиров. Карбоновые кислоты при восстановлении превращаются в первичные спирты. Один из лучших восстановителей в данном случае алюмогидрид лития:
![]()
Однако восстановление литийалюминийгидридом обходится довольно дорого, а другим методам восстановления карбоновые кислоты поддаются с трудом. Поэтому восстановлению обычно подвергают не карбоновые кислоты, а их производные – сложные эфиры.
Сложные эфиры карбоновых кислот можно восстановить под давлением 10-15 атм на медно-хромовом катализаторе при 2500. В указанных условиях в промышленности из метилового эфира лауриновой кислоты поучают додециловый эфир:
![]()
Сложные эфиры восстанавливаются также по Буво и Блану водородом в момент выделения. Для этого сложный эфир кипятят в спиртовом растворе с металлическим натрием. При этом разрывается связь между кислородом и ацильной частью эфира. Из осколков получается два спирта, один из которых обязательно первичный:
![]()
Полагают, что в ходе реакции последовательно получаются алкоголят и альдегид. А уже при гидрировании последнего образуется спирт:
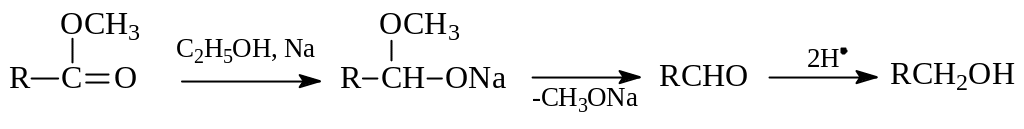
1.2.4. Алюмоорганический синтез (Алфол-процесс). В виду особой важности первичных высших жирных спиртов для них был разработан специальный синтез через алюмоорганические соединения. При этом вначале реакцией триэтилалюминия с этиленом получают триалкилалюминий:

В последующем полученный триалкилалюминий окисляют, а образовавшийся алкоголят алюминия – гидролизуют:
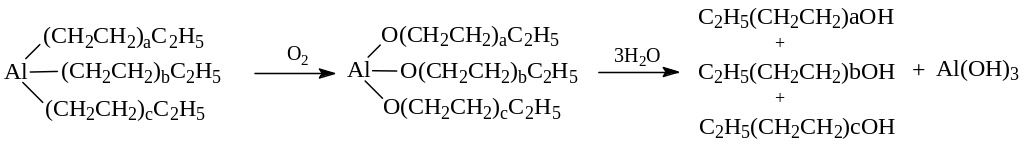
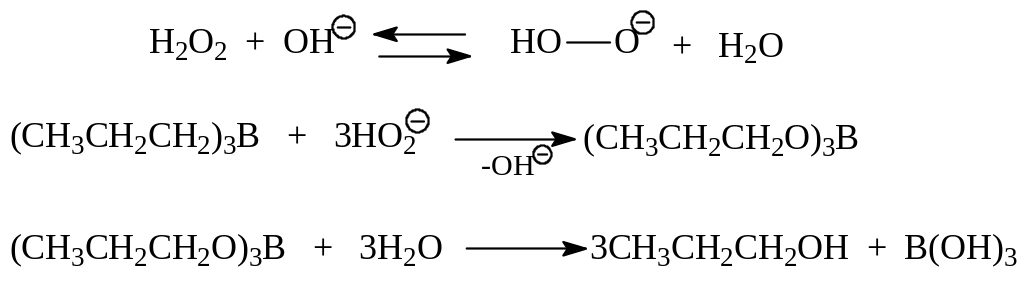
1.2.5. Гидроборирование – окисление алкенов. Этот метод получения спиртов ценен тем, что позволяет синтезировать первичные спирты. Гидрид бора в димерной форме (В2Н6. диборан) легко присоединяется к алкенам против правила Марковникова с образованием алкилборанов. Эта реакция носит название гидроборирования:
![]()
В последующем алкилбораны окисляют щелочным раствором перекиси водорода в эфиры борной кислоты. Гидролиз последних приводит к первичным спиртам:
1.2.6. Кроме общих методов, для получения практически важных спиртов разработаны специальные способы получения, которые лежат в основе соответствующих промышленных процессов. Так, метанол получают гидрированием оксида углерода при 4000 и 200-300 атм в присутствии окисного цинк-хромового катализатора (около 90% оксида цинка):
![]()
Значительные количества этилового спирта до сих пор получают сбраживанием дрожжами некоторых видов моно-, ди- и полисахаридов: главным образом глюкозы, фруктозы, мальтозы, сахарозы, а также крахмала и целлюлозы. Суммарное уравнение превращения сахаров в этиловый спирт и двуокись углерода таково:
![]()
1.3. Химические свойства. Химические свойства спиртов определяются наличием в их молекуле гидроксильной группы. Аналогично атомам галогенов в галогенпроизводных углеводородов, эта группа может замещаться на какие-нибудь другие заместители или отщепиться вместе с водородным атомом. Интересно отметить, что заместиться может гидроксил целиком или только водород в ней. Гидроксил становится хорошей уходящей группой после протонирования, потому что в этом случае в ходе реакции замещения гидроксил уходит в виде нейтральной молекулы воды, а не гидроксил-аниона. Любопытно, что гидроксильная группа по существу не оказывает влияния на реакционную способность связанного с ней углеводородного остатка.
Рассмотрим наиболее характерные реакции спиртов.
1.3.1. Дегидратация. При нагревании спиртов в присутствии кислот (жидкофазная дегидратация) или при пропускании паров спирта через слой катализатора, чаще всего оксида алюминия, при 400-5000 (парофазная дегидратация) отщепляется молекула воды и образуется алкен:
![]()
Установлено, что легче дегидратируются третичные спирты, труднее – первичные. Вторичные спирты по реакционной способности при дегидратации занимают промежуточное положение. Часто спирты определенного строения при дегидратации дают алкены неожиданного строения. При отщеплении воды, как правило, соблюдается правило Зайцева – образуется наиболее замещенный алкен.
Все эти наблюдения над дегидратацией спиртов вполне объясняются в рамках следующего механизма. Вначале молекула спирта протонируется, затем отщепляется молекула воды с образованием карбокатиона. Далее ион отщепляет протон с соседнего с электронодефицитным углеродом положения. Это известный уже нам механизм Е1 – элиминирования. На примере дегидратации этилового спирта в присутствии серной кислоты реакция идет по следующей схеме:
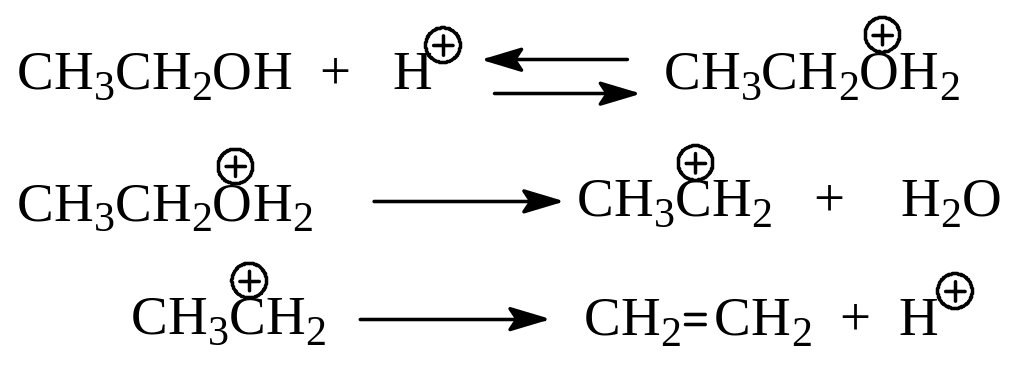
Кроме выброса протона, карбокатион вполне может прореагировать и с молекулой спирта. В этом случае образуется простой эфир, а реакция становится межмолекулярной дегидратацией.

На направление дегидратации в данном случае существенно влияет температура реакции: при 1400 протекает межмолекулярная дегидратация, а при 1800 – внутримолекулярная.
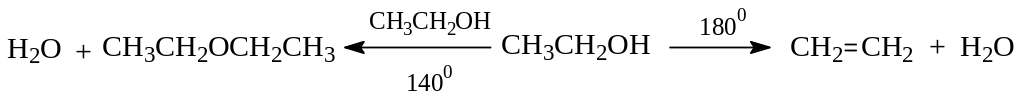
Образование на ключевой стадии дегидратации карбокатиона объясняет также образование неожиданных продуктов реакции. Известно, что карбокатионам присущи перегруппировки. Если в ходе реакции образуется катион, который в результате так называемых 1,2-сдвигов может преобразоваться в более устойчивый карбокатион, то это происходит неминуемо.
Рассмотрим механизм кислотной дегидратации изоамилового спирта:
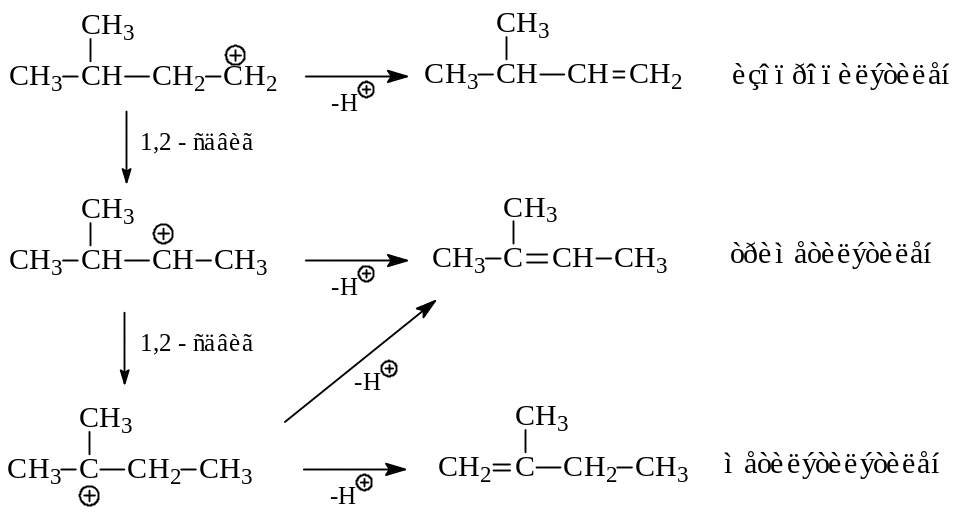
В результате этой реакции получается смесь трех изоамиленов с преобладанием триметилэтилена. Из приведенного механизма видно почему это происходит. Первоначально образовавшийся первичный карбокатион может депротонироваться в изопропилэтилен или перегруппироваться во вторичный ион. Последний, в свою очередь, может отщепить протон и превратиться в триметилэтилен или преобразоваться в третичный карбокатион. Состав продуктов дегидратации изоамилового спирта определяется, очевидно, соотношением скоростей депротонирования и 1,2-гидридных сдвигов.
1.3.2. Кислотно-основные свойства. Связь О-Н в гидроксильной группе спиртов сильно поляризована, т.к. в данном случае ковалентно связаны два атома, значительно различающиеся по электроотрицательности. Поляризация облегчает отщепление относительно положительного водорода в виде иона. Этим объясняется определенная кислотность, которую проявляют спирты. О кислотности спиртов свидетельствует их способность реагировать с активными металлами с выделением водорода и с образованием алкоголятов – солей спиртов как слабых кислот:
![]()
Следующие реакции свидетельствуют, что спирты являются более слабыми кислотами, чем вода, но более сильными кислотами, чем ацетилен:
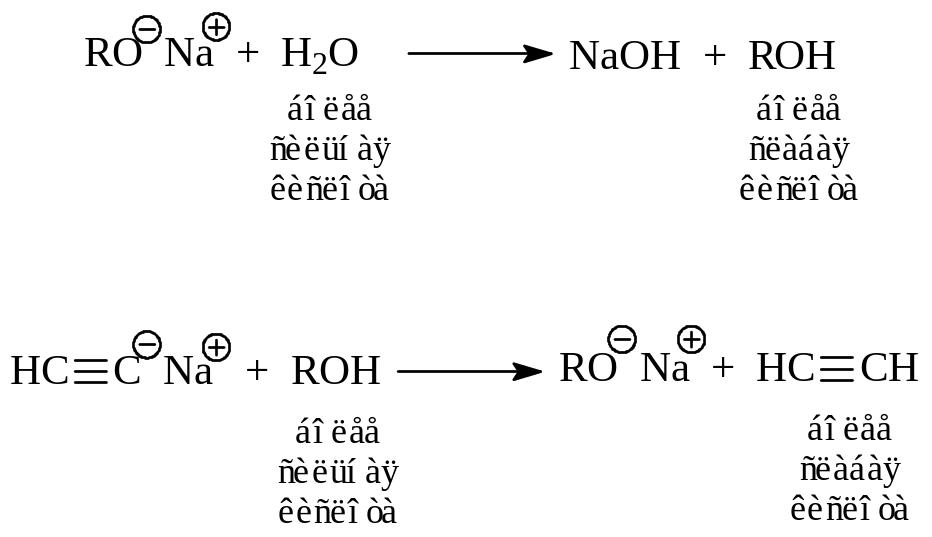
В ряду спиртов кислотность изменяется в следующем порядке:
![]()
Предполагается, что такой порядок изменения кислотности связан с индуктивным эффектом алкильных радикалов. Алкил как донор электронов будет увеличивать плотность отрицательного заряда в алкокси-анионе и, тем самым, делать его менее устойчивым:
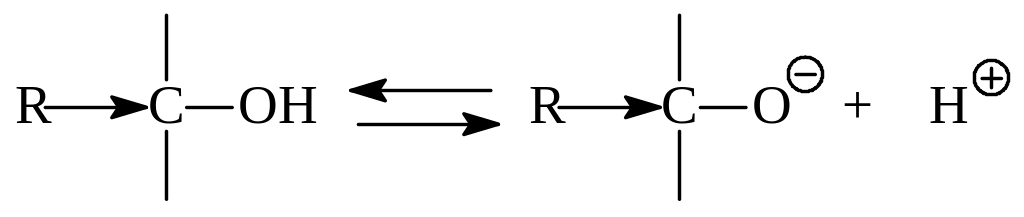
Возможно и другое объяснение. В алкокси-анионе в случае третичных спиртов возникают пространственные затруднения для сольватации. Это повышает энергию аниона и затрудняет его образование. Такая точка зрения основывается на порядке изменения кислотности в паровой фазе (сольватация несущественна), которая оказывается обратным порядку изменения кислотности в растворах.
Слабость третичных спиртов как кислот говорит о том, что их анионы должны обладать сильной основностью. Действительно, трет.бутокси- анион является более сильным основанием, чем гидроксил-анион. Поэтому алкоголяты спиртов широко используются как очень сильные основания и для введения алкоксигруппы в молекулу.
Гидроксильная группа в спиртах, обуславливающая их кислотность, придает им также, за счет неподеленной пары кислорода, свойства оснований. Известно, что спирты легко протонируются с образованием молекулы протонировнного спирта или иона алкоксония:
![]()
1.3.3. Замещение ОН-группы на галоген. Замещение ОН-группы на галоген происходит при взаимодействии спиртов с галогенводородами, галогенидами фосфора, хлористыми тионилом (SOCl2) и сульфурилом (SO2Cl2). Например:
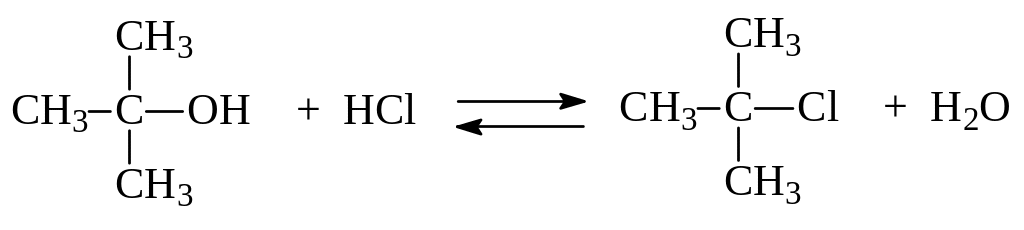
Установлено, что при взаимодействии спиртов с галогенводородами:
- реакция ускоряется сильными минеральными кислотами;
- в ряде случаев реакция протекает с перегруппировкой;
- реакционная способность изменяется в следующем порядке:
![]()
Эти наблюдения над реакцией можно объяснить на основании механизма SN1. Предполагается, что вначале молекула спирта протонируется. Протонированный спирт диссоциирует на карбокатион и воду. В быстрой стадии реакции карбокатион присоединяет ион галогена и дает продукт реакции:
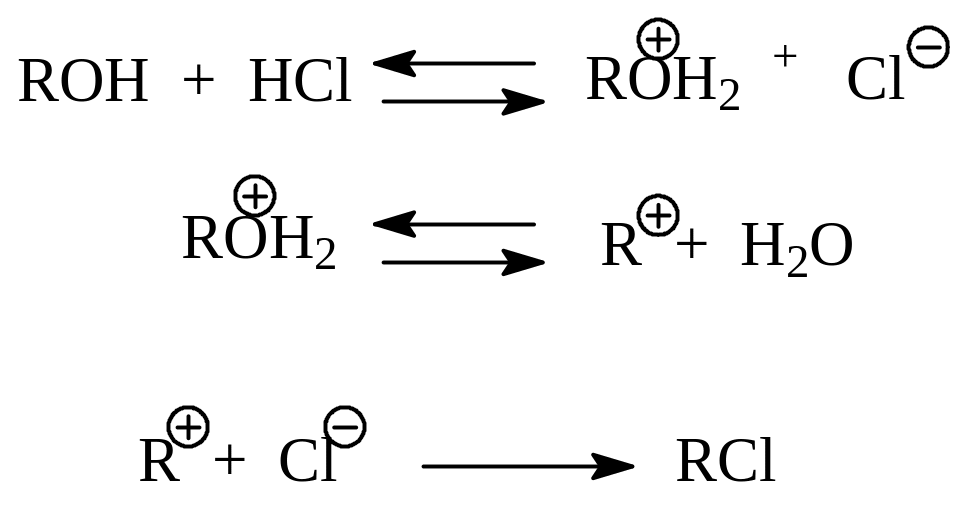
Образование на ключевой стадии нуклеофильного замещения карбокатиона объясняет наблюдающееся иногда получение в реакции неожиданных продуктов. Так, при SN1-реакции с участием неопентилового спирта и хлористого водорода вместо ожидаемого неопентилхлорида получается трет.пентилхлорид в результате 1.2-метильного сдвига в первоначально образовавшемся карбокатионе:
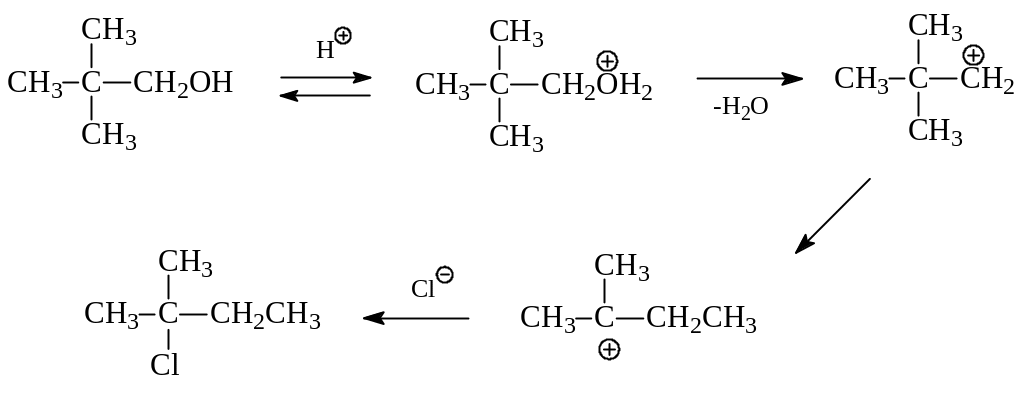
Интересно отметить, что многие первичные спирты реагируют с галогенводородами без перегруппировок. Предполагается, что это происходит потому, что в реакциях с их участием не образуются промежуточные карбокатионы, способные перегруппироваться. В этом случае реакция идет по SN2-механизму с участием протонированной молекулы спирта:
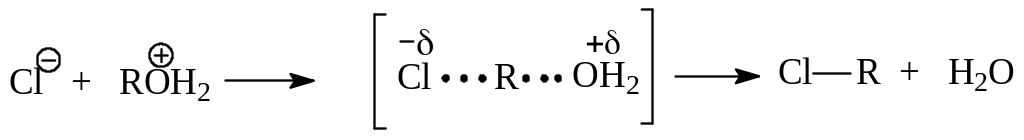
Сказанное вовсе не означает, что по бимолекулярному механизму реагируют все первичные спирты. Выше было показано, что первичный спирт – неопентиловый – замещается по SN1-механизму с перегруппировкой. Дело в том, что этот спирт из-за объемистого неопентилового заместителя и обусловленного этим пространственного затруднения бимолекулярной реакции может реагировать только по SN1-механизму. Другим примером реагирования первичного спирта по этому механизму является аллиловый спирт, Этот спирт при мономолекулярном замещении на лимитирующей стадии реакции образует устойчивый аллильный катион. Это и определяет предпочтительность реакции SN1 перед SN2 в данном случае.
Для получения хлористых алкилов из спиртов удобно использование хлористого тионила. При взаимодействии спирта с хлористым тионилом вначале образуется не устойчивый алкилхлорсульфит, который уже при слабом нагревании разлагается на алкилхлорид и сернистый ангидрид:
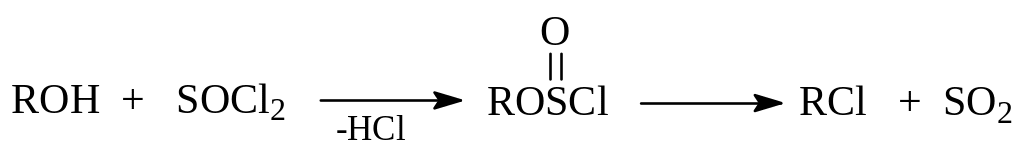
1.3.4. Образование сложных эфиров. При взаимодействии спиртов с карбоновыми и минеральными кислотами и некоторыми их производными (ангидридами и галогенангидридами) происходит образование сложных эфиров. В молекуле сложных эфиров кислородный атом связан с углеводородным радикалом и кислотным остатком. Реакция образования эфира носит название этерификации. Для протекания реакции требуется присутствие кислого катализатора. При этерификации кислотами выделяется вода а сама реакция является обратимой:
![]()
Этерификация подвержена пространственным препятствиям – объемистые заместители вблизи от реакционного центра в спирте или кислоте замедляют реакцию. С учетом этого обстоятельства спирты по реакционной способности при этерификации располагаются в следующий ряд:
![]()
Ряд активности карбоновых кислот в рассматриваемой реакции следующий:
![]()
Механизм кислотно-катализируемой этерификации следующий. Вначале имеет место протонирование молекулы карбоновой кислоты по карбонильному кислороду - образуется карбокатион, положительный заряд в котором сильно рассредоточен с участием кислородных атомов. В последующем карбокатион реагирует с нуклеофилом, в качестве которого выступает молекула спирта:
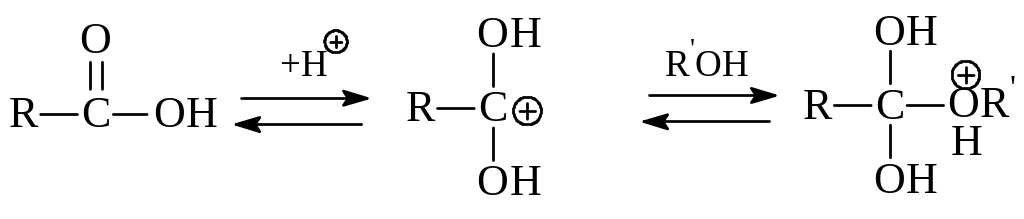
Далее в оксониевом ионе протон от алкокси-группы переходит к одному из гидроксилов. На заключительных этапах реакции оксониевый ион отщепляет уходящую группу Н2О и протон:
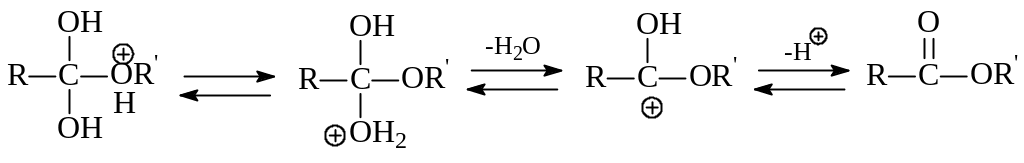
В соответствии с обсуждаемым механизмом в ходе реакции происходит разрыв между гидроксилом и кислотным остатком кислоты. Это было доказано опытами с меченым О18:

1.3.5. Окисление и дегидрирование спиртов. Характер продуктов окисления спиртов определяется тем, какой алкоголь подвергается реакции. Первичные спирты легко окисляются и образуют альдегиды:
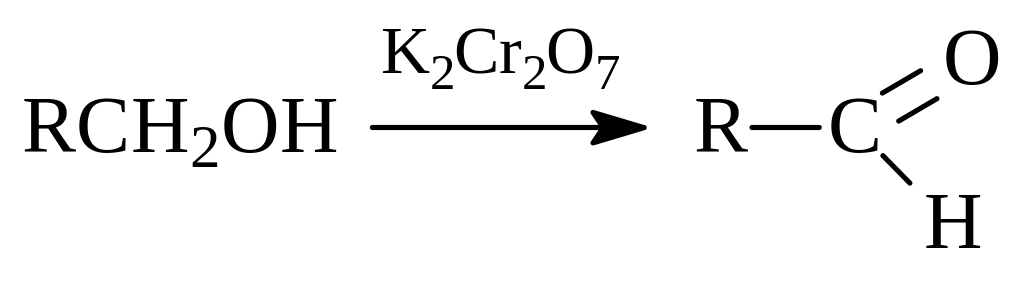
Поскольку альдегиды окисляются до карбоновых кислот даже легче самих спиртов, то их следует выводить из зоны реакции прежде, чем это произойдет.
Вторичные спирты при окислении образуют кетоны:

Третичные спирты окисляются с большим трудом и только с разрывом связей между углеродными атомами.
При окислении спиртов используется кислород воздуха и химические окислители: перманганат калия, хромовая кислота и др.
С образованием альдегидов и кетонов протекает и дегидрирование спиртов. Реакцию проводят, пропуская пары спирта через нагретые до 200-3000 медные стружки:
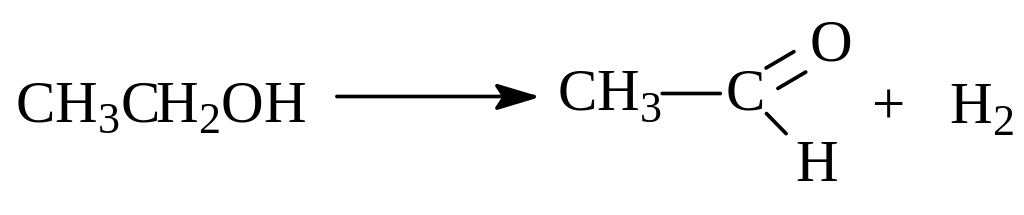
Интересно отметить, что при получении формальдегида из метилового спирта процесс осуществляют в таких условиях (650-7000, катализатор серебро на пемзе), чтобы тепловые эффекты реакций дегидрирования и окисления компенсировали друг друга.
1.3.6. Взаимодействие с магнийгалогеналкилами. Реактивы Гриньяра можно рассматривать как соли углеводородов как кислот. Поскольку спирты более сильные кислоты, то они вытесняют углеводород из соли:
![]()
При использовании метилмагнийгалогенидов в этой реакции получается метан. По объему алкана можно проводить количественное определение спиртов (метод Церевитинова-Чугаева).
1.4. Отдельные представители.
Наибольшее применение из спиртов находит метиловый спирт. Значительная его часть идет на получение формальдегида, эфиров, аминов, красителей, душистых веществ. Находит применение как растворитель широкого назначения. Ядовит. В технике получают восстановлением СО.
Этиловый спирт получают гидратацией этилена и брожением сахаристых веществ. Находит широкое применение как многоцелевой растворитель, как полупродукт при синтезе диэтилового эфира, хлороформа, сложных эфиров, в производстве фармацевтичесих, душистых веществ и красителей. Обладает слабым наркотическим действием. К сожалению, широко используется при изготовлении алкогольных напитков
Н.бутиловый спирт получается брожением глюкозы под влиянием особых бактерий и гидрированием масляного альдегида. Этот спирт и его сложные эфиры в больших количествах применяются в лакокрасочной промышленности как растворители.
Высшие жирные спирты получают восстановлением сложных эфиров, альдегидов и карбоновых кислот, а также в алфол-процессе. Широко используются при производстве моющих средств (алкилсульфаты), синтетических масел и пластификаторов (сложные эфиры).
