
- •4)Гомоциклические (ароматические) аминокислоты
- •31) Лиазы.
- •Номенклатура
- •Авитаминозы Причины
- •Биологическая роль
- •Как может повлиять изменение одного азотистого основания в мРнк на аминокислотную последовательность полипептида?
- •Макроэргические соединения: атф и другие нуклеозидтрифосфаты, креатинфосфат, аргининфосфат и другие. Напишите структурную формулу атф. Укажите макроэргические связи.
- •Какие химические соединения называются макроэргическими? Напишите формулы нуклеотидов, являющихся макроэргическими соединениями. Какова их биологическая роль.
- •Классификация и номенклатура углеводов. Особенности строения моносахаридов.
- •Дайте определения следующим понятиям: оптические антиподы, эпимеры, диастереоизомеры, рацемическая смесь.
- •Что такое мутаротация? Как можно объяснить преобладание [3- d-глюкопиранозы в растворе после стояния? Какие еще формы глюкозы находятся в растворе? Напишите формулы.
- •Основные таутомерные формы глюкозы в растворе. Напишите их формулы. Что такое мутаротация?
- •Какая функциональная группа глюкозы проявляет восстанавливающие свойства? Напишите схему реакции окисления глюкозы гидроксидом меди (II).
- •Химические свойства моносахаридов (реакции с участием карбонильной и спиртовой групп, гликозидного гидроксила).
- •Охарактеризуйте производные моносахаридов: аминосахара, кислоты, гликозиды. Приведите примеры и напишите формулы.
- •Структура, свойства и биологическая роль аминосахаров и их ацильных производых. Напишите структурную формулу n-ацетилнейраминовой кислоты.
- •Что такое гликозиды? Как определить принадлежность гликозидов к l- и d-ряду? Напишите формулы следующих веществ:
- •Какой вывод можно сделать о химических свойствах сахарозы на основании ее строения? Способна ли она к мутаротации? Может ли она восстанавливать аммиачный раствор серебра, реактив Фелинга?
- •Строение сахарозы (напишите структурную формулу), её свойства. Инверсия сахарозы. Как называется и чем характеризуется подобный тип олигосахаридов?
- •Гомогликаны, их строение и функции. Напишите структурную формулу фрагмента гликогена с точкой ветвления и целлюлозы.
- •Охарактеризуйте физико-химические свойства и укажите структурные особенности крахмала, гликогена и целлюлозы. Укажите черты сходства и различия в строении и свойствах указанных гомогликанов.
- •Гетерогликаны, их строение и функции. Приведите примеры. Напишите структурную формулу фрагмента какого-либо гетерогликана.
- •Классификация и физико-химические свойства липидов.
- •Строение, физико-химические свойства жирных кислот. Приведите примеры. Напишите структурную формулу линоленовой кислоты.
- •Характеристика высших жирных кислот, входящих в состав жира. Что называется кислотным числом, числом омыления, йодным числом.
- •Арахидоновая кислота и ее производные, их роль в обмене веществ.
- •Охарактеризуйте простые липиды: ацилглицерины, воски. Напишите структурную формулу триацилглицерина, дайте его полное название (с указанием жирнокислотных остатков).
- •Регуляция активности ферментов путем ковалентной модификации. Приведите примеры.
- •Гормональная регуляция активности ферментов с участием вторичных посредников. (??)
- •Роль внутриклеточных посредников в проведении и усилении гормонального сигнала. (???)
- •Биосинтез рнк. Этапы транскрипции. Процессинг мРнк.
- •Транскрипция: биохимические механизмы и биологическая роль транскрипции.
- •Репликация днк; молекулярные механизмы и биологическая роль.
- •Механизм действия стероидных гормонов.
- •Мембранно-опосредованный механизм действия пептидных и белковых гормонов.
- •Назовите а-кетокислоты, образующиеся из аминокислот (аспартата, аланина) в реакциях трансаминирования с а-кетоглутаратом. Опишите механизм трансаминирования.
- •Назовите пути образования и распада аминокислот. Декарбоксилирование аминокислот. Физиологическая роль продуктов этого процесса.
- •138 Молекул атф
- •Синтез триацилглицеринов
- •22) Биосинтез глицерофосфолипидов
Арахидоновая кислота и ее производные, их роль в обмене веществ.
рахидоновая кислота - ( эйкозатетраеновая кислота ;5,8,11,14-эйкозатетpаеновая) - полиненасыщенная жирная кислота, входит в состав мембранных фосфолипидов тромбоцитов и эндотелиальных клеток. Высвобождается из фосфолипидов под действием фосфолипазы А2 и фосфолипазы С ( рис. 2.3 allerg), активируемых коллагеном, тромбином, АДФ и другими биологически активными веществами. Арахидоновая кислота является предшественником в синтезе оксилипинов см. рис. 1-1 и рис. 1-2. Свободная арахидоновая кислота быстро метаболизируется, превращаясь в высокоактивные соединения - простагландины и тромбоксаны.
В составе липидов арахидоновая кислота присутствует в мозге, печени и молочном жире млекопитающих. В фосфолипидах надпочечников арахидоновая кислота составляет около 20 % от суммы жирных кислот. При гидрировании арахидоновая кислота образует арахиновую кислоту, встречающуюся в маслах бобовых растений, в частности — арахиса.[1] Метаболиты АК являются эндогенными лигандами каннабиноидных рецепторов (1992 - 95 гг.). Наиболее важными среди них являются продукт неокислительного метаболизма арахидоновой кислоты - арахидонилэтаноламид (анандамид) и 2- арахидонилглицерин, 2-АГ Оба соединения выполняют функции нейромодулятора и нейромедиатора и служат "эндогенными каннабиоидами".
Охарактеризуйте простые липиды: ацилглицерины, воски. Напишите структурную формулу триацилглицерина, дайте его полное название (с указанием жирнокислотных остатков).
Глицериды (ацилглицерины, или ацилглицеролы *) представляют собой сложные эфиры трехатомного спирта глицерина и высших жирных кислот. Если жирными кислотами этерифицированы все три гидроксильные группы глицерина (ацильные радикалы R1, R2 и R3 могут быть одинаковы или различны), то такое соединение называют триглицеридом (триацилглицерол), если две – диглицеридом (диацилглицерол) и, наконец, если этерифицирована одна группа – моноглицеридом (моноацилглицерол).
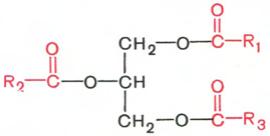
Триацилглицерол
Наиболее распространенными являются триглицериды, часто называемые нейтральными жирами или просто жирами. Нейтральные жиры находятся в организме либо в форме протоплазматического жира, являющегося структурным компонентом клеток, либо в форме запасного, резервного, жира. Роль этих двух форм жира в организме неодинакова. Протоплазматический жир имеет постоянный химический состав и содержится в тканях в определенном количестве, не изменяющемся даже при патологическом ожирении, в то время как количество резервного жира подвергается большим колебаниям. Как отмечалось, основную массу природных нейтральных жиров составляют триглицериды. Жирные кислоты в триглицеридах могут быть насыщенными и ненасыщенными. Из жирных кислот чаще встречаются пальмитиновая, стеариновая и олеиновые кислоты. Если все три кислотных радикала принадлежат одной и той же жирной кислоте, то такие триглицериды называют простыми (например, трипальмитин, тристеарин, триолеин и т.д.), если разным жирным кислотам, то смешанными. Названия смешанных триглицеридов образуются в зависимости от входящих в их состав жирных кислот, при этом цифры 1, 2 и 3 указывают на связь остатка жирной кислоты с соответствующей спиртовой группой в молекуле глицерина (например, 1-олео-2-пальмитостеарин). Необходимо отметить, что положение крайних атомов в молекуле глицерина на первый взгляд равнозначно, тем не менее их обозначают сверху вниз – 1 и 3. Это объясняется прежде всего тем, что в структуре триглицерида при пространственном ее рассмотрении крайние ≪глицериновые≫ атомы углерода становятся уже не равнозначными, если гидроксилы 1 и 3 ацилированы разными жирными кислотами. При необходимости применяют также систему стереохимической нумерации (обозначают sn –stereochemical numbering): например, 1,2-дистеарил-3-пальмитил-sn-глицерол.
По этой системе, если в проекции Фишера гидроксильная группа при 2-м углеродном атоме глицерина располагается слева, атому углерода, находящемуся над ним, присваивается номер 1, а расположенному под ним – номер 3. Действительно, углероды 1 и 3 глицерола, учитывая их пространственное расположение, неидентичны. Особенно четко это видно на примере молекулы триглицерида. Ферменты это различают и всегда специфичны только к одному из трех углеродов глицерина. Так, глицеролкиназа фосфорилирует глицерин в положении sn-3, в результате чего образуется глицерол-3-фосфат, но не глицерол-1-фосфат. Жирные кислоты, входящие в состав триглицеридов, практически определяют их физико-химические свойства. Так, температура плавления триглицеридов повышается с увеличением числа и длины остатков насыщенных жирных кислот. Напротив, чем выше содержание ненасыщенных жирных кислот, или кислот с короткой цепью, тем ниже точка плавления. Животные жиры (сало) обычно содержат значительное количество насыщенных жирных кислот (пальмитиновой, стеариновой и др.). благодаря чему при комнатной температуре они твердые. Жиры, в состав которых входит много ненасыщенных кислот, при обычной температуре жидкие и называются маслами. Так, в конопляном масле 95% всех жирных кислот приходится на долю олеиновой, линолевой и линоленовой кислот и только 5% – на долю стеариновой и пальмитиновой кислот. В жире человека, плавящемся при температуре 15°С (при температуре тела он жидкий), содержится 70% олеиновой кислоты. Глицериды способны вступать во все химические реакции, свойственные сложным эфирам. Наибольшее значение имеет реакция омыления, в результате которой из триглицеридов образуются глицерол и жирные кислоты. Омыление жира * может происходить как при ферментативном гидролизе, так и при действии кислот или щелочей.
Воска – сложные эфиры высших жирных кислот и высших одноатомных или двухатомных спиртов с числом углеродных атомов от 16 до 22. Общие их формулы можно представить так:
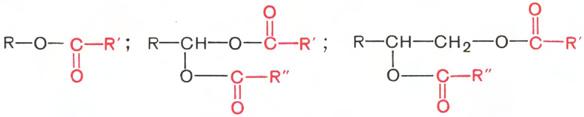
В этих формулах R, R' и R" – возможные радикалы.
Воска могут входить в состав жира, покрывающего кожу, шерсть, перья. У растений 80% от всех липидов, образующих пленку на поверхности листьев и плодов, составляют воска. Известно также, что воска являются нормальными метаболитами некоторых микроорганизмов. Природные воска (например, пчелиный воск, спермацет, ланолин) обычно содержат, кроме указанных сложных эфиров, некоторое количество свободных жирных кислот, спиртов и углеводородов с числом углеродных атомов 21–35.
Глицерофосфолипиды, их строение, разнообразие и свойства. Приведите примеры и напишите структурные формулы.
Глицерофосфолипиды являются производными фосфатидной кислоты. В их состав входят глицерин, жирные кислоты, фосфорная кислота и обычно азотсодержащие соединения. Общая формула глицерофосфолипидов выглядит так:
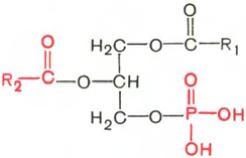
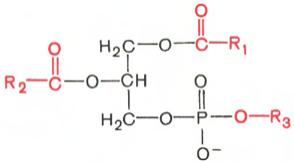
Фосфатидная кислота Глицеролфосфолипид
В этих формулах R1 и R2 – радикалы высших жирных кислот, a R3 – чаще радикал азотистого соединения. Для всех глицерофосфолипидов характерно, что одна часть их молекул (радикалы R1 и R2 ) обнаруживает резко выраженную гидрофобность, тогда как другая часть гидрофильна благодаря отрицательному заряду фосфорной кислоты и положительному заряду радикала R3.
Из всех липидов глицерофосфолипиды обладают наиболее выраженными полярными свойствами. При помещении глицерофосфолипидов в воду в истинный раствор переходит лишь небольшая их часть, основная же масса липидов находится в виде мицелл. Существует несколько групп (подклассов) глицерофосфолипидов. В зависимости от характера азотистого основания, присоединенного к фосфорной кислоте, Глицерофосфолипиды подразделяют на фосфатидилхолины (лецитины), фосфатидилэтаноламины (кефалины) и фосфатидилсерины. В состав некоторых глицерофосфолипидов вместо азотсодержащих соединений входит не содержащий азота шестиуглеродный циклический спирт инозит, называемый также инозитолом. Эти липиды называются фосфатидилинозитолами.
Фосфатидилхолины (лецитины). В отличие от триглицеридов в молекуле фосфатидилхолина одна из трех гидроксильных групп глицерина связана не с жирной, а с фосфорной кислотой. Кроме того, фосфорная кислота в свою очередь соединена эфирной связью с азотистым основанием – холином [НО—СН2—СН2—N+(CH3)3]. Таким образом, в молекуле фосфатидил-холина соединены глицерин, высшие жирные кислоты, фосфорная кислота и холин:
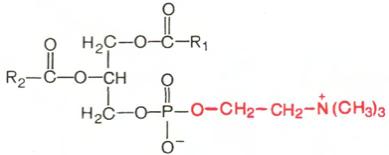
Фосфатидилхолин
Фосфатидилэтаноламины. Основное различие между фосфатидилхолинами и фосфатидилэтаноламинами – наличие в составе последних азотистого основания этаноламина (HO—CH2—CH2—N+H3):
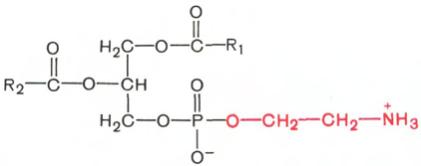
Фосфатидилэтаноламин
Из глицерофосфолипидов в организме животных и высших растений в наибольшем количестве встречаются фосфатидилхолины и фосфатидилэтаноламины. Эти 2 группы глицерофосфолипидов метаболически связаны друг с другом и являются главными липидными компонентами мембран клеток.
Фосфатидилсерины.
В
молекуле фосфатидилсерина азотистым
соединением служит остаток аминокислоты
серина
![]()
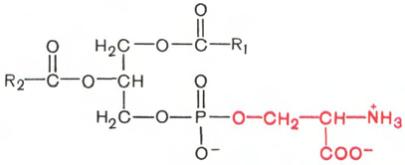
Фосфатидилсерин
Фосфатидилсерины распространены гораздо менее широко, чем фосфатидилхолины и фосфоэтаноламины, и их значение определяется в основном тем, что они участвуют в синтезе фосфатидилэтаноламинов.
Глицерофосфолипиды являются производными фосфатидной кислоты. Напишите формулу фосфатидной кислоты. Какими кислотами этерифицированы спиртовые группы большинства природных глицерофосфолипидов?
Фосфатидная кислота
Какими кислотами???
Напишите формулы: а- и b-фосфатидилхолинов, кардиолипина. Охарактеризуйте эти соединения.
Фосфатидилхолин
В отличие от триглицеридов в молекуле фосфатидилхолина одна из трех гидроксильных групп глицерина связана не с жирной, а с фосфорной кислотой. Кроме того, фосфорная кислота в свою очередь соединена эфирной связью с азотистым основанием – холином [НО—СН2—СН2—N+(CH3)3]. Таким образом, в молекуле фосфатидил-холина соединены глицерин, высшие жирные кислоты, фосфорная кислота и холин
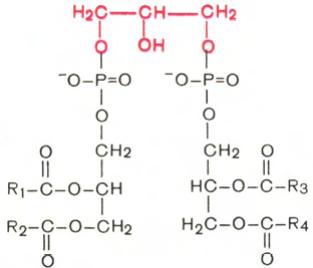
Кардиолипин
Своеобразным представителем глицерофосфолипидов является кардиолипин, впервые выделенный из сердечной мышцы. По своей химической структуре кардиолипин можно рассматривать как соединение, в котором 2 молекулы фосфатидной кислоты связаны с помощью одной молекулы глицерина. В отличие от остальных глицерофосфолипидов кардиолипин является как бы ≪двойным≫ глицерофосфолипидом. Кардиолипин локализован во внутренней мембране митохондрий. Функция его пока неясна, хотя известно, что в отличие от других фосфолипидов кардиолипин обладает иммунными свойствами.
93. Церамиды и сфингомиелины
Церамидами называют ?-ацильные производные сфингозинов, в которых аминогруппа основания ацилирована жирной кислотой. Эти соединения широко распространены в тканях растений и животных, но количества их незначительны. Церамиды различаются остатками жирных кислот, входящими в их состав. Жирные кислоты, присоединенные амидными связями к аминогруппе основания в молекуле церамида, содержат различное число атомов углерода (Ci6, Ci8, С22 или С24). Сфингомиелины могут рассматриваться как фосфохолиновые производные церамидов и являются одной из наиболее важных групп фосфолипидов.
О ? II
ОН N—CR
СН3(СН2)12—СН=СН—СН—СН—СН2ОН цераммЭ
н ?
ОН N—CR О CH3(CH2)12-CH=CH-CH-CH-CH2-0-P-OCH2CH2N=(CH3)3
о-сфмнгомиелмн
Хотя сфингомиелины по химическому строению и отличаются от фосфатидилхолина, эти соединения проявляют определенное сходство, обусловленное типичной для амфифилов структурой, а именно наличием ионной фосфорилхолиновой группировки и двух длинных углеводородных целей.
Впервые сфингомиелины были обнаружены в нервной ткани, однако они входят в состав липидов крови, а также встречаются во многих других тканях. Кроме обычных сфингозинов, рассмотренных выше, сфингомиелин из мозга содержит полиненасыщенные сфингозины, называемые дегидросфингозинами.
95. ЦЕРЕБРОЗИДЫ, сфинголипиды общей ф-лы RCH(OH)CH(NHCOR')CH2OX, где R и R' - алкил, гидроксиалкил, алкенил; X - остаток глюкозы (глюкоцереброзиды), галактозы (галактоцереброзиды) или фукозы (фукоцереброзиды). В глюко- и галакто-цереброзидах присутствует-гликозидная связь, в фуко-цереброзидах-гликозидная связь.
Цереброзиды- твердые в-ва, не раств. в воде, хорошо раств. в орг. р-рителях. При кислотном гидролизе образуют жирные к-ты, сфингозины (сфингозиновые основания) RCH(OH)CH(NH2)CH2OH и углеводы.
Цереброзиды содержатся в тканях человека, животных и высших растений. С их функционированием связана деятельность организма в целом и на клеточном уровне (изолирующие свойства миелиновой оболочки нервных аксонов, межклеточное узнавание, иммунологич. р-ции). Биосинтез цереброзидов протекает по двум путям: гликозилирование церамидов с помощью уридиндифосфатсахаров или гликозилирование сфингозинов с послед. N-ацилированием. Нарушения метаболизма цереброзидов, обусловленные снижением активности или отсутствием ферментов их гидролиза, имеют наследственный характер (т. наз. болезнь Краббе); при этом в органах и тканях, особенно в мозге, накапливаются галактоцереброзиды. Повышение содержания глюкоцереброзидов в мозге, печени свидетельствует о нарушениях обмена ганглиозидов (болезнь Гоше).
Осуществлен полный хим. синтез и полусинтез цереброзидов, их аналогов и меченых производных, используемых в качестве диагностич. и исследовательских биопрепаратов. Осн. путь синтеза - гликозилирование бензоилцерамидов RCH(OCOC,H5)CH(NHCOR')CH2OH по Кёнигса-Кнорра реакции. Наиб. стереоселективно с образованием-аномера гликозилирование происходит в присут. цианида ртути. Другой подход - ацилирование психозина (сфингозил--галактозида), полученного при избират. гидролизе прир. цереброзидов.
Типичными представителями цереброзидов головного мозга являются галактоцереброзиды на основе 4-сфингенина CH3(CH2)12CH = CHCH(OH)CH(NH2)CH2OH: френозин [в общей ф-ле R' = C22H25CH(OH)], т. пл. 195 °С; церазин (R' = С23H47), т. пл. 182 °С; нервон [R' = СН3(СН2)6СН = = СН(СН2)13].
96. При гидролизе распадаются на сфингозин, галактозу или глюкозу, а также остаток жирной кислоты. Цереброзиды содержатся в больших количествах в составе мозга, особенно в белом веществе мозга и мякотных нервных волокнах.
Избыточное накопление цереброзидов в организме и появление их в больших количествах в печени, селезенке, костном мозге и лимфатических узлах связано с некоторыми заболеваниями нервной системы — так называемой нейролипоидозами. Среди этих жирных кислот чаще всего встречается лигноцериновая, нервоновая и цереброновая кислоты, т.е. жирные кислоты, имеющие 24 углеродных атома. Структура цереброзидов может быть представлена следующей схемой:
Сфингозин - СН2-О— гексоза (чаще галактоза)
0 = С — остаток жирной кислоты
97) ГАНГЛИОЗИДЫ (сиалогликосфинголипиды), гликосфин-голипиды общей ф-лы , где Х - углеводная цепь, содержащая остатки сиаловых к-т, связанных с остатком галактозы или гексозамина (см., напр., ф-лу I в ст. Гликосфинголипиды; Y - остаток N-ацетил- или N-гликолилнейраминовой к-ты, к-рые наз. сиаловыми к-тами - см. ф-лу).
В названиях ганглиозидов используют сочетание из двух букв - G (указывает принадлежность соед. к ганглиозидам) и М, D, Т или Q (показывают число сиаловых к-т в молекуле - соотв. 1, 2, 3 или 4) и цифры (иногда с буквами) в ниж. индексе, обозначающие конкретное в-во. Соед. I (ф-ла в ст. Гликосфинголипиды, Y-остаток N-ацетилнейраминовой к-ты) по этой номенклатуре обозначается GM1. В соответствии с правилами ИЮПАК это соед. обозначается II3AcNeuGgOse4Cer, где римская цифра показывает положение остатка моносахарида (считая от церамида; в общей ф-ле Х-Н), с к-рым связан остаток сиаловой к-ты, цифра в верх. индексе-номер углеродного атома в цикле, с к-рым связана эта к-та, AcNeuGgOse4-oлигocaxapиднaя цепь (AcNeu-остаток N-ацетилнейраминовой к-ты, GgOse4- остаток ганглиотет-раозы), Сеr-остаток церамида.
Ганглиозиды широко распространены в тканях животных, особенно в мозге. В растениях и микроорганизмах не встречаются. Локализованы в осн. на пов-сти плазматич. мембраны клетки. Как и др. Гликосфинголипиды участвуют в процессах регуляции роста и адгезии клеток, межклеточных взаимодействиях, иммунология, процессах. Могут входить в состав рецепторов токсинов (напр., GMj входит в состав рецептора токсина холеры), пептидных гормонов, нек-рых вирусов и интерферона.
В клетке ганглиозиды синтезируются в аппарате Гольджи путем переноса остатков моносахаридов и сиаловых к-т от уридиндифосфатсахаров и цитидинмонофосфатсиаловых к-т в присут. специфич. гликозилтрансфераз и сиалилтрансфераз к церамиду. При нарушении метаболизма ганглиозидов возникают болезни (ганглиозидозы). Изменение биосинтеза ганглиозидов происходит и при злокачественной трансформации клеток. В препаративных кол-вах ганглиозиды получают из прир. источников, в осн. из мозга.
98. Стерины
Стеролы, циклические спирты, относящиеся к классу стероидов (См. Стероиды), широко распространены в живой природе. Большинство С. — оптически-активные кристаллические вещества, растворимые в органических растворителях и нерастворимые в воде. Общим предшественником С. у микроорганизмов, растений и животных служит углеводород Сквален, превращающийся в циклический ланостерин (С30Н50О) или в его изомер циклоартенол, из которых затем образуются различные С., содержащие 27—29 атомов углерода. Важнейший С. животных — Холестерин, самый распространённый С. грибов, в том числе дрожжей,— Эргостерин, а из обширной группы С. растений (фитостеринов (См. Фитостерины)) наиболее распространены β-ситостерин и стигмастерин.
У высших животных С. содержатся в нервной ткани, печени, клетках спермы и т.д.: образуя с высшими жирными кислотами сложные эфиры, они служат их переносчиками в организме. В растениях С. находятся в свободном состоянии или в соединении с жирными кислотами (т. н. стериды), углеводами (т. н. фитостеролины) или с теми и другими вместе. С., поступающие с пищей, используются для синтеза гормонов насекомыми. которые не обладают ферментами, необходимыми для первых стадий биосинтеза С. К С. относят гормоны линьки насекомых (см. Экдизон (См. Экдизоны)) и антеридиол, индуцирующий половое размножение некоторых низших грибов. Близки к С. витанолиды (ненасыщенные Лактоны) и кукурбитацины (ненасыщенные горькие вещества из тыквенных растений), а также сапогенины морских беспозвоночных и входящие в состав Ланолина и восков ланостерин и др. тритерпены со стерановым углеродным скелетом (см. Стероиды). Наиболее изученные биохимич. функции С. — превращение холестерина в стероидные гормоны и эргостерина в витамины группы D под действием ультрафиолетового света. С. входят в состав биологических мембран (См. Биологические мембраны) как их структурные компоненты. Доступные С. (холестерин, эргостерин, (β-ситостерин) используются как сырьё для промышленного получения стероидных гормонов и витаминов группы D.
99.Ж ЕЛЧНЫЕ КИСЛОТЫ, монокарбоновые гидроксикислоты, относящиеся к классу стероидов. Почти все желчные кислоты - производные прир. холановой к-ты (ф-ла Iа).
Наиб. распространены ее моно-, ди- и тригидроксизамещенные, содержащие 24 атома С; известны также ди-, три- и тетрагидроксизамещенные желчные кислоты, содержащие 27 (Iб) и 28 (Iв) атомов С. Положение заместителей, расположенных под или над плоскостью молекулы, обозначают соотв. буквами a и b. Желчные кислоты - кристаллы; плохо раств. в воде (см. табл.). Образование желчных кислот происходит гл. обр. в печени нек-рых птиц, млекопитающих и человека из холестерина. Биосинтез желчных кислот из холестерина включает след. р-ции: гидроксилирование по атомам углерода колец В и С, инверсию 3b- в 3a-гидроксигруппу, восстановление двойной связи при атоме С-5 с получением цис-сочленения колец А и В, окислит. отщепление изопропильной группы в боковой цепи с образованием карбоксильной при атоме С-24.
Для млекопитающих характерно наличие в молекуле желчных кислот 24, для земноводных - 27 атомов С. В желчи человека содержатся хенодезоксихолевая, холевая и дезоксихолевая к-ты (соотв. 45, 31 и 24% от общего кол-ва желчных кислот); в желчи быка - гл. обр. холевая и дезоксихолевая к-ты (30 и 10% соотв.). Желчные кислоты содержатся в желчи в виде щелочных солей т. наз. конъюгатов - соединений желчных кислот с таурином или глицином. Так, для холевой к-ты конъюгаты - гликохолевая к-та (в ф-ле I R = CONHCH2COOH) и таурохолевая к-та (R = = CONHCH2CH2SO3H). Натриевые соли желчных кислот - хорошие эмульгаторы; эмульгируя жиры, они способствуют их всасыванию и перевариванию. Важную роль при этом играют, в частности, р-римые комплексы дезоксихолевой к-ты с жирами и жирными к-тами (холеиновые к-ты). Желчные кислоты получают щелочным гидролизом твердого в-ва желчи: нагревают желчь с 5-10%-ным р-ром КОН или NaOH в автоклаве при 120-160°С в течение 8-16 ч, затем подкисляют разб. НСl и экстрагируют эфиром или этилацетатом. На основе прир. желчных кислот осуществлен синтез разл. гидрокси- и оксопроизводных холановой к-ты. Так, дегидратация холевой к-ты при нагр. в вакууме или при действии ZnCl2 в ацетоне приводит к апохолевой к-те [3,12-дигидрокси-5b-хола-8(14)-ен-24-овая к-та], из к-рой м. б. получены холеиновые к-ты. Желчные кислоты применяют для синтеза кортикостероидов и в медицине в качестве лек. препаратов, растворяющих и предотвращающих образование желчных камней (напр., хенодезоксихолевая к-та и ее Mg-соль, урсодезоксихолевая к-та, этиловый эфир 3,7,12-тригидроксихолановой к-ты).
100. Продукция гормонов аденогипофиза зависит от либеринов и статинов - гормонов гипоталамуса , поступающих в воротную систему гипофиза ( рис. 9.1 ).Рилизинг-факторы, или либерины, стимулирующт синтез и выделение гормонов клетками передней доли гипофиза . Секреция либеринов и статинов контролируется адренергическими , холинергическими и дофаминергическими нейронами высших нервных центров . Кроме того, секреция некоторых гормонов аденогипофиза и либеринов тормозится гормонами периферических эндокринных желез по принципу отрицательной обратной связи. Таким образом, в регуляции роста участвуют гормоны гипоталамуса , аденогипофиза и периферических эндокринных желез - мишеней аденогипофизарных гормонов .
Семейство рилизинг-факторов (гипофизарных либеринов и статинов ) включает небольшие пептиды, образующиеся в нейронах мелкоклеточных ядер медиобазального и отчасти заднего гипоталамуса и хранящиеся в срединном возвышении нейрогипофиза . Рилизинг-факторы, по-видимому, образуются и накапливаются в различных отделах мозга .
К настоящему времени известны 10 рилизинг-факторов, участвующих в регуляции секреции гормонов аденогипофиза .
В 1970-1972 гг группами Гиллемина и Шэлли впервые была расшифрована первичная структура и впервые осуществлен полный химический синтез этих факторов. В настоящее время осуществлен молекулярно-биологический синтез мРНК соматостатина и его гена. Синтезированный ген удалось ввести в бактериальную плазмиду и с ее помощью создать штамм соматостатинпродуцирующих бактерий. Названные рилизинг-факторы состоят из небольшого количества аминокислотных остатков. Так, Тиролиберин является трипептидом, ЛГ/ФСГ-РФ - декапептид, соматостатин - тетрапептид. Их структуры, по-видимому, не обладают видовой специфичностью, в то время как для факторов, контролирующих секрецию МСГ , видовые особенности структуры исключить нельзя.
Предполагают, что у млекопитающих МРФ и МИФ могут быть производными окситоцина: МИФ - боковой цепью, МРФ - лишенными кольцевой структуры и одного остатка цистеина его N-кольцевого фрагмента.
Рилизинг-факторы не всегда обладают строго специфической направленностью действия. Так, ТРФ - стимулятор секреции не только тиреотропного гормона ( ТТГ ), но и пролактина . ЛГ-РФ стимулирует продукцию лютеинизирующего гормона ( ЛГ ) и фолликулостимулирующего гормона ( ФСГ ).
Соматостатин обладает довольно широким спектром ингибирующих эффектов на эндокринные функции: он тормозит секрецию соматотропина ( СТГ ), индуцированную секрецию ТТГ и пролактина передней долей гипофиза , секрецию инсулина и особенно глюкагона поджелудочной железой , а также гормонов желудочно-кишечного тракта . Интересно, что соматостатин образуется не только в гипоталамусе , но и в островковом аппарате поджелудочной железы . МИФ не только тормозит секрецию МСГ средней доли гипофиза , но и оказывает влияние на корковые и подкорковые структуры головного мозга . ТРФ - антидепрессант .
101. Питуитарная железа, называемая также гипофизом, — это мелкая железа около 1 см в диаметре и массой от 0,5 до 1 г, которая лежит в турецком седле (костном образовании основания черепа) и связана с гипоталамусом посредством питуитарного, или гипофизарного, стебля. Физиологически питуитарная железа подразделяется на две независимые части: переднюю долю гипофиза, или аденогипофиз, и заднюю долю гипофиза, или нейрогипофиз. Между ними есть промежуточная доля, относительно плохо васкуляризированная, практически не выраженная у человека и более заметная как структурно, так и функционально у низкоорганизованных организмов.
В эмбриогенезе эти две доли гипофиза развиваются из разных источников: передняя доля — из кармана Ратке, который эмбриологически является инвагинацией фарингеального эпителия, а задняя доля — из нервной ткани, являющейся выростом гипоталамуса. Происхождением передней доли гипофиза из фарингеального эпителия объясняется эпителиоидная структура ее клеток, а наличие глиального типа клеток в задней доле гипофиза — его нейрогенной природой. Передним гипофизом продуцируются 6 важных гормонов-пептидов и несколько менее существенных, в заднем гипофизе содержатся 2 гормона-пептида. Гормоны аденогипофиза играют важную роль в контроле метаболических функций организма:
• гормон роста обеспечивает рост организма, увеличение количества клеток и их дифференцировку, стимулируя образование белков;
• адренокортикотропный гормон (кортикотропин) управляет секрецией некоторых гормонов коры надпочечников, которые, в свою очередь, влияют на метаболизм глюкозы, белков и жиров;
• тиреотропный гормон (тиреотропин, ТТГ) контролирует скорость секреции тироксина и трийодтиронина щитовидной железой. В свою очередь, они регулируют в организме скорость основных химических реакций;
• пролактин обеспечивает развитие молочных желез и продукцию молока;
• два самостоятельных гонадотропных гормона — фолликулостимулирующий и лютеинизирующий — контролируют рост яичников и семенников, их гормональную и репродуктивную активность. Роль гормонов заднего гипофиза иная:
• антидиуретический гормон (также называемый вазопрессином) контролирует скорость экскреции воды с мочой, помогая регулировать количество воды в организме;
• окситоцин стимулирует роды и способствует молокоотделению из молочных желез во время кормления ребенка.
Передняя доля гипофиза содержит много различных типов клеток, синтезирующих и высвобождающих гормоны. Для синтеза определенного типа гормонов в аденогипофизе существует определенный тип клеток. С помощью специальных красителей, реагирующих с комплексом антиген-антитело, где антигеном является определенный гормон, смогли выделить пять разных типов клеток.
1. Соматотропы — гормон роста человека.
2. Кортикотропы — адренокортикотропин.
3. Тиреотропы — тиреотропный гормон.
4. Гонадотропы — гонадотропные гормоны, включая лютеинизирующий гормон, фолликулостимулирующий гормон.
5. Лактотропы — пролактин.
Около 30-40% клеток переднего гипофиза представлены соматотропами, вырабатывающими гормон роста, 20% — кортикотропами, секретирующими АКТГ. Каждый из остальных типов клеток составляет не более 3-5% общего количества, но они секретируют чрезвычайно мощные гормоны, контролирующие функции щитовидной железы, половые функции и секрецию молока.
Соматотропы, избирательно окрашиваемые только кислыми красителями, называют ацидофильными, поэтому опухоли гипофиза, секретирующие большое количество гормона роста, называют ацидофильными опухолями.
Гормоны задней доли гипофиза синтезируются клетками гипоталамуса. Клетки, секретирующие гормоны нейрогипофиза, представляют собой большие нейроны, названные крупноклеточными, и располагаются в супраоптическом и паравентрикулярном ядрах гипоталамуса. Из передних отделов гипоталамуса гормоны транспортируются аксоплазмой нервных волокон в гипофиз.
102.Тиреотропные гормоны
Физиологическими свойствами и производимые в щитовидной железе.
Синтез тиреоидных гормонов в присутствии тиреоидной пероксидазы.[1]
Щитовидная железа производит два тиреоидных гормона, отличающихся лишь наличием или отсутствием одного дополнительного атома йода в молекуле — тироксин (T4) и трийодтиронин (T3). При этом тироксин является относительно малоактивным тиреоидным гормоном, фактически — прогормоном, и слабо связывается непосредственно с рецепторами тиреоидных гормонов в тканях.
Перед тем, как оказать действие на клетки органов-мишеней, большая часть тироксина непосредственно в клетках конвертируется в биологически активную форму — трийодтиронин. Этот процесс происходит при участии металлофермента — селен-зависимой монодейодиназы. При дефиците микроэлемента селена в организме или при генетическом дефекте монодейодиназы, предопределяющем её пониженную активность в тканях, развивается состояние недостаточности гормона щитовидной железы, несмотря на кажущийся нормальным уровень T4 в плазме крови — так называемый англ. euthyroid sick syndrome. Аналогичное состояние может наблюдаться при приёме некоторых лекарственных веществ, угнетающих активность тканевой монодейодиназы.
От 2/3 до 4/5 общего количества тиреоидных гормонов, производимых щитовидной железой, поступает в кровь в форме «прогормона» тироксина, и лишь 1/3-1/5 — в форме биологически активного трийодтиронина.
103.Гормоны поджелудочной железы
Поджелудочная железа является органом смешанной секреции. С одной стороны, она вырабатывает пищеварительные ферменты, которые по специальным каналам поступают в двенадцатиперстную кишку, при этом они находятся в неактивном состоянии. С другой стороны, ее клетки синтезируют рад гормонов, предназначенных для регуляции работы внутренних органов. Ответственны за синтез этих соединений особые клеточные скопления, называемые островками Лангерганса по имени ученого, который их открыл. Они рассредоточены по всему телу железы и не имеют специальных выводных путей. Их секрет поступает непосредственно в кровь и доставляется к органам-мишеням.
Основными гормонами поджелудочной железы являются следующие соединения:
Инсулин
Глюкагон
С-пептид
За синтез инсулина отвечают бета-клетки островков Лангерганса, его основная функция в организме состоит в понижении уровня сахара в крови. Это достигается с помощью одновременного действия по трем направлениям. Инсулин приостанавливает образование глюкозы в печени и повышает количество сахара, который усваивается тканями организма за счет увеличения проницаемости клеточных мембран. В то же время он тормозит распад глюкагона, ведь тот является полимерной цепочкой, состоящей из молекул глюкозы, и может быть использован для увеличения ее концентрации в крови. Под действием ряда факторов в организме возникает недостаток инсулина, ведущий к развитию сахарного диабета.
Выработкой глюкагона занимаются альфа-клетки островков Лангерганса, он отвечает за увеличение концентрации глюкозы в кровяном русле. Это достигается путем стимулирования ее образования в печени. Кроме того, он способствует расщепление липидов в жировой ткани. Таким образом, два описанных выше гормона поджелудочной железы выполняют противоположные функции. Однако в поддержании нормального уровня сахара в крови участвуют и другие биологически активные соединения, вырабатываемые эндокринной системой - соматотропин (гормон роста), кортизол, адреналин.
В диагностике таких заболеваний, как сахарный диабет, ожирение, акромегалия и различные патологии печени, используют анализ крови на инсулин. С-пептид, строго говоря, не является гормоном поджелудочной железы. Он представляет собой часть молекулы проинсулина, которая отделяется от нее в процессе синтеза и оказывается в кровяном русле. Поэтому количество С-пептида в сыворотке крови эквивалентно количеству инсулина, которое секретируется поджелудочной железой. Этот показатель более точен, ведь белковый фрагмент не обладает биологической активностью и не вступает в химические реакции.
В настоящее время его используют в диагностике сахарного диабета I и II типа, опухоли поджелудочной железы и заболеваний печени. Повышенное содержание С-пептида свидетельствует о наличии в организме инсулиномы. Если оно сохраняется после прохождения курса лечения, то велика вероятность развития метастазов или рецидивов заболевания. С-пептид позволяет определять уровень инсулина у больных сахарным диабетом, получающих лечение, и соответственно корректировать характер терапевтических мероприятий. Кроме того, он помогает отслеживать состояние плода у женщин, страдающих диабетом беременных.
104. Гормоны гипоталамуса — важнейшие регуляторные гормоны, производимые гипоталамусом. Все гормоны гипоталамуса имеют пептидное строение и делятся на 3 подкласса: рилизинг-гормоны стимулируют секрецию гормонов передней доли гипофиза, статины тормозят секрецию гормонов передней доли гипофиза, и гормоны задней доли гипофиза традиционно называются гормонами задней доли гипофиза по месту их хранения и высвобождения, хотя на самом деле производятся гипоталамусом.
Гормоны гипоталамуса играют одну из ведущих ролей в деятельности всего человеческого организма. Вырабатываются эти гормоны в отделе головного мозга под названием гипоталамус. Без исключения все эти вещества являются пептидами. При этом все эти гормоны различают трех видов: рилизинг-гормоны, статины и гормоны задней доли гипофиза. В подкласс рилизинг-гормонов гипоталамуса входят следующие гормоны:
кортикотропин-рилизинг-гормон
соматотропин-рилизинг-гормон
тиреотропин-рилизинг-гормон
гонадотропин-рилизинг-гормон.
В подкласс гормонов задней доли гипофиза входят:
антидиуретический гормон, или вазопрессин
окситоцин
Вазопрессин и окситоцин синтезируются в гипоталамусе, а затем поступают в гипофиз. Функция регуляции секреции.
105) КАТЕХОЛАМИНЫ, группа биогенных аминов производных пирокатехина (катехола), осуществляющая регуляцию ф-ций эндокринных желез (надпочечники, щитовидная железа и др.) и передачу нервных импульсов. В первом случае катехоламины рассматривают как гормоны, во втором - как нейромедиаторы. Иногда к катехоламинам относят их синтетич. производные (см. Адреномиметические средства). К биогенным катехоламинам относятся дофамин (ф-ла I; R = R' =Н), L-норадреналин (I; R=ОН, R'=Н) и L-адреналин (I; R=ОН, R'=СН3). Осн. ф-ция дофамина-стимуляция секреции соматотропина (гормона роста) и подавление секреции пролактина (гормона, стимулирующего рост молочных желез, лактацию и др.). Известно также стимулирующее влияние дофамина на гликогенолиз, уровень глюкозы в крови, диурез, кровоток в почках. Нарушение синтеза дофамина в мозгу - причина возникновения болезни Паркинсона. Дофамин выделяется из пресинаптич. окончаний и действует на постсинаптич. рецепторы, к-рые либо активируют фермент адепилатцтлазу (рецепторы типа Д-1), либо оказывают на аденилатцик-лазу ингибирующее влияние и повышают уровень внутриклеточного Са2+ в результате активации фосфоинозитидного обмена (гидролиза полифосфоинозитидов до диацил-глицерина и инозитолфосфатов) или открывания рецепторрегулируемых Са-каналов (рецепторы Д-2). Все биол. эффекты дофамина связаны с его участием в регуляции фос-форилирования внутриклеточных белков. Биосинтез дофамина осуществляется из фенилаланина через тирозин (II) по схеме:
Лимитирующая стадия - синтез дигидроксифенилаланина (ДОФА), к-рая катализируется ферментом тирозингидроксилазой. Последняя активируется Са2+, поэтому факторы, повышающие концентрацию Са2+ в аксоплазме (часть цитоплазмы нейрона, входящая в состав аксона), ускоряют синтез дофамина. Стадия превращения ДОФА в дофамин катализируется декарбоксилазой ароматич. L-аминокислот. Дофамин накапливается гл. обр. в разл. отделах центр, нервной системы. В аксонах симпатич. нервных волокон и в мозговом слое надпочечников дофамин - промежут. метаболит. В этих тканях он при участии b-гидроксилазы гидроксилируется до L-норадреналина. Последний в мозговом слое надпочечников при участии фениламиноэтанол-N-метилтрансферазы и источника метильных групп S-аденозилметионина превращ. в L-адреналин. Нервные импульсы, идущие по симпатич. волокнам, приводят к выбросу L-норадреналина из пресинаптич. мембраны этих волокон и рецепции нейромедиатора на постсинаптич. мембране. В мозговом слое надпочечников секреция этих катехоламинов вызывается путем возбуждения, приходящего по чревному нерву. При этом в кровь поступают преим. L-адреналин и малые кол-ва L-норадреналина. Рецепторы этих катехоламинов есть практически во всех тканях человека и животных. L-Норадреналин взаимод. преим. с a-, a L-адреналин - с a- и b-адренергич. рецепторами. Через a-рецепторы (активируют фосфоинозитидный обмен) осуществляются вазоконстрикторные эффекты катехоламинов (приводят к сужению кровеносных сосудов), стимулируется гликогенолиз, секреция адренокортикотропина, инсулина, ренина и др. физиологически активных в-в. Через b-рецепторы (активируют аденилатциклазу) катехоламины уменьшают периферич. сопротивление сосудов, стимулируют гликогенолиз, липолиз и белковый обмен, повышают частоту и силу сердечных сокращений. Активация синтеза катехоламинов-типичная р-ция на стресс (напр., у животных концентрация адреналина в крови под влиянием страха может возрастать в 100 раз за неск. с); их роль заключается в мобилизации организма на осуществление активной мозговой и мышечной деятельности. Важнейшую роль катехоламины играют также в поддержании гомеостаза (постоянства состава внутр. среды и устойчивости осн. физиол. ф-ций) и адаптации организма. Удаление катехоламинов из синаптич. щели происходит путем обратного захвата в пресинаптич. окончания. Этот активный транспорт происходит с использованием энергии градиента Na+ на мембране. Часть катехоламинов диффундирует из синапса в межклеточное пространство и затем поступает в кровь. Инактивируются катехоламины путем окислит, дезаминирования, катализируемого катехол-О-метилтрансферазой. Метаболиты катехоламинов удаляются из организма почками, поэтому их содержание в моче может указывать на активность симпатич. нервной системы и мозгового слоя надпочечников. Нарушения в метаболизме, секреции и обратном
захвате катехоламинов-причина мн. патологич. процессов. Препараты, воздействующие на обмен катехоламины и их рецепцию (напр., пропранолол, ф-ла III), широко используют для лечения ряда заболеваний человека.
106. Производные аминокислот:
-производные тирозина: тироксин, трийодтиронин, дофамин, адреналин, норадреналин;
-производные триптофана: мелатонин, серотонин; -производные гистидина: гистамин.
107.Пептидные гормоны - наиболее многочисленный и разнообразный по составу и вариабельный в сравнительно-биологическом плане класс гормональных соединений. По особенностям химической структуры, свойств и физиологическим функциям входящих в него гормонов этот класс можно разделить на семейства:
1) нейрогипофизарных пептидов ;
2) гипоталамических пептидных рилизинг-факторов ;
3) ангиотензинов ;
4) олигопептидных гипофизарных гормонов ряда АКТГ ;
5) олигопептидных гормонов типа глюкагона и гормонов желудочно- кишечного тракта ; 6) инсулина ;
7) полипептидных гормонов, регулирующих обмен кальция , и полипептидных гормонов, регулирующих обмен фосфора ;
8) одноцепочечных (мономерных) белково-пептидных гормонов ряда СТГ ;
9) димерных гликопротеидных гормонов .
Предполагается, что представители каждого из большинства перечисленных семейств возникли на самых ранних стадиях эволюции позвоночных из общего гормонального предшественника путем серий последовательных мутаций и дупликаций кодирующего гена, а также ассоциаций модифицированных генов в более крупные.
Это предположение не относится к семейству паратгормона и кальцитонина . В основе типологии гормонов в указанном случае лежит не эволюционно-структурный принцип, а направленность их физиологических эффектов.
К пептидным гормонам относятся также эритропоэтин , гормоны тимуса , соматомедины , некоторые нейросекреторные гормоны насекомых и т.д.
Анализ функциональных свойств различных участков пептидной цепи нейрогипофизарных гормонов показал, что за связывание их с рецепторами соответствующих органов-мишеней ответственна кольцевая часть молекулы гормона и прежде всего аминокислота, стоящая в 3-м положении.
Очевидно, наличие в 3-м положении Фен обеспечивает наилучшее связывание пептидов преимущественно вазопрессиновыми рецепторами клеток экскреторных органов и артериол. Наличие в том же положении изолейцина обусловливает наибольшее сродство гормона к окситоциновым рецепторам клеток миометрия (гладкомышечного слоя матки) и миоэпите- лиальных образований молочных желез. Однако оба типа кольцевой части все же могут связываться, хотя и с разной степенью интенсивности, с обоими типами рецепторов и конкурировать друг с другом за связывание. По- видимому, структура всей 1-6-петли нейрогипофизарных пептидов ответственна за принципиальную возможность гормон-рецепторного взаимодействия, а остатки в 3-й позиции петли определяют силу данного взаимодействия с тем или иным типом рецепторов и специфику эффекта. Роль актона , по существующим представлениям, выполняют боковая цепь и остаток тирозина во 2-м положении.
В настоящее время основными направлениями развития исследований белково - пептидных гормонов являются:
1) изучение тонкой структурно - функциональной организации генов и мРНК, кодирующих белково - пептидные гормоны млекопитающих, выявление основных регуляторных элементов этих генов, анализ их структуры и механизмов тканеспецифичной мультигормональной (мультифакторной) регуляции.
2) изучение генов и мРНК, кодирующих факторы белковой природы, которые регулируют экспрессию данных белково - пептидных гормонов млекопитающих, анализа их структуры и механизмов взаимодействия с регуляторными участками промоторных областей генов белково - пептидных гормонов;
3) исследование структурно - функциональной организации самих белково - пептидных гормонов, выявление функциональной значимости отдельных аминокислотных доменов, выяснение закономерных взаимосвязей между аминокислотной последовательностью и функциональной активностью; 4) выяснение молекулярных механизмов действия белково -пептидных гормонов в клетке - мишени, расшифровка цепи молекулярных сигналов, реализующих воздействие пептидного гормонва с поверхности мембранного рецептора клетки на ген, локализованный в хромосоме.
ЧАСТЬ В
1. Витамин А (ретинол)
Правильное химическое название витамина А — ретинол. Он обнаружен в продуктах животного происхождения. Пигмент каротин (оранжевого цвета), присутствующий в моркови, и схожие пигменты, называемые каротинами, часто встречающиеся в растениях, могут преобразовываться в витамин А в процессе пищеварения. Структура каротинов и витамина А особенно хорошо адаптирована для поглощения света, как в растениях в форме каротинов, так и у животных, у которых витамин А превращается в светопоглощающую молекулу ретиналь. Три группы животных, у которых имеются глаза (моллюски, членистоногие и позвоночные), используют ретиналь в качестве светопоглощающей части фоторецепторных молекул. Свет вызывает довольно большие изменения в структуре ретиналя, достаточные для генерации нервного импульса.
Помимо этого витамин А играет важную роль в сохранении нормального состояния кожи и других эпителиальных (поверхностных) тканей, а маленьким детям он требуется для нормального роста.
Гиповитаминоз А.
Дефицит витамина А приводит к нарушению темновой адаптации (иными словами, нарушает работу палочек, реагирующих на интенсивность света). На первых порах возникает так называемая «куриная слепота», когда человек не видит в сумерках. Это состояние развивается в условиях недостатка ретиналя в палочках. В конечном счете палочки разрушаются. Одновременно возникает сухость конъюнктивы и роговицы (ксерофтальмия; xeros — сухой, ophthalmos — глаз), и нарушаются их функции. На роговице появляются язвы (кератомаляция) и как следствие этого — слепота.
При дефиците витамина А у детей замедляется их рост. Продолжительный дефицит этого витамина может привести к смерти. Подобная картина все еще характерна для некоторых развивающихся стран, где из-за недостатка витамина А у детей нередко наступает слепота. Около 3 млн. детей в возрасте до 10 лет в этих странах слепы именно по этой причине. У человека витамин А хранится в печени, в которой при условии полноценной диеты существует примерно двухлетний его запас. По рекомендации британских диетологов среднесуточное потребление этого витамина должно в два раза превышать потребности организма в нем.
Гипервитаминоз А
Известны редкие случаи отравления, явившиеся результатом приема избыточного количества витамина А. Обычно это бывает при длительном употреблении витаминных препаратов. Проявляется гипервитаминоз А в ломкости костей, выпадении волос, двоении в глазах, рвоте и других осложнениях. Прием большого количества (более 3300 мкг в день) витамина А во время беременности может привести к возникновению врожденных пороков развития у детей. В Соединенном Королевстве беременным женщинам не рекомендуют принимать витамины, содержащие витамин А, без консультации с врачом.
Суточное потребление при регулярном приеме не должно превышать 6000 мкг для подростков, 7500 мкг — для взрослых женщин и 9000 мкг для взрослых мужчин.
2. Витамин Д
Витамины группы D образуются под действием ультрафиолета в тканях животных и растений из стеринов.
витамин D2 - эргокальциферол; выделен из дрожжей, его провитамином является эргостерин;
витамин D3 - холекальциферол; выделен из тканей животных, его провитамин - 7-дегидрохолестерин;
витамин D4 - 22, 23-дигидро-эргокальциферол;
витамин D5 - 24-этилхолекальциферол (ситокальциферол); выделен из масел пшеницы;
витамин D6 - 22-дигидроэтилкальциферол (стигма-кальциферол). Действие
Основная функция витамина D - обеспечение нормального роста и развития костей, предупреждение рахита и остеопороза. Он регулирует минеральный обмен и способствует отложению кальция в костной ткани и дентине, таким образом, препятствуя остеомаляции (размягчению) костей.
Поступая в организм, витамин D всасывается в проксимальном отделе тонкого кишечника, причем обязательно в присутствии желчи. Часть его абсорбируется в средних отделах тонкой кишки, незначительная часть - в подвздошной. После всасывания кальциферол обнаруживается в составе хиломикронов в свободном виде и лишь частично в форме эфира. Биодоступность составляет 60-90%.
Витамин D влияет на общий обмен веществ при метаболизме Ca2+ и фосфата (НРО2-4). Прежде всего, он стимулирует всасывание из кишечника кальция, фосфатов и магния. Важным эффектом витамина при этом процессе является повышение проницаемости эпителия кишечника для Ca2+ и Р.
Витамин D является уникальным - это единственный витамин, действующий и как витамин, и как гормон. Как витамин он поддерживает уровень неорганического Р и Са в плазме крови выше порогового значения и повышает всасывание Са в тонкой кишке.
В качестве гормона действует активный метаболит витамина D - 1,25-диоксихолекациферол, образующийся в почках. Он оказывает влияние на клетки кишечника, почек и мышц: в кишечнике стимулирует выработку белка-носителя, необходимого для транспорта кальция, а в почках и мышцах усиливает реабсорбцию Ca++.
Витамин D3 влияет на ядра клеток-мишеней и стимулирует транскрипцию ДНК и РНК, что сопровождается усилением синтеза специфических протеидов.
Однако роль витамина D не ограничивается защитой костей, от него зависит восприимчивость организма к кожным заболеваниям, болезням сердца и раку. В географических областях, где пища бедна витамином D, повышена заболеваемость атеросклерозом, артритами, диабетом, особенно юношеским.
Он предупреждает слабость мускулов, повышает иммунитет (уровень витамина D в крови служит одним из критериев оценки ожидаемой продолжительной жизни больных СПИДом), необходим для функционирования щитовидной железы и нормальной свертываемости крови.
Так, при наружном применении витамина D3 уменьшается характерная для псориаза чешуйчатость кожи.
Есть данные, что, улучшая усвоение кальция и магния, витамин D помогает организму восстанавливать защитные оболочки, окружающие нервы, поэтому он включается в комплексную терапию рассеянного склероза.
Витамин D3 участвует в регуляции артериального давления (в частности, при гипертонии у беременных) и сердцебиения.
Витамин D препятствует росту раковых и клеток, что делает его эффективным в профилактике и лечении рака груди, яичников, предстательной железы, головного мозга, а также лейкимии.
3. Витамин E жирорастворимый, накапливается в печени, жировых тканях, в сердце, мышцах, яичках, матке, крови, надпочечниках и гипофизе. Токоферол объединяет ряд ненасыщенных спиртов-токоферолов, из которых наиболее активным является альфа-токоферол.
Действие: витамин Е улучшает циркуляцию крови, необходим для регенерации тканей, полезен при предменструальном синдроме и лечении фиброзных заболевания груди. Он обеспечивает нормальную свертываемость крови и заживление, снижает возможность образования шрамов от некоторых ран, снижает кровяное давление, способствует предупреждению катаракт, улучшает атлетические достижения, снимает судороги ног, поддерживает здоровье нервов и мускулов, укрепляя стенки капилляров, предотвращает анемию. В качестве антиоксиданта витамин Е защищает клетки от повреждения, замедляя окисление липидов (жиров) и формирование свободных радикалов. Он защищает другие растворимые жирами витамины от разрушения кислородом, способствует усвоению витамина А и защищает его от кислорода. Витамин Е замедляет старение, может предотвращать появление старческой пигментации. Витамин Е участвует в формировании коллагеновых и эластичных волокон межклеточного вещества. Токоферол предотвращает повышенную свертываемость крови, благоприятно влияет на периферическое кровообращение, участвует в биосинтезе гема и белков, пролиферации клеток, образовании гонадотропинов, развитии плаценты. Витамина Е способен облегчать болезнь Альцгеймера и диабет, а также улучшать иммунную функцию организма. Витамин E играет профилактическую роль - он не может восстановить уже имеющееся повреждение. Эффективность витамина Е повышается в присутствии других питательных веществ-антиоксидантов. Его противораковое защитное действие особенно заметно повышает витамин С.
Взаимодействие: если вы на диете, с высоким содержанием полиненасыщенных масел, вам может понадобиться витамин Е. Неограниченное железо разрушает витамин Е, так что их не следует принимать вместе. Глюконат, пептонат, цитрат или фумерат железа не разрушают витамин Е.
Симптомы дефицита витамина E: первым и наиболее ранним признаком, проявляющимся довольно быстро при недостаточном поступлении с пищей витамина Е и избыточном поступлении ненасыщенных жирных кислот, является мышечная дистрофия. Дистрофия скелетных мышц считается наиболее универсальным проявлением авитаминоза Е. Наиболее тяжелые поражения отмечаются в диафрагме. Мышечные волокна подвергаются распаду, а в некротизированных волокнах откладываются соли кальция. В печени при авитаминозе Е описаны некрозы, жировая дистрофия, расширение синусоидов, уменьшение содержания гликогена. Недостаточность также может провоцировать сокращение длительности жизни красных кровяных клеток (эритроцитов). Исследования на животных доказывают, что при дефиците витамина Е могут также страдать сердечная мышца и репродуктивные функции организма.
Польза: помогает выглядеть моложе, замедляя старение клеток; защищает легкие от загрязненного воздуха; защищает клеточные структуры от разрушения свободными радикалами (действует как антиоксидант); предупреждает появление и растворяет кровяные тромбы; ускоряет заживление ожогов; действуя как мочегонное средство, может понижать кровяное давление; предохраняет от выкидышей; поддерживает иммунитет; обеспечивает нормальное функционирование мускулатуры.
Где содержится: растительные масла: из пшеничных зародышей, оливковое, подсолнечное, хлопковое, кукурузное, соевое; семечки яблок, миндаль, арахис, зеленые листовые овощи, злаковые, бобовые, яичный желток, печень, молоко, овсянка, соя, пшеница и ее проростки, одуванчик, люцерна, льняное семя, крапива, овес, лист малины, плоды шиповника.
Аптека корпорации «Тяньши»: Витамин Е содержится в препарате Вэйкан, который чрезвычайно богат витаминами и минералами. Вэйкан производства «Тяньши» применяют для лечения сердечно-сосудистых заболеваний, таких как инфаркт, инсульт, стенокардия, гипертоническая болезнь, варикозное расширение вен, атеросклероз.
Наилучший вариант для сохранения красоты — употреблять добавки целебных трав китайской медицины, содержащие витамины Е и С. Одной из таких добавок является Лянь Янь, которая содержит оба этих витамина в необходимом количестве. Принимая витамин С 3 раза в день по 400мг и витамин Е 3 раза в день по 200мг, 71,4% пациентов избавились от коричневых пятен за 3 месяца!
Также уникальным источником Витамина Е является - Омега-3 корпорации «Тяньши». Основные компоненты препарата: полиен, облепиховое масло, витамин Е — 1 капсула содержит 0,9г Омега-3 полиненасыщенных жирных кислот (50% суточной дозы) и 1,5мг витамина Е (10% суточной дозы).
4. Витамин РР (ниацин, никотиновая кислота)
Ниацин входит в состав ферментов, участвующих в клеточном дыхании и обмене белков, регулирующих высшую нервную деятельность и функции органов пищеварения. Используется для профилактики и лечения пеллагры, заболеваний желудочно-кишечного тракта, вяло заживающих ран и язв, атеросклероза.
При передозировке или при повышенной чувствительности могут возникать покраснение лица и верхней половины туловища, головокружение, чувство прилива к голове, крапивница. При быстром внутривенном введении возможно сильное понижение артериального давления.
Основными источниками витамина РР служат мясо, печень, почки, яйца, молоко. Содержится витамин PP также в хлебных изделиях из муки грубого помола, в крупах (особенно гречневой), бобовых, присутствует в грибах.
Суточная потребность в витамине РР взрослого человека составляет 14-18 мг; беременных и кормящих - 19-21 мг; детей первого года жизни - 5-7 мг. Витамин РР может синтезироваться в организме человека из незаменимой аминокислоты триптофана, входящей в состав белков.
Витамин РР относительно устойчив к тепловой обработке. Необходимо учитывать, что в зерновых продуктах, особенно в кукурузе, большая часть ниацина находится в связанной форме (ниацитин), эта часть витамина становится доступной только после интенсивной тепловой обработки. В бобовых и продуктах животного происхождения связанная форма отсутствует.
5. КОФЕРМЕНТЫ
Коферменты (синоним коэнзимы) — органические соединения небелковой природы, необходимые для осуществления каталитического действия многих ферментов. Соединяясь с белковой частью молекулы фермента — апоферментом, К. образуют каталитически активный комплекс — холофермент. Прочно связанные с белками К. называются простетическими группами. Многие К. легко отделяются от ферментного белка и служат переносчиками электронов, отдельных атомов или групп атомов субстрата, превращение которого катализирует данный фермент, т.е. функционируют в качестве промежуточных акцепторов. К. могут участвовать в активировании молекул субстратов, образуя с ними реакционно-способные соединения, которые затем подвергаются ферментативному превращению. Некоторые метаболиты, выступающие в ферментативных реакциях как обычные субстраты, в определенных условиях могут выполнять роль К. Многие К. являются производными витаминов, поэтому нарушение обмена веществ при витаминной недостаточности опосредовано через понижение активности определенных ферментов.
Коферменты, как правило, термостабильны, разнообразны по химическому строению и механизму действия. Наиболее распространенную группу составляют соединения нуклеотидной природы, а также К., содержащие остатки фосфорной кислоты. Адениловые нуклеотиды наряду с их ключевой ролью в обмене энергии (см. Макроэргические соединения, Обмен веществ и энергии) в качестве К. участвуют в реакциях переноса и активации орто- и пирофосфатных остатков, аминоацильных групп, остатков неорганических кислот. В группу адениловых нуклеотидов входят аденозинфосфорные кислоты — нуклеотиды, содержащие аденин, рибозу и остатки фосфорной кислоты (АДФ и АМФ). В подобных реакциях могут участвовать в качестве К. также производные инозин-5'-фосфорной и гуанозин-5'-фосфорной кислот. Гуаниловые рибонуклеотиды (гуанозин-5'-моно-, ди- и трифосфорные кислоты) выполняют роль К. в реакциях переноса сукцинильной группы, при биосинтезе рибонуклеопротеинов в микросомах, биосинтезе адениловой кислоты из инозиновой кислоты и др. Цитидиловые рибонуклеотиды (цитидил-5'-моно-, ди- и трифосфорные кислоты) играют роль К. при биосинтезе фосфолипидов, участвуя в переносе остатков, образующих полярные «головки» молекул фосфолипидов (0-фосфоэтанолхолина, 0-фосфоэтаноламина и др.). Уридиловые рибонуклеотиды (уридин-5'-моно, ди- и трифосфорные кислоты) участвуют в качестве К. в процессах трансгликозилирования (переноса остатков простых сахаров и их производных) при биосинтезе ди- и полисахаридов, гликозаминогликанов и реакциях взаимопревращения сахаров.
К важнейшим К. нуклеотидной природы относятся никотинамидные К. никотинамидадениндинуклеотид (НАД, NAD+; синоним: дифосфопиридиннуклеотид, ДПН; устаревшее кофермент I, Kol, козимаза, кодегидр (оген)аза I] и его фосфорилированное производное никотинамидадениндинуклеотидфосфат [НАДФ, NADP+; синоним: трифосфопиридиннуклеотид, ТПН; устаревшее кофермент II, KoII, фосфокозимаза, фосфокодегидр(оген)аза]. Никотинамидные К. входят в состав ряда дегидрогеназ — катализаторов ключевых окислительно-восстановительных реакций энергетического и пластического обмена. Молекула НАД представляет собой динуклеотид, построенный из аденинрибонуклеотида и никотинамидрибонуклеотида (последний отвечает за проявление каталитической активности НАД), связанных фосфоангидридным мостиком, а НАДФ имеет третий остаток фосфорной кислоты в положении 2' рибозы аденилового нуклеотида. Способность НАД и НАДФ переносить электроны и протоны от окисляемого субстрата к другому акцептору обеспечивает выполнение этими К. важной биологической функции в процессе клеточного дыхания (см. Дыхание тканевое). Окислительно-восстановительные реакции, протекающие с участием никотинамидных К., могут быть изображены в виде общего уравнения; АН2 + НАД(Ф)+ = А + НАД(Ф)Н + Н+, где АН2 восстановленная форма субстрата. А — окисленная форме субстрата. Эти реакции состоят в обратимом переносе двух восстановительных эквивалента от субстрата к окисленному никотинамидному К. Один восстановительный эквивалент присутствует в восстановленном К. в виде атома водорода, другой — в виде электроне, при этом катион второго атома водорода переходит в среду а виде свободного Н+. Обнаружено около 350 НАД(Ф)-зависимых дегидрогеназ, как правило, специфичных в отношении либо НАД, либо НАДФ. Обычно связь никотинамидных и других нуклеотидных К. с белками легко диссоциирует. НАД-зависимые дегидрогеназы участвуют преимущественно в процессах катаболизма (например, в клеточном дыхании), в НАДФ-зависимые — главным образом в анаболических процессах (восстановительных биосинтетических реакциях). Содержание никотинамидных К., соотношение между их окисленными и восстановленными формами (НАДН и НАДФН), к также величию отношения НАД/НАДФ являются показателями активности метаболических процессов в ткани, характеризуют ее функциональное состояние. В организме НАД и НАДФ синтезируются из никотиновой кислоты (ниацина, или витамина РР) или никотинамида, поэтому недостаточность ниацина ведет к нарушению биосинтеза никотинамидных коферментов.
5. Флавиновые коферменты ФМН (FMN) и ФАД (FAD) (2, см. с. 86) найдены в дегидрогеназах, оксидазах и монооксигеназах. Обычно оба соединения ковалентно связаны с ферментами. Активной группой обоих коферментов является флавин (изоаллоксазин), имеющий сопряженную систему из трех колец, которая может при восстановлении принимать два электрона и два протона. В ФМН к флавину присоединен фосфорилированный полиол рибит. ФАД состоит из ФМН, связанного с АМФ. Оба соединения являются функционально близкими коферментами.
8.КоА Ацетил коэнзим А или ацетил-КоА – важное соединение в обмене веществ, используемое во многих биохимических реакциях. Его главная функция – доставлять атомы углерода с ацетил-группой в цикл трикарбоновых кислот, чтобы те были окислены с выделением энергии. По своей химической структуре ацетил-КоА – тиоэфир между коферментом А (тиолом) и уксусной кислотой (носителем ацильной группы). Ацетил-КоА образуется во время второго шага кислородного клеточного дыхания, декарбоксилирования пирувата, который происходит в матриксе митохондрии. Ацетил-КоА затем поступает в цикл трикарбоновых кислот.
Ацетил-КоА – важный компонент биологического синтеза нейротрансмиттера ацетилхолина. Холин, в соединении с ацетил-КоА, катализируется ферментом холинацетилтрансферазой, чтобы образовать ацетилхолин и коэнзим А.
9. Пантотеновая кислота, пантотенат (лекарственная форма — пантотенат кальция, также витамин B3, B5. Пантотеновая кислота по химической природе является дипептидом и состоит из остатков аминокислоты β-аланина и пантоевой кислоты.
Пантотеновая кислота получила свое название от греческого «пантотен», что означает «всюду», из-за чрезвычайно широкого её распространения. Пантотеновая кислота, попадая в организм, превращается в пантетин, который входит в состав кофермента А, который играет важную роль в процессах окисления и ацетилирования. Кофермент А — одно из немногих веществ в организме, участвующее в метаболизме и белков, и жиров, и углеводов.
Пантонетовая кислота требуется для обмена жиров, углеводов, аминокислот, синтеза жизненно важных жирных кислот, холестерина, гистамина, ацетилхолина, гемоглобина. Пантотеновая кислота чувствительна к нагреванию, при термической обработке теряется почти 50 % витамина. В клетках животных и растений пантотеновая кислота входит в состав кофермента A (KoA), принимающего участие в важнейших реакциях обмена веществ.
Важнейшим свойством витамин пантотеновой кислоты является ее способность стимулировать производство гормонов надпочечников — глюкокортикоидов, что делает его мощным средством для лечения таких заболеваний как артрит, колит, аллергия и болезни сердца. Витамин играет важную роль в формировании антител, способствует усвоению других витаминов, а также принимает участие в синтезе нейротрансмиттеров.
Пантотеновая кислота участвует в метаболизме жирных кислот. Она нормализует липидный обмен и активирует окислительно-восстановительные процессы в организме.
Пантотеновая кислота оказывает значительное гиполипидемическое действие, обусловленное, по-видимому, ингибированием биосинтеза основных классов липидов, формирующих в печени липопротеины низкой и очень низкой плотности.
10. Тиами́н (витамин B1; старое название — аневрин) — водорастворимый витамин, соединение, отвечающее формуле C12H17N4OS. Бесцветное кристаллическое вещество, хорошо растворимое в воде, нерастворимое в спирте. Разрушается при нагревании.
Известный как витамин B1 тиамин играет важную роль в процессах метаболизма углеводов и жиров. Вещество необходимо для нормального протекания процессов роста и развития и помогает поддерживать надлежащую работу сердца, нервной и пищеварительной систем. Тиамин, являясь водорастворимым соединением, не запасается в организме и не обладает токсическими свойствами. В природе тиамин синтезируется растениями и многими микроорганизмами. Животные и человек не могут синтезировать тиамин и получают его вместе с пищей. В тиамине нуждаются все животные за исключением жвачных, так как бактерии в их кишечнике синтезируют достаточное количество витамина.
Всасываясь из кишечника, тиамин фосфорилируется и превращается в тиаминпирофосфат.
Тиаминпирофосфат (ТПФ) — активная форма тиамина — является коферментом пируватдекарбоксилазного и α-кетоглутаратдекарбоксилазного комплексов, а также транскетолазы. Первые два фермента участвуют в метаболизме углеводов, транскетолаза функционирует в пентозофосфатном пути, участвуя в переносе гликоальдегидного радикала между кето- и альдосахарами. ТПФ синтезируется ферментом тиаминпирофосфокиназой, главным образом в печени и в ткани мозга. Реакция требует присутствия свободного тиамина, ионов Mg2+ и АТФ. Также ТПФ выступает коферментом дегидрогеназы γ-оксиглутаровой кислоты и пируватдекарбоксилазы клеток дрожжей.
Другими производными тиамина являются:
Тиаминтрифосфат, обнаружен у бактерий, грибов, растений и животных[1], у E. coli играет роль сигнальной молекулы при ответе на аминокислотное голодание[2].
Аденозинтиаминдифосфат — накапливается у E. coli в результате углеродного голодания[3].
Аденозинтиаминтрифосфат — присутствует в небольших количествах в печени позвоночных, функция его неизвестна[
11. Витамин B6 — собирательное название производных 3-гидрокси-2-метилпиридинов, обладающих биологической активностью пиридоксина[1] — собственно пиридоксин, пиридоксаль, пиридоксамин, а также их фосфаты, среди которых наиболее важен пиридоксальфосфат.
Различные формы в организме человека превращаются в пиридоксальфосфат — кофактор ферментов, которые катализируют декарбоксилирование и трансаминирование аминокислот.
Витамин B6 (пиридоксин, пиридоксаль, пиридоксамин) содержится во многих продуктах. Особенно много его содержится в зерновых ростках, в грецких орехах и фундуке, в шпинате, картофеле и батате, моркови, цветной и белокочанной капусте, помидорах, клубнике, черешне, апельсинах и лимонах, авокадо. Также он содержится в мясных и молочных продуктах, рыбе, яйцах, крупах и бобовых. Витамин B6 (пиридоксин, пиридоксаль, пиридоксамин) синтезируется в организме кишечной микрофлорой. Пиридоксин
Основная статья: Пиридоксин
Пиридоксин
Пиридоксин представляет собой бесцветные кристаллы, растворимые в воде. В большинстве съедобных растений пиридоксина нет, или он встречается в незначительных количествах. Но существуют растения, например, питайя, исключительно богатые пиридоксином. Пиридоксин синтезируется некоторыми бактериями. Также он содержится в мясных и молочных продуктах, но он менее устойчив к высоким температурам, чем другие формы витамина B, поэтому в варёных и жареных мясных продуктах его мало. Вегетарианцы могут получить пиридоксин из кожицы некоторых овощей, в которых имеются остатки почвы, например, картофеля, моркови. Регистрационный номер CAS 65-23-6, для соли (гидрохлорида) 58-56-0. Имеются данные, что избыточные дозы пиридоксина могут привести к токсическому эффекту.
Пиридоксаль
Брутто-формула пиридоксаля C8H9NO3. Пиридоксаль отличается от пиридоксина тем, что вместо одной из трёх гидроксогрупп к пиридиновому кольцу присоединена карбонильная группа, так что пиридоксаль является одновременно и альдегидом. Молярная масса 0.16716 кг/моль. Представляет собой кристаллический порошок, плавящийся при 165 °C. Пиридоксаль содержится в зелёных частях некоторых растений, в цветной и белокочанной капусте, в мясе. Регистрационный номер CAS 66-72-8, для соли (гидрохлорида) 65-22-5.
Пиридоксамин
Пиридоксамин отличается от пиридоксина тем, что вместо одной из трёх гидроксогрупп к пиридиновому кольцу присоединена аминогруппа. Пиридоксамин содержится в мясе животных. Также пиридоксамин сдержится в некоторых пищевых добавках. Также в некоторых добавках содержится его соль — дигидрохлорид пиридоксамина. Однако в США в 2009 году FDA постановила, что отныне пиридоксамин считается лекарством, и его нельзя вносить в пищевые добавки. Регистрационный номер CAS 85-87-0 Пиридоксальфосфат
Пиридоксальфосфат образуется в организме человека из любого из трёх вышеуказанных веществ. Пиридоксальфосфат может быть получен через пищу в готовом виде из мяса животных. Он также может быть синтезирован искусственно химическим путём. Регистрационный номер CAS 54-47-7.
Пиридоксальфосфат является коферментом большого числа ферментов азотистого обмена (трансаминаз, декарбоксилаз аминокислот) и других ферментов.
Пиридоксальфосфат:
принимает участие в образовании эритроцитов;
участвует в процессах усвоения нервными клетками глюкозы;
необходим для белкового обмена и трансаминирования аминокислот;
принимает участие в обмене жиров;
оказывает гипохолестеринемический эффект;
оказывает липотропный эффект, достаточное количество пиридоксина необходимо для нормального функционирования печени.
14. Вещества, которые оказывают влияние на активность ферментов, называют эффекторами. Это могут быть ингибиторы – соединения, тормозящие каталитический процесс, или активаторы – вещества, которые этот процесс ускоряют. Учение об ингибиторах ферментов имеет большое теоретическое и практическое значение для фармакологии и токсикологии. Многие лекарственные препараты являются ингибиторами ферментов. Например, ингибиторы амилаз успешно применяются для лечения заболеваний, связанных с повышенной активностью этих ферментов – диабета, ожирения, кариеса. Используемые в военном деле нервно-паралитические газы представляют собой специфические ингибиторы ферментов. В научных исследованиях специфические ингибиторы используются для изучения механизма действия ферментов, строения их активного центра. Например, многие из промежуточных продуктов гликолиза и дрожжевого брожения были открыты благодаря использованию ингибиторов, блокирующих последовательные стадии процесса. В результате такого блокирования соответствующие промежуточные продукты накапливались в количествах, достаточных для их выделения и идентификации.
По типу действия ингибиторы можно разделить на обратимые и необратимые. Удаление обратимых ингибиторов из системы (диализом, гельфильтрацией и др.) восстанавливает каталитическую активность фермента.
Обратимо действуют эффекторы:
1. Близкие аналоги субстрата, которые связываются активным центром фермента, но
не подвергаются превращению. Занимая активный центр, они препятствуют связыванию истинного субстрата, конкурируя с ним, и поэтому называются конкурентными ингибиторами.
2. Кофакторы ферментов, без которых апофермент вообще не обладает активностью.
Постепенное добавление их приводит к появлению активности, которая затем повышается до определенного предела, соответствующего полному насыщению.
3. Вещества, которые взаимодействуют с дополнительными, регуляторными центрами, несовпадающими с активным центром. Тем не менее, это взаимодействие изменяет конформацию в районе активного центра и влияет на кинетику ферментативного процесса. Такие соединения называются аллостерическими эффекторами. Они имеют важное биологическое значение, так как с их помощью осуществляется один из механизмов регуляции каталитической активности.
Необратимую инактивацию вызывают соединения (найденные в живой природе или полученные путем синтеза), которые вступают в химическую реакцию с участком фермента, важным для проявления каталитической активности. Такие соединения, специфически реагирующие с определенными группами в молекулах ферментов (групп-специфические реагенты), используют для идентификации функциональных групп активного центра (метод химической модификации).
С этой целью широко используются соединения, блокирующие SH-группы (иодацетамид, n-хлормеркурибензоат и др.), окисляющие остатки триптофана в кислой среде (N-бромсукцинимид), ацетилирующие остатки тирозина (N-ацетилимидазол), связывающие металлы (азид натрия) и т.д.
15. ПРОТЕОЛИТИЧЕСКИЕ ФЕРМЕНТЫ
ПРОТЕОЛИТИЧЕСКИЕ ФЕРМЕНТЫ (протеазы), ферменты класса гидролаз, катализирующие гидролиз (протео-лиз) пептидных связей. Место расщепления пептидной связи в полипептидной цепи определяется позиционной и субстратной специфичностью фермента и пространств. структурой гидролизуемого субстрата (белка или пептида).
Различают экзопептидазы, расщепляющие связи вблизи С- или N-конца цепи (соотв. карбоксипептидазы и аминопеп-тидазы)и эндопептидазы (протеиназы), гидролизующие связи, удаленные от концевых остатков (напр., трипсин). Лишь ограниченное число протеолитических ферментов обладает строгой субстратной специфичностью. К ним относят, напр., ренин, гидроли-зующий связь между остатками лейцина в положениях 10 и 11 в ангиотензиногене (предшественник ангиотензина пептида, участвующего в регуляции кровяного давления), или энтеропептидазу отщепляющую N-концевой гексапептид в трипсиногене (предшественник трипсина). Специфичность большинства протеолитических ферментов определяется в осн. структурой аминокислотного остатка, расположенного рядом с расщепляемой связью. Ферменты трипсинового типа катализируют гидролиз связей, образованных карбоксильной группой основных аминокислот (остатками лизина и аргинина). Для мн. ферментов (химотрипсин, пепсин, субтилизины и др.) важно наличие вблизи расщепляемой связи объемистых гидрофобных остатков (фенилаланина, тирозина, триптофана и лейцина). Протеолитические ферменты типа эластазы (фермент поджелудочной железы) гидролизуют связи, образованные аминокислотными остатками с небольшой боковой группой (напр., остатками аланина и серина). Место расщепления зависит от расположения пептидной связи в пространств. структуре субстрата-легче всего гидролизуются связи на р-изгибах цепи, к-рые расположены на пов-сти молекулы. Углеводные цепи в гликопротеинах могут препятствовать доступу фермента к данной связи.
Многие протеолитические ферменты прочно ассоциированы с клеточными мембранами и поэтому действуют только на определенные белки (т. наз. компартментализация). К ним относят, напр., сигнальные протеазы, участвующие в транспорте белков во внеклеточное пространство. В зависимости от локализации фермента протеолиз происходит при разл. рН. Так, протеолитические ферменты желудка (напр., пепсин, гастриксин) функционируют при рН 1,5-2, лизосомные ферменты-при рН 4-5, а протеолитические ферменты сыворотки крови, тонкого кишечника и др.-при нейтральных или слабощелочных значениях рН. Нек-рые протеолитические ферменты используют в качестве кофактора ионы металлов-Са2+, Mg2+ и др.
Дефектные и чужеродные белки деградируют в клетке при участии АТФ-зависимой системы протеолиза. У эукариот (все организмы, кроме бактерий и синезеленых водорослей) эта система включает низкомол. белок убикитин, образующий с белками-субстратами конъюгат, и протеазы, расщепляющие этот конъюгат.
Протеолитические ферменты играют важную роль во мн. процессах, происходящих в организме, напр. при оплодотворении, биосинтезе белка, свертывании крови и фибринолизе, иммунном ответе (активации системы комплемента), гормональной регуляции. Во мн. этих случаях фермент расщепляет в субстрате лишь одну или неск. связей (ограниченный протеолиз). Активность протеолитических ферментов регулируется на посттрансляц. стадии путем активации их неактивных предшественников (зи-могенов), а также действием прир. ингибиторов ферментов (a2-макроглобулина, a1антитрипсина, секреторного панк-реатич. ингибитора и др.). Нарушения механизмов регуляции активности протеолитических ферментов-причина мн. тяжелых заболеваний (мышечной дистрофии, аутоиммунных заболеваний, эмфиземы легких, панкреатитов и др.).
Протеолитические ферменты применяют в медицине, напр. для коррекции нарушений пищеварения, заживления ран и ожогов и др. Их также используют для получения смесей аминокислот, применяемых для парэнтерального питания, в произ-ве гормональных препаратов и нек-рых антибиотиков, в пищ. и кожевенной пром-сти, произ-ве моющих ср-в.
