- •Реакции гидрогалогенирования
- •Гидратация
- •Применение
- •1. Углеродной цепи
- •2. Положения функциональной группы
- •19) Фено́лы — органические соединения ароматического ряда, в молекулах которых гидроксильные группы связаны с атомами углеродаароматического кольца. По числу он-групп различают:
- •1. Реакции с участием гидроксильной группы
- •[Править]2. Реакции с участием бензольного кольца
- •1 Реакции присоединения
- •Классификация
15) Алки́ны (иначе ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации.
Для алкинов характерны реакции присоединения. В отличие от алкенов, которым свойственны реакции электрофильного присоединения, алкины могут вступать также и в реакции нуклеофильного присоединения. Это обусловлено значительным s-характером связи и, как следствие, повышенной электроотрицательностью атома углерода. Кроме того, большая подвижность атома водорода при тройной связи обуславливает кислотные свойства алкинов в реакциях замещения.
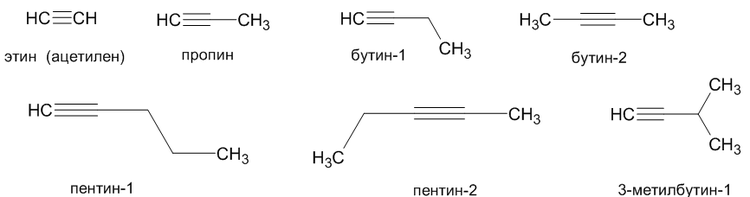
Простейшим алкином является этин (ацетилен C2H2). По номенклатуре IUPAC названия алкинов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ин»; положение тройной связи указывается арабскими цифрами.
Углеводородные радикалы, образованные от алкинов имеют суффикс «-инил», так CH≡C- называется «этинил».
Ниже
представлены некоторые представители
алкинов и их названия:
Реакции галогенирования
Алкины способны присоединять одну или две молекулы галогена с образованием соответствующих галогенпроизводных:
![]()
![]()
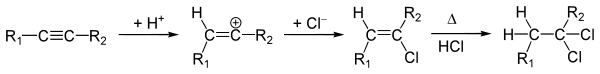
Реакции гидрогалогенирования
Присоединение хлороводорода и бромоводорода к алкинам происходит по аналогии с алкенами. Реакция идет в две стадии: сперва образуется галогеналкен, который далее переходит в дигалогеналкан:
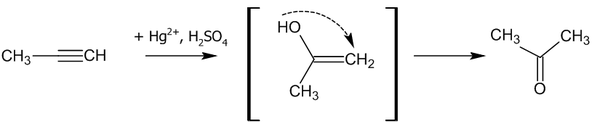
Гидратация
В присутствии солей ртути алкины присоединяют воду с образованием ацетальдегида (для ацетилена) или кетона (для прочих алкинов). Эта реакция известна как реакция Кучерова.
Считается, что процесс гидратации идет через стадию образования енола:
Применение
Из всех ацетиленовых углеводородов серьёзное промышленное значение имеет только ацетилен, который является важнейшим химическим сырьём.
Ацетилен использует для синтеза следующих продуктов:
тетрахлорэтан, трихлорэтилен, дихлорэтилен (хлорирование ацетилена) — растворители;
винилхлорид (гидрохлорирование ацетилена) — для получения поливинилхлорида;
ацетальдегид (гидратация ацетилена) — для дальнейшего получения уксусной кислоты, ацетона и др. продуктов;
хлоропрен (гидрохлорирование винилацетилена) — для получения хлоропреновых каучуков;
бутадиен (дегидратация бутиленгликоля) — для получения бутадиеновых каучуков;
16) Алкадиены — непредельные углеводороды, содержащие две двойные связи. Общая формула алкадиенов СnН2n-2. Для алкадиенов характерны те же виды изомерии, что и для алкенов:
1) изомерия углеродного скелета.
2) изомерия положения двойных связей
3) цис-транс-изомерия.
Номенклатура. Главную цепь в диенах выбирают так, чтобы она содержала обе двойные связи, и нумеруют с того конца, при котором сумма номеров положений двойных связей минимальна. В названии соответствующего алкана окончание -ан заменяется на -диен.
Химические свойства. Для алкадиенов характерны обычные реакции электрофильного присоединения АE, свойственные алкенам. Особенность сопряженных диенов состоит в том, что две двойные связи в их молекулах функционируют как единое целое, поэтому реакции присоединения могут протекать в двух направлениях: а) к одной из двойных связей (1,2-присоединение) или б) в крайние положения сопряженной системы с образованием новой двойной связи в центре системы (1,4-присоединение). Так, присоединение брома к бутадиену может привести к двум продуктам:
|
1,2 |
|
СН2=СН-СН=СН2 + Вr2 |
→ |
СН2=СН-СНВr-СН2Вr |
или
|
1,4 |
|
СН2=СН-СН=СН2 + Вr2 |
→ |
ВrСН2-СН=СН-СН2Вr |
Подбор реагентов и условий реакций позволяет направлять присоединение по любому из двух направлений.
Важнейшее свойство диенов — их способность к полимеризации, которая используется для получения синтетических каучуков. При полимеризации бутадиена-1,3, которая протекает как 1,4-присоединение, получают бутадиеновый каучук:
nСН2=СН-СН=СН2 → (-СН2-СН=СН-СН2-)n.
Использование металлоорганических катализаторов в этой реакции позволяет получить каучук с регулярным строением, в котором все звенья цепи имеют цис-конфигурацию. Аналогичная реакция с изопреном дает синтетический изопреновый каучук, который по строению и свойствам близок к природному каучуку:
nСН2=С(СН3)-СН=СН2 → (-СН2-С(СН3)=СН-СН2-)n.
Применение. Основная область применения алкадиенов - синтез каучуков.
17) Ароматические соединения — циклические органические соединения, которые имеют в своём составе ароматическую систему. Основными отличительными свойствами являются повышенная устойчивость ароматической системы и, несмотря на ненасыщенность, склонность к реакциям замещения, а не присоединения. Особенности строения и свойств бензола удалось полностью объяснить только после развития современной квантово-механической теории химических связей. По современным представлениям все шесть атомов углерода в молекуле бензола находятся в sp2-гибридном состоянии. Каждый атом углерода образует -связи с двумя другими атомами углерода и одним атомом водорода, лежащие в одной плоскости. Валентные углы между тремя -связями равны 120°. Таким образом, все шесть атомов углерода лежат в одной плоскости, образуя правильный шестиугольник ( -скелет молекулы бензола).
Каждый атом углерода имеет одну негибридизованную р-орбиталь. Шесть таких орбиталей располагаются перпендикулярно плоскому -скелету и параллельно друг другу (см. рис. а). Все шесть электронов взаимодействуют между собой, образуя -связи
Номенклатура и изомерия. Условно арены можно разделить на два ряда. К первому относят производные бензола (например, толуол или дифенил), ко второму — конденсированные (полиядерные) арены (простейший из них — нафталин):

Гомологический ряд бензола отвечает общей формуле С6Н2n-6.
Структурная изомерия в гомологическом ряду бензола обусловлена взаимным расположением заместителей в ядре. Монозамещенные производные бензола не имеют изомеров положения, так как все атомы в бензольном ядре равноценны. Дизамещенные производные существуют в виде трех изомеров,
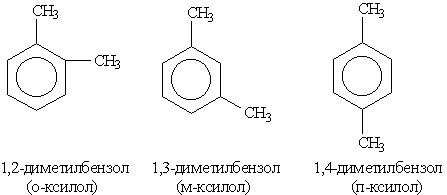
различающихся взаимным расположением заместителей. Положение заместителей указывают цифрами или приставками: орто- (о-), мета- (м-), пара- (п-).
Радикалы ароматических углеводородов называют арильными радикалами. Радикал С6Н5 — называется фенил.
Химические свойства бензола. 1. Галогенирование. Бензол не взаимодействует с хлором или бромом в обычных условиях. Реакция может протекать только в присутствии катализаторов — безводных АlСl3, FeСl3, АlВr3. В результате реакции образуются галогенозамещенные арены:

Роль катализатора заключается в поляризации нейтральной молекулы галогена с образованием из нее электрофильной частицы:
![]()
2. Нитрование. Бензол очень медленно реагирует с концентрированной азотной кислотой даже при сильном нагревании. Однако при действии так называемой нитрующей смеси (смесь концентрированных азотной и серной кислот) реакция нитрования проходит достаточно легко:
![]()
3. Сулъфирование. Реакция легко проходит под действием “дымящей” серной кислоты (олеума):
![]()
4.Гидрирование. Реакция присоединения водорода к аренам идет при нагревании и высоком давлении в присутствии металлических катализаторов (Ni, Pt, Pd). Бензолпревращается в циклогексан, а гомологи бензола — в производные циклогексана:
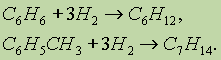
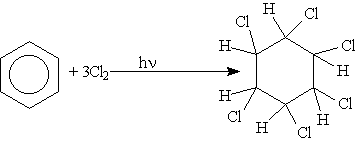
5. Радикальное галогенирование. Взаимодействие паров бензола с хлором протекает по радикальному механизму только под воздействием жесткого ультрафиолетового излучения. При этом бензол присоединяет три молекулы хлора и образует твердый продукт — гексахлорциклогексан (гексахлоран) С6Н6Сl6:
Применение. Бензол и его гомологи применяются как химическое сырье для производства лекарств, пластмасс, красителей, ядохимикатов и многих других органических веществ. Широко используются как растворители. Бензол в качестве добавки улучшает качество моторного топлива.
18) Спирты́ (от лат. spiritus — дух; устар. алкого́ли) — органические соединения, содержащие одну или более гидроксильных групп (гидроксил, −OH), непосредственно связанных с насыщенным (находящемся в состоянии sp³ гибридизации) атомом углерода[1]. Спирты можно рассматривать как производные воды (H−O−H), в которых один атом водорода замещен на органическую функциональную группу: R−O−H.
Классификация По числу гидроксильных групп:
— одноатомные спирты (метанол); — двухатомные спирты (этиленгликоль); — трехатомные спирты (глицерин); — четырёхатомные спирты (пентаэритрит); — многоатомные спирты (пятиатомный спирт: ксилит). |
В зависимости от насыщенности углеводородного заместителя:
— предельные или насыщенные спирты (бутанол); — непредельные или ненасыщенные спирты (аллиловый спирт, пропаргиловый спирт); — ароматические спирты (бензиловый спирт). |
|
В зависимости от наличия или отсутствия цикла в углеводородном заместителе:
— алициклические спирты (циклогексанол); — алифатические или ациклические спирты (этанол). |
|
В зависимости от того, при каком атоме углерода находится гидроксильная группа:
— первичные спирты (пропанол); — вторичные спирты (изопропиловый спирт); — третичные спирты (2-метилпропан-2-ол). |
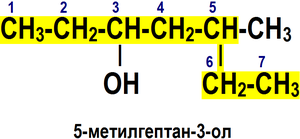
Правила построения названия спиртов (функциональная группа −OH)[6]:
1. Выбирается родительский углеводород по самой длинной непрерывной углеводородной цепи, содержащей функциональную группу. Он формирует базовое название (по числу атомов углерода).
|
|
2. Родительский углеводород нумеруется в направлении, которое дает суффиксу функциональной группы самое низкое число.
3.
Если в соединении помимо функциональной
группы имеется другой заместитель,
суффикс функциональной группы получает
самое низкое число.
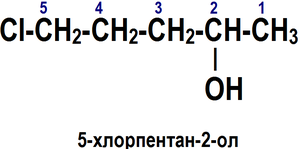
|
4. Если для суффикса функциональной группы получено одно и то же число в обоих направлениях, цепь нумеруется в направлении, которое дает другому заместителю самое низкое число.
5. Если имеется несколько заместителей, они перечисляются в алфавитном порядке.
Спирты
геометрически подобны молекуле воды.
Угол R−O−H в молекуле метанола равен
109°[52].
Гидроксильный кислород находится
в состоянии sp³
гибридизации:

|
Виды изомерии Структурная