
- •5. Ядерная модель атома по Резерфорду. Противоречия ядерной модели.
- •6. Постулаты Бора. Строение атома водорода по Бору. Линейчатость спектров
- •7. Оптический спектр водорода
- •15. Графическое изображение электронных структур. Правило Хунда.
- •18. Радиоактивность: альфа-, бета-, гамма-излучение.
- •19. Радиоактивный распад. Типы радиоактивного распада. Закон смещения.
- •22. Основные виды химической связи(ковалентная, ионная, металлическая).
- •27. Ионная связь и её свойства.
- •28. Межмолекулярные силы. Силы Ван-дер-Ваальса.
- •29. Водородная связь
- •30. Металлическая связь и её особенности.
1. Периодический закон Д. И. Менделеева: Свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от заряда ядра атома
2. Структура периодической системы элементов. Период, группа подгруппа: Периодическая таблица включает периоды, ряды, группы, подгруппы. Период - это ряд элементов, расположенных в порядке возрастания порядковых номеров, начинающийся щелочными металлами, и заканчивающийся инертными газами. В периодах с возрастанием порядкового номера элементов увеличиваются неметаллические свойства, так как увеличивается число электронов на наружном (валентном) энергетическом уровне, и увеличивается способность присоединять электроны. Отличие больших периодов от малых:
1) 2 больших периода - четный и нечетный.
2) В больших, в два раза возрастает валентность оксидов от 1 до 7.
3)В больших периодах медленнее возрастают неметаллические свойства.
4)Строение атомов в четных рядах больших периодов, начиная с 3 элемента, достраивается предпоследний электронный слой до 18-ти электронов, а в наружном остается 2 электрона
В нечетных рядах больших периодов достраивается наружный энергетический уровень до 8 ē, как в малом периоде. Число элементов соответствует максимально возможному числу ē на соответствующем уровне.
Группы - это вертикальные столбцы химических элементов, объединенных по признаку валентности. 8 групп. Они делятся на подгруппы: главные, включающие элементы малых и больших периодов, число главных подгрупп определяется максимальным числом ē на внешнем энергетическом уровне. максимальное число = 8. Число переходных ē определяется максимальным числом ē на d-подуровне (=10), но т.к. по три элемента включены в одну побочную подгруппу, то число побочных подгрупп=8. Номер группы указывает на число наружных элементов 3-х главных подгрупп и наивысшую степень окисления. В главных подгруппах с возрастанием порядкового номера увеличиваются металлические свойства, т.к. возрастает радиус атома, и уменьшается сила притяжения наружных ē. Побочные подгруппы включают элементы только больших периодов. Водород находится в 1 группе главной подгруппы над щелочными металлами (Ме), т.к. на наружном энергетическом уровне он имеет 1 электрон. Легко его теряет, превращаясь в положительно заряженный ион как щелочные Ме.
3. Как изменяются физические свойства по периоду и группе (атомные объёмы, радиусы атомов и ионов, цветность, магнитные свойства)?
1. В группе сверху вниз изменяются свойства:
- радиус атома хим. элемента увеличивается
- число энергетических уровней увеличивается, равно номеру периода.
- заряд ядра атома увеличивается.
- число валентных электронов не изменяется (=№ группы)
- электроотрицательность средство к электрону уменьшается.
- металлические (восстановительные свойства) увеличиваются, неметаллические (окислительные свойства) ослабевают.
- основной характер оксидов усиливается, кислотный характер ослабевает.
2. В периоде слева на право:
- радиус атома уменьшается.
- число энергетических уровней не изменяется.
- заряд атома увеличивается.
- атомная масса увеличивается.
- число валентных электронов увеличивается.
- электроотрицательность, сродство к электрону увеличиваются (чем меньше радиус тем электроотрицательность больше).
- металлические свойства ослабевают, а неметаллические усиливаются.
- кислотный характер оксидов усиливается.
4. Как изменяются химические свойства по периоду и группе (энергия ионизации, сродство к электрону, электроотрицательность)?
Радиусы атомов и одинаково заряженных ионов в периоде с увеличением зарядов ядра в основном (за несколькими исключениями) уменьшаются в связи с увеличением сил кулоновского притяжения из-за роста числа, а следовательно, и суммарного заряда электронов в электронных оболочках и ядер.
В подгруппах с увеличением заряда ядра (движение сверху вниз) атомные и ионные радиусы, как правило, увеличиваются, что связанно с увеличением числа электронных уровней.
Энергия ионизации(I) (потенциал ионизации) в периоде возрастает с ростом заряда ядра, в главных и третьей побочной подгруппах – убывает сверху вниз в связи с появлением нового энергетического уровня. В остальных побочных подгруппах энергия ионизации возрастает с ростом заряда ядра.
Сродством к электрону (Е) (энергия, которая выделяется при присоединении дополнительного электрона к атому, иону или молекуле). Максимальна у атомов галогенов. Сродство к электрону зависит не только от заряда ядра атома, но и от степени заполнения внешних электронных уровней.
Электроотрицательность (ЭО) - обобщенная характеристика элемента, определяемая как сумма энергии ионизации и сродства к электрону.
Относительную ЭО по Полингу определяют как отношение ЭО элемента к ЭО атома лития. Относительная электроотрицательность в периоде возрастает, а в подгруппах уменьшается с ростом заряда ядра.
Окислительная способность элемента меняется так же как и электроотрицательность, а восстановительная способность в обратном порядке.
Плотность простых веществ в периоде обычно проходит через максимум, лежащий примерно в середине периода, возрастает в подгруппах с ростом заряда ядра.
Основные свойства высших оксидов и гидроксидов элементов в периоде закономерно ослабляются, что связано с увеличением силы притяжения гидроксид-ионов к центральному атому с ростом заряда его ядра и уменьшением атомного радиуса, а в подгруппе, как правило, усиливаются, потому что атомный радиус элементов возрастает.
Кислотные свойства этих соединений изменяются в обратном направлении.
Неметаллические свойства в периоде, как правило, усиливаются слева направо, а в подгруппе – ослабевают сверху вниз, металлические – наоборот. Граница между металлами и неметаллами в таблице проходит по диагонали B-At таким образом, что все неметаллы находятся в верхней правой части таблицы (исключение составляют d- элементы).
5. Ядерная модель атома по Резерфорду. Противоречия ядерной модели.
На основании обобщения ряда экспериментальных данных Резерфордом была предложена (1911) ядерная модель атома. В этой модели атом принимается состоящим из положительно заряженного ядра и электронов, вращающихся вокруг него по тем или иным орбитам.
Резерфорд дал объяснения рассеяния α-частиц, предложив в 1911 г. ядерную модель строения атома. Согласно этой модели атом состоит из массивного положительно заряженного ядра, очень малого по размерам. В ядре сосредоточена почти вся масса атома. Вокруг ядра на значительном расстоянии от него вращаются электроны, образующие электронную оболочку атома.
Таким образом, складывалась весьма запутанная и противоречивая ситуация эксперимент говорил в пользу планетарной (ядерной) модели атома, тогда как согласно известным физическим законам такой атом существовать не мог. Выход был найден Н. Бором, теория которого опиралась на модель атома, предложенную Резерфордом, эмпирически установленные закономерности в атомных спектрах и гипотезу М. Планка. На последней надо остановиться особо.
6. Постулаты Бора. Строение атома водорода по Бору. Линейчатость спектров
Первая попытка построить качественно новую – квантовую – теорию атома была предпринята в 1913 г. Нильсом Бором. Он поставил цель связать в единое целое эмпирические закономерности линейчатых спектров, ядерную модель атома Резерфорда и квантовый характер излучения и поглощения света. В основу своей теории Бор положил ядерную модель Резерфорда. Он предположил, что электроны движутся вокруг ядра по круговым орбитам. Движение по окружности даже с постоянной скоростью обладает ускорением. Такое ускоренное движение заряда эквивалентно переменному току, который создает в пространстве переменное электромагнитное поле. На создание этого поля расходуется энергия. Энергия поля может создаваться за счет энергии кулоновского взаимодействия электрона с ядром. В результате электрон должен двигаться по спирали и упасть на ядро. Однако опыт показывает, что атомы – очень устойчивые образования. Отсюда следует вывод, что результаты классической электродинамики, основанной на уравнениях Максвелла, неприменимы к внутриатомным процессам. Необходимо найти новые закономерности. В основу своей теории атома Бор положил следующие постулаты.
Бор (1913) - развил модель строения атома:
Первый постулат Бора (постулат стационарных состояний) гласит: ē может вращаться вокруг ядра не по любым орбиталям, а по дозволенным (стационарным), радиусы относятся между собой как квадраты натурального ряда чисел:


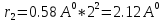

Второй постулат Бора формулируется следующим образом: ē вращаясь по стационарной орбите с наименьшей энергией не излучает и не поглощает энергию.
 ,
в этом случае расстояние между ядром
и ē наименьшее, Энергия – наименьшая,
связь –наибольшая.
,
в этом случае расстояние между ядром
и ē наименьшее, Энергия – наименьшая,
связь –наибольшая.
n=1, E=0 n=2, E=10.15 n=3, E=12.04 n=4, E=12.7
Третий
постулат:
При переходе с одной орбиты на другую,
происходит поглощение или выделение
Энергии в виде квантов.

Еще в начале XIX века были открыты дискретные спектральные линии в видимой области излучения атома водорода (так называемый линейчатый спектр). Линейчатый спектр - спектр, состоящий из отдельных узких спектральных линий. Линейчатые спектры излучаются веществами в атомарном состоянии.
