- •Вопросы по органической химии
- •Ионная и ковалентная связи в органических соединениях.
- •Координационная и семиполярная связи.
- •Номенклатура органических соединений.
- •Атомные орбитали s- и p-типа. Гибридизация орбиталей,δ- и π-связи.
- •Тетраэдрическая модель атома углерода. Теория строения Бутлерова.
- •Структурная изомерия и изомерия положения.
- •Алканы. Номенклатура, физические свойства, методы получения.
- •Химические свойства алканов.
- •Механизмы радикальных реакций (радикальное галогенирование и сульфохлорирование).
- •Алкены (этиленовые углеводороды), π-связь. Номенклатура, физические свойства. Методы получения.
- •Получение алкенов
- •Получение этилена в лаборатории
- •Химические свойства алкенов
- •17. Изомерия, природные источники и способы получения олефинов
- •18. Дегидративание первичных спиртов, физические и механические свойства олефинов
- •19. Правила Марковникова. Метод Вагнера
- •20. Полимеризация олефинов
- •Правило Марковникова. Исключения из этого правила (перекисный эффект Хараша, присоединение к α,β- непредельным карбонильным соединениям. )
- •Электронная природа двойной связи углерод-углерод. Цис-транс изомерия этиленовых углеводородов.
- •Химические свойства алкенов.
- •Алкины. Номенклатура , способы получения.
- •Алкины. Химические свойства. Реакции присоединения:
- •1) Присоединение водорода (гидрирование). На I ступени образуются алкены, на II ступени – алканы.
- •Сходства и различия в химических свойствах алкенов и алкинов.
- •Диеновые углеводороды . Электронное строение . Методы получения.
- •1. Строение и классификация
- •2. Номенклатура и изомерия
- •3. Получение диенов
- •4. Физические и химические свойства
- •5. Отдельные представители
- •6. Каучуки и резины (эластомеры)
- •Реакционная способность диеновых углеводородов в реакциях присоединения.
- •Полимеризация алкенов и диенов. Природный и синтетический каучук.
- •Ароматические углеводороды. Строение бензола . Ароматичность. Методы получения гомологов бензола.
- •Реакции электрофильного замещения (на примере соединений ароматического ряда).
- •Теория замещения в ароматических соединениях. Реакции электрофильного замещения . Ориентанты 1 рода(орто-, пара- ориентанты) .
- •Теория замещения в ароматических соединениях. Реакции электрофильного замещения. Ориентанты 2 рода (мета- ориентанты).
- •Механизмы органических реакций-замещение, присоединение, отщепление.
Тетраэдрическая модель атома углерода. Теория строения Бутлерова.
В 1875 г. Вант-Гофф и Ле Бель предложили тетраэдрическую модель атома углерода, по которой валентности углерода направлены к вершинам тетраэдра, если атом углерода поместить в центр этого тетраэдра. В 1917 году Льюис предложил рассматривать химическую связь с помощью электронных пар. Вант-Гофф предложил тетраэдрическую модель атома углерода. Согласно этой теории, четыре валентности атома углерода в метане направлены к четырем углам тетраэдра, в центре которого находится углеродный атом, а в вершинах — атомы водорода (рис. 1, а). Этан, согласно Вант-Гоффу, можно представить себе как два тетраэдра, соединенных вершинами и свободно вращающихся около общей оси (рис. 1, б). Модель молекулы этилена представляет собой два тетраэдра, соединенных ребрами (рис. 1, в), а мол екулы с тройной связью изображаются моделью, в которой тетраэдры соприкасаются плоскостями (рис. 1, г).
Рис. 3. Шаростержне-вая модель ацетилена
Такого типа модели оказались весьма удачными и для сложных молекул. Они с успехом используются и сегодня для объяснения ряда стереохимических вопросов.
Различные пространственные модели широко применяются для объяснения многих химических реакций, в которых пространственное расположение атомов играет определяющую роль. Модели строятся с учетом длин связей
между атомами, которые известны, и валентных углов (т. е. углов, образованных направлениями связей между отдельными атомами). На рис. 2—5 приведены наиболее широко употребляемые типы моделей.
Теория, предложенная Вант-Гоффом, хотя и пригодная почти во всех случаях, не давала, однако, обоснованного объяснения типа и существа связывающих сил в молекулах. Это было сделано только в XX в. (см. гл. 1).
Теория строения органических соединений А. М. Бутлерова Теория строения органических соединений A. M. Бутлерова, сформулированная ученым в 1861г., включает в себя следующие положения: 1 Атомы расположены в молекулах не хаотично, а соединены друг с другом в определенной последовательности, в соответствии с их валентностью. 2. Химические свойства веществ зависят не только от качественного или количественного состава, но и от химического строения молекул. 3. Атомы или группы атомов в молекулах взаимно влияют друг на друга, непосредственно или посредством других атомов. Соединения, у которых один и тот же состав, но различный порядок связи атомов в молекуле, называются изомерами. Явление изомерии - также одна из причин многообразия органических соединений.
Структурная изомерия и изомерия положения.
ИЗОМЕРИЯ (греч. isos – одинаковый, meros – часть) – одно из важнейших понятий в химии, главным образом, в органической. Вещества могут иметь одинаковый состав и молекулярную массу, но различное строение и соединения, содержащие в своем составе одни и те же элементы в одинаковом количестве, но различающиеся пространственным расположением атомов или групп атомов, называют изомерами. Изомерия является одной из причин того, что органические соединения так многочисленны и разнообразны. Изомерия была впервые обнаружена Ю.Либихом в 1823, который установил, что серебряные соли гремучей и изоциановой кислот: Ag-О-N=C и Ag-N=C=O имеют одинаковый состав, но разные свойства. Термин «Изомерия» в 1830 ввел И.Берцелиус, предположивший, что различия в свойствах соединений одинакового состава возникают из-за того, что атомы в молекуле расположены в неодинаковом порядке. Представления об изомерии окончательно сформировались после создания A.M.Бутлеровым теории химического строения (1860-е). Основываясь на положениях этой теории, он предположил, что должно существовать четыре различных бутанола. К моменту создания теории был известен лишь один бутанол (СН3)2СНСН2ОН, получаемый из растительного сырья. Последовавший затем синтез всех изомеров бутанола и определение их свойств стали убедительным подтверждением теории. Согласно современному определению два соединения одинакового состава считают изомерами, если их молекулы нельзя совместить в пространстве так, чтобы они полностью совпадали. Совмещение, как правило, проделывают мысленно, в сложных случаях используют пространственные модели, либо расчетные методы. Есть несколько причин возникновения изомерии. Структурная изомерия Обусловлена, как правило, различиями в строении углеводородного скелета либо неодинаковым расположением функциональных групп или кратных связей.
Изомерия углеводородного скелета. Насыщенные углеводороды, содержащие от одного до трех атомов углерода (метан, этан, пропан), не имеют изомеров. Для соединения с четырьмя атомами углерода С4Н10 (бутан) возможно существование двух изомеров, для пентана С5Н12 – трех изомеров, для гексана С6Н14 – пяти
С увеличением числа атомов углерода в молекуле углеводорода количество возможных изомеров резко возрастает. Для гептана С7Н16 существует девять изомеров, для углеводорода С14Н30 – 1885 изомеров, для углеводорода С20Н42 – свыше 366 000.
В сложных случаях вопрос о том, являются ли два соединения изомерами, решают, используя различные повороты вокруг валентных связей (простые связи это допускают, что в определенной степени соответствует их физическим свойствам). После перемещения отдельных фрагментов молекулы (не допуская при этом разрыва связей) накладывают одну молекулу на другую. Если две молекулы полностью совпадают, то это не изомеры, а одно и то же соединение:
Индуктивный эффект и эффект сопряжения.
Индуктивный эффект Индуктивный эффект (I-эффект) - это передача электронного влияния заместителей по цепи σ-связей. Этот эффект передаётся по цепи σ-связей с постепенным затуханием и, как правило, через три - четыре связи он уже не проявляется. Направление индуктивного эффекта заместителя качественно оценивают, сравнивая с со связью С-Н, полагая её неполярной, а индуктивный эффект водорода равным нулю. Электроотягивающие заместители снижают элекроную плотность в системе σ-связей, и их называют электроноакцепторными. Элекроноподающие заместители повышают электроннную плотность в цепи σ-связей по сравнению с атомом водорода, т. е. проявляют +I эффект и являются элекронодонорными. К ним относятся атомы с низкой электроотрицательностью (например, металлы), а также отрицательно заряженные атомы или группы, обладающие избытком электронной плотности, которую они стремятся перераспределить на соседние связи.
|
|
|||
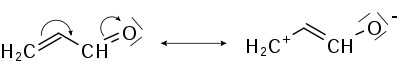
Мезомерный эффект Мезомерный эффект, или эффект сопряжения (М-эффект), - это передача электронного влияния эаместителей по сопряжённой системе. Мезомерный эффект (эффект сопряжения, резонансный эффект) - смещение электронной плотности химической связи по π-связям. Возникновение мезомерного эффекта связано с изменением профиля π-системы молекулы. Исходная π-система перекрывается с π-системой или p-орбиталью заместителя, в результате чего возникает перераспределение электронной плотности. Именно последнее определяет наличие +М- или -М-эффекта. Знак, как и в случае индуктивного эффекта определяется прибавлением электронной плотности и противоположен знаку параметра заместителя σ в уравнении Гаммета. В отличие от индуктивного эффекта мезомерный эффект слабо затухает по системе связей, с тем лишь отличием, что в данном случае необходима система кратных связей и p-орбиталей. Наиболее характерными +М-группами являются группы, вносящие неподелённые электронные пары в сопряжённую систему, такие как амино-, гидрокси-, алкоксигруппы, галогены; группы с -М-эффектом содержат кратные связи с гетероатомами. Можно привести аналогию с разными типами атомов азота в гетероциклах: • для +М характерны пиррольные гетероатомы; • для -М характерны пиридиновые гетероатомы. -М-группами являются карбонильная группа, цианогруппа и т. п. Группы с системой сопряжённых углерод-углеродных связей, таких как фенильная и винильная группы, занимают промежуточное положение с так называемым ±М-эффектом и проявляют эффект, противоположный эффекту группы, с которой связаны, усиливая его. Примеры мезомерного эффекта:
|