
- •Вопросы по органической химии
- •Ионная и ковалентная связи в органических соединениях.
- •Координационная и семиполярная связи.
- •Номенклатура органических соединений.
- •Атомные орбитали s- и p-типа. Гибридизация орбиталей,δ- и π-связи.
- •Тетраэдрическая модель атома углерода. Теория строения Бутлерова.
- •Структурная изомерия и изомерия положения.
- •Алканы. Номенклатура, физические свойства, методы получения.
- •Химические свойства алканов.
- •Механизмы радикальных реакций (радикальное галогенирование и сульфохлорирование).
- •Алкены (этиленовые углеводороды), π-связь. Номенклатура, физические свойства. Методы получения.
- •Получение алкенов
- •Получение этилена в лаборатории
- •Химические свойства алкенов
- •17. Изомерия, природные источники и способы получения олефинов
- •18. Дегидративание первичных спиртов, физические и механические свойства олефинов
- •19. Правила Марковникова. Метод Вагнера
- •20. Полимеризация олефинов
- •Правило Марковникова. Исключения из этого правила (перекисный эффект Хараша, присоединение к α,β- непредельным карбонильным соединениям. )
- •Электронная природа двойной связи углерод-углерод. Цис-транс изомерия этиленовых углеводородов.
- •Химические свойства алкенов.
- •Алкины. Номенклатура , способы получения.
- •Алкины. Химические свойства. Реакции присоединения:
- •1) Присоединение водорода (гидрирование). На I ступени образуются алкены, на II ступени – алканы.
- •Сходства и различия в химических свойствах алкенов и алкинов.
- •Диеновые углеводороды . Электронное строение . Методы получения.
- •1. Строение и классификация
- •2. Номенклатура и изомерия
- •3. Получение диенов
- •4. Физические и химические свойства
- •5. Отдельные представители
- •6. Каучуки и резины (эластомеры)
- •Реакционная способность диеновых углеводородов в реакциях присоединения.
- •Полимеризация алкенов и диенов. Природный и синтетический каучук.
- •Ароматические углеводороды. Строение бензола . Ароматичность. Методы получения гомологов бензола.
- •Реакции электрофильного замещения (на примере соединений ароматического ряда).
- •Теория замещения в ароматических соединениях. Реакции электрофильного замещения . Ориентанты 1 рода(орто-, пара- ориентанты) .
- •Теория замещения в ароматических соединениях. Реакции электрофильного замещения. Ориентанты 2 рода (мета- ориентанты).
- •Механизмы органических реакций-замещение, присоединение, отщепление.
Атомные орбитали s- и p-типа. Гибридизация орбиталей,δ- и π-связи.
Гибридизация атомных орбиталей
Для объяснения отличия валентных углов в молекулах H2O (104,5) и NH3 (107,3) от 90 следует принять во внимание, что устойчивому состоянию молекулы отвечает ее геометрическая структура с наименьшей потенциальной энергией. Поэтому при образовании молекулы форма и взаимное расположение атомных электронных облаков * изменяется по сравнению с их формой и расположением в свободных атомах. В результате достигается более полное перекрывание орбиталей * при образовании химической связи. Такая деформация электронных облаков требует затраты энергии, но более полное перекрывание приводит к образованию более прочной связи, и в целом получается выигрыш в энергии. Этим и объясняется возникновение гибридных орбиталей.
Форма гибридной орбитали может быть определена математически путем сложения волновых функций * исходных орбиталей:

В результате сложения волновых функций s- и p-орбиталей с учетом их знаков оказывается, что плотность электронного облака (величина Ψ2) по одну сторону от ядра повышена, а по другую – понижена.
В целом процесс гибридизации включает следующие этапы: возбуждение атома *, гибридизация орбиталей возбужденного атома, образование связей с другими атомами. Затраты энергии на первые два этапа компенсируются выигрышем энергии при образовании более прочных связей с гибридными орбиталями. Тип гибридизации определяется типом и количеством участвующих в ней орбиталей.
Ниже рассмотрены примеры различных видов гибридизации s- и p-орбиталей.
Гибридизация одной s- и одной p-орбитали (sp-гибридизация) происходит, например, при образовании галогенидов бериллия, цинка, кадмия и ртути. Атомы этих элементов в нормальном состоянии имеют во внешнем слое два спаренных s-электрона. В результате возбуждения один из s-электронов переходит в p-состояние – появляется два неспаренных электрона, один из которых s-, а другой p-электрон. При образовании химической связи * эти две различные орбитали преобразуются в две одинаковые гибридные орбитали (sp-орбитали), направленные под углом 180 друг к другу, – две связи имеют противоположное направление (рисунок 3.5).

Рисунок 3.5 – Перекрывание sp-орбиталей бериллия и p-орбиталей хлора в молекуле BeCl2
Экспериментальное определение структуры молекул BeГ2, ZnГ2, CdГ2, HgГ2 (Г–галоген) показало, что эти молекулы являются линейными, и обе связи металла с атомами галогена имеют одинаковую длину.
Гибридизация одной s- и двух p-орбиталей (sp2-гибридизация) имеет место, например, при образовании соединений бора. Возбужденный атом бора обладает тремя неспаренными электронами – одним s-электроном и двумя p-электронами. Из трех орбиталей образуются три эквивалентные sp2-гибридные орбитали, расположенные в одной плоскости под углом 120 друг к другу (рисунок 3.6). Действительно, как показывают экспериментальные исследования, молекулы таких соединений бора, как BГ3 (Г-галоген), B(CH3)3 – триметилбор, B(OH)3 – борная кислота, имеют плоское строение. При этом три связи бора в указанных молекулах имеют одинаковую длину и расположены под углом 120.
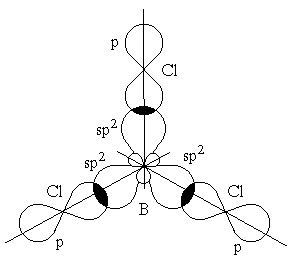
Рисунок 3.6 – Перекрывание sp2-орбиталей бора и p-орбиталей хлора в молекуле BCl3
Гибридизация одной s- и трех p-орбиталей (sp3-гибридизация) характерна, например, для углерода и его аналогов – кремния и германия. В этом случае четыре гибридные sp3-орбитали расположены под углом 10928´ друг к другу; они направлены к вершинам тетраэдра (в молекулах CH4, CCl4, SiH4, GeBr4 и др.). Валентные углы в молекулах H2O (104,5) и NH3 (107,3) не точно соответствуют взаимному расположению “чистых” p-орбиталей (90). Это обусловлено некоторым вкладом s-электронов в образование химической связи. Такой вклад есть не что иное, как гибридизация. Валентные электроны в этих молекулах занимают четыре орбитали, которые близки к sp3-гибридным. Незначительное отличие валентных углов от тетраэдрических 10928´ объясняется тем, что гибридизация в данном случае является неполной.
Во многих молекулах центральный атом не подвергается гибридизации. Так, валентные углы в молекулах H2S, PH3 и др. близки к 90, т.е. образование связей происходит с участием “чистых” p-орбиталей, расположенных под прямым углом друг к другу.
