
- •Вопросы по органической химии
- •Ионная и ковалентная связи в органических соединениях.
- •Координационная и семиполярная связи.
- •Номенклатура органических соединений.
- •Атомные орбитали s- и p-типа. Гибридизация орбиталей,δ- и π-связи.
- •Тетраэдрическая модель атома углерода. Теория строения Бутлерова.
- •Структурная изомерия и изомерия положения.
- •Алканы. Номенклатура, физические свойства, методы получения.
- •Химические свойства алканов.
- •Механизмы радикальных реакций (радикальное галогенирование и сульфохлорирование).
- •Алкены (этиленовые углеводороды), π-связь. Номенклатура, физические свойства. Методы получения.
- •Получение алкенов
- •Получение этилена в лаборатории
- •Химические свойства алкенов
- •17. Изомерия, природные источники и способы получения олефинов
- •18. Дегидративание первичных спиртов, физические и механические свойства олефинов
- •19. Правила Марковникова. Метод Вагнера
- •20. Полимеризация олефинов
- •Правило Марковникова. Исключения из этого правила (перекисный эффект Хараша, присоединение к α,β- непредельным карбонильным соединениям. )
- •Электронная природа двойной связи углерод-углерод. Цис-транс изомерия этиленовых углеводородов.
- •Химические свойства алкенов.
- •Алкины. Номенклатура , способы получения.
- •Алкины. Химические свойства. Реакции присоединения:
- •1) Присоединение водорода (гидрирование). На I ступени образуются алкены, на II ступени – алканы.
- •Сходства и различия в химических свойствах алкенов и алкинов.
- •Диеновые углеводороды . Электронное строение . Методы получения.
- •1. Строение и классификация
- •2. Номенклатура и изомерия
- •3. Получение диенов
- •4. Физические и химические свойства
- •5. Отдельные представители
- •6. Каучуки и резины (эластомеры)
- •Реакционная способность диеновых углеводородов в реакциях присоединения.
- •Полимеризация алкенов и диенов. Природный и синтетический каучук.
- •Ароматические углеводороды. Строение бензола . Ароматичность. Методы получения гомологов бензола.
- •Реакции электрофильного замещения (на примере соединений ароматического ряда).
- •Теория замещения в ароматических соединениях. Реакции электрофильного замещения . Ориентанты 1 рода(орто-, пара- ориентанты) .
- •Теория замещения в ароматических соединениях. Реакции электрофильного замещения. Ориентанты 2 рода (мета- ориентанты).
- •Механизмы органических реакций-замещение, присоединение, отщепление.
Электронная природа двойной связи углерод-углерод. Цис-транс изомерия этиленовых углеводородов.
Химические свойства алкенов.
Алкины. Номенклатура , способы получения.
Алкины – это углеводороды, в молекулах которых два атома углерода находятся в состоянии sp-гибридизации и связаны друг с другом тройной связью.
Общая формула: CnH2n–2, где n > 2.
Особенности алкинов: 1) длина связи в алкинах равна 0,120 нм; 2) каждый атом углерода в состоянии sp-гибридизации связан с двумя другими атомами; 3) может присоединять еще два атома.
Существует два типа изомерии алкинов: 1) изомерия положения тройной связи; 2) изомерия цепи.
Первые два члена гомологического ряда – этин и пропин – изомеров не имеют.
Для бутинов возможен только один вид изомерии – изомерия положения тройной связи.
Существует два типа номенклатуры: 1) международная номенклатура: этин; пропин; 2) рациональная номенклатура: ацетилен; метиацетилен.
Физические свойства алкинов: 1) С2Н2…С4Н6 – газы; 2) С5Н8…С15Н28 – жидкости; 3) С16Н30… – твердые вещества; 4) плохо растворимы в воде.
Химические свойства алкинов: обладают большой реакционной способностью, характеризуются реакцией присоединения, тройная связь содержит две π-связи.
Алкины (ацетиленовые углеводороды) содержат тройную связь. Общая формула алкина с одной тройной связью C nH 2n–2. Название образуется от соответствующего углеводорода с добавлением суффикса -ин. В табл. 12.4 приведены первые пять алкинов.
|
|||||||||||||||||||||
Таблица 12.4. Алкины ряда ацетилена C n H 2 n –2 . |
|||||||||||||||||||||
Диины могут быть двух видов: с изолированными тройными связями
|
1,6-гептадиин |
и с сопряженными тройными связями
|
бутадиин |
Алкины. Химические свойства. Реакции присоединения:
1) Присоединение водорода (гидрирование). На I ступени образуются алкены, на II ступени – алканы.
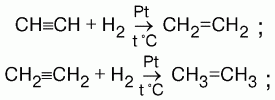
2) присоединение галогенов (галогенирование). HC≡CH + HCl → CH2=CHCl → CH3-CHCl2;
На I ступени образуются дигалогеналкены, на II – тетрагалогеналканы.
Реакция алкинов с бромной водой – качественная реакция на алкины. Бромная вода обесцвечивается;
3) присоединение галогеноводородов (гидрогалогенирование).
На I ступени образуются моногалогеналкены, на II – дигалогеналканы;
4) присоединение воды (гидратация).
Ацетилен образует альдегид, его гомологи – кетоны (реакция М.Г. Кучерова):

Реакция окисления: 1) горение (полное окисление): 2С2Н2 + 5O2 → 4СO2 + 2Н2О; 2) неполное окисление (под действием окислителя типа КМnO4, К2Сr2О7).
При действии сильных окислителей (КМnO4 в нейтральной среде, К2Сr2О7 в кислотной среде) алкины окисляются с разрывом молекулы по тройной связи (кроме ацетилена).
Конечным продуктом реакции являются карбоновые кислоты: СН3-С≡С-СН3 + 3[О] + Н2О → 2СН3-СООН – этановая (уксусная) кислота.
При неполном окислении ацетилена образуется двухосновная щавелевая кислота: СН≡Н + 4[О] → НООС-СООН.

