
- •Ионная и ковалентная связи
- •2)Координационная и семиполярная связи.
- •3)Номенклатура органических соединений
- •4) Атомные орбитали s- p- типа.
- •5) Тетраэдрическая модель атома углерода. Теория строения Бутлерова.
- •6) Структурная изомерия и изомерия положения.
- •7)Индуктивный эффект и эффект сопряжения
- •8) Алканы.
- •9)Химические свойства алканов.
- •10) Механизмы радикальных реакций
- •11) Алкены
- •12) Правило Марковникова. Исключения.
- •13) Электронная природа двойной связи углерод-углерод. Цис-транс изомерия этиленовых углеводородов.
- •14) Химические свойства Алкенов.
- •15) Алкины.
- •16) Алкины, химические свойства.
- •17) Сходства и различия в химических свойствах алкенов и алкинов.
- •18) Диены. Электронное строение. Методы получения.
- •19) Реакционная способность диенов в реакциях присоединения.
- •20) Полимеризация алкенов и диенов. Природный и синтетический каучук.
14) Химические свойства Алкенов.
Реакции присоединения. Чаще реакции присоединения идут по гетеролитическому типу, являясь реакциями электрофильного присоединения.
1. Гидрирование (присоединение водорода). Алкены, присоединяя водород в присутствии катализаторов (Pt, Pd, Ni), переходят в предельные углеводороды — алканы:
Н2С==СН2 + H2 ® Н3С—СН3 этилен этан
2. Галогенирование (присоединение галогенов). Галогены легко присоединяются по месту разрыва двойной связи с образованием дигалогенопроизводных:
Н2С==СН2 + Cl2 ® ClH2C—CH2Cl 1,2-дихлорэтан
Легче идет присоединение хлора и брома, труднее — иода. Фтор с алкенами, как и с алканами, взаимодействует со взрывом.
Реакции окисления. Алкены окисляются легче, чем алканы. Продукты, образованные при окислении алкенов, и их строение зависят от строения алкенов и от условий проведения этой реакции.
1. Окисление при обычной температуре. При действии на этилен водного раствора КМnO4 (при нормальных условиях) происходит образование двухатомного спирта — этиленгликоля:
3H2C==CH2 + 2KMnO4 + 4H2O ® 3HOCH2—CH2OH + 2MnO2 + KOH
2. Горение алкенов. Как и алканы, непредельные соединения ряда этилена сгорают на воздухе с образованием оксида углерода (IV) и воды:
Н2С=СН2 + 3O2 ® 2СO2 + 2Н2O
15) Алкины.
Углеводородные радикалы, образованные от алкинов имеют суффикс «-инил», так CH≡C- называется «этинил».
Ниже представлены некоторые представители алкинов и их названия:
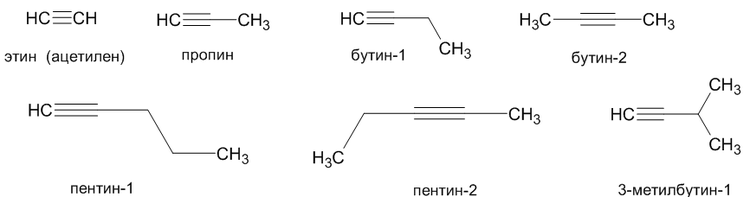
Этин: C2H2
Пропин: C3H4
Бутин: C4H6
Пентин: C5H8
Гексин: C6H10
Гептин: C7H12
1) Общим способом получения алкинов является реакция дегидрогалогенирования - отщепления двух молекул галогеноводорода от дигалогензамещенных алканов, которые содержат два атома галогена либо у соседних атомов углерода (например, 1,2-дибромпропан), либо у одного атома углерода (2,2-дибромпропан). Реакция происходит под действием спиртового раствора гидроксида калия:
 2.
Важнейший из алкинов — ацетилен —
получают в промышленности путем
высокотемпературного крекинга метана:
2.
Важнейший из алкинов — ацетилен —
получают в промышленности путем
высокотемпературного крекинга метана:
![]()
16) Алкины, химические свойства.
1. Галогенирование. Галогены присоединяются к алкинам в две стадии. Например, присоединение брома к ацетилену приводит к образованию дибромэтена, который, в свою очередь, реагирует с избытком брома с образованием тетрабромэтана:
![]() 2. Гидрогалогенирование. Галогеноводороды
присоединяются к тройной связи труднее,
чем к двойной. Для активации галогеноводорода
используют АlСl3 —
сильную кислоту Льюиса. Из ацетилена
при этом можно получить винилхлорид
(хлорэтен), который используется для
получения важного полимера —
поливинилхлорида;
2. Гидрогалогенирование. Галогеноводороды
присоединяются к тройной связи труднее,
чем к двойной. Для активации галогеноводорода
используют АlСl3 —
сильную кислоту Льюиса. Из ацетилена
при этом можно получить винилхлорид
(хлорэтен), который используется для
получения важного полимера —
поливинилхлорида;
![]() 3. Гидратация. Присоединение
воды к алкинам катализируется солями
ртути (П) (реакция
Кучерова):
3. Гидратация. Присоединение
воды к алкинам катализируется солями
ртути (П) (реакция
Кучерова):
![]()
Особенностью алкинов, имеющих концевую тройную связь, является их способность отщеплять протон под действием сильных оснований, т, е, проявлять слабые кислотные свойства. Возможность отщепления протона обусловлена сильной поляризацией s -связи º С¬ Н. Причиной поляризации является высокая электроотрицательность атома углерода в sp-гибридном состоянии. Поэтому алкины, в отличие от алкенов и алканов, способны образовывать соли, называемые ацетиленидами.
![]() Ацетилениды
серебра и меди (I) легко образуются и
выпадают в осадок при пропускании
ацетилена через аммиачный раствор
оксида серебра или хлорида меди (I). Эта
реакция служит для обнаружения алкинов
с тройной связью на конце цепи:
Ацетилениды
серебра и меди (I) легко образуются и
выпадают в осадок при пропускании
ацетилена через аммиачный раствор
оксида серебра или хлорида меди (I). Эта
реакция служит для обнаружения алкинов
с тройной связью на конце цепи:

Ацетилениды серебра и меди как соли очень слабых кислот легко разлагаются при действии хлороводородной кислоты с выделением исходного алкина:
![]() Таким
образом, используя реакции образования
и разложения ацетиленидов, можно
выделять алкины из смесей с другими
углеводородами
Таким
образом, используя реакции образования
и разложения ацетиленидов, можно
выделять алкины из смесей с другими
углеводородами
