
- •Ионная и ковалентная связи
- •2)Координационная и семиполярная связи.
- •3)Номенклатура органических соединений
- •4) Атомные орбитали s- p- типа.
- •5) Тетраэдрическая модель атома углерода. Теория строения Бутлерова.
- •6) Структурная изомерия и изомерия положения.
- •7)Индуктивный эффект и эффект сопряжения
- •8) Алканы.
- •9)Химические свойства алканов.
- •10) Механизмы радикальных реакций
- •11) Алкены
- •12) Правило Марковникова. Исключения.
- •13) Электронная природа двойной связи углерод-углерод. Цис-транс изомерия этиленовых углеводородов.
- •14) Химические свойства Алкенов.
- •15) Алкины.
- •16) Алкины, химические свойства.
- •17) Сходства и различия в химических свойствах алкенов и алкинов.
- •18) Диены. Электронное строение. Методы получения.
- •19) Реакционная способность диенов в реакциях присоединения.
- •20) Полимеризация алкенов и диенов. Природный и синтетический каучук.
11) Алкены
СН3—СН2—СН=СН2 СН3—СН=СН—СН3 бутен-1 бутен-2
С2Н4 — этен, С3Н6 — пропен, С4Н8 — бутен, С5Н10 — пентен, С6Н12 — гексен и т. д.
Получение:
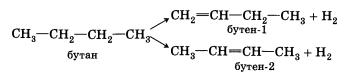
Дегидрирование
предельных углеводородов. При пропускании
алканов над катализатором при высокой
температуре (400—600 °С) происходит
отщепление молекулы водорода и образование
алкена:
Дегидратация
спиртов (отщепление воды). Воздействие
водоотнимающих средств (Н2804, Аl203) на
одноатомные спирты при высокой температуре
приводит к отщеплению молекулы воды и
образованию двойной связи:
![]()
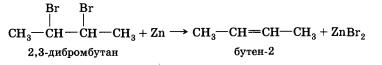
Дегалогенирование.
При действии цинка на дибромпроиз-водное
алкана происходит отщепление атомов
галогенов, находящихся при соседних
атомах углерода, и образование двойной
связи:
Физические свойства
Первые три представителя гомологического ряда алкенов — газы, вещества состава С5Н10—С16Н32 — жидкости, высшие алкены — твердые вещества. Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений.
12) Правило Марковникова. Исключения.
Марковникова правило: при присоединении протонных кислот или воды к несимметричным алкенам или алкинаматом водорода присоединяется к наиболее гидрогенизированному атому углерода, например:
![]()
Исключения:
Современная электронная трактовка правила Марковникова позволяет объяснить и ряд случаев присоединения против этого правила. Так, присоединение электрофильных и нуклеофильных агентов к соединениям с сопряжёнными связями, содержащим электроотрицательную группировку у атома углерода двойной связи, происходит против правила Марковникова в соответствии со смещением электронной плотности к наиболее электроотрицательным атомам, например:
![]()
Правило Марковникова нарушается также в реакциях присоединения HBr к олефинам в присутствии перекисей (эффект Хараша), так как механизм реакции в этом случае радикальный. Атакующей частицей является атомарный бром, а ориентация присоединения определяется стабильностью промежуточно образующегося углеродного свободного радикала:
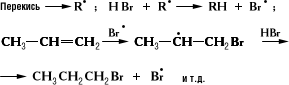
13) Электронная природа двойной связи углерод-углерод. Цис-транс изомерия этиленовых углеводородов.
Однако в ряду этиленовых углеводородов помимо структурно изомерии возможен еще один вид изомерии — цис-, транс-изомерия (геометрическая изомерия). Такая изомерия характерна для соединений с двойной связью. Если простая s-связь допускает свободное вращение отдельных звеньев углеродной цепи вокруг своей оси, то вокруг двойной связи такого вращения не происходит. Это и является причиной появления геометрических (цис-, транс-) изомеров.
Геометрическая изомерия — один из видов пространственной изомерии.
Изомеры, у которых одинаковые заместители (при разных углеродных атомах) расположены по одну сторону от двойной связи, называют цис-изомерами, а по разную — транс-изомерами:
H H H CH3 | | | | C==C C==C | | | | H3C CH3 H3C H цис-бутен-2 транс-бутен-2
Цис- и транс-изомеры отличаются не только пространственным строением, но и многими физическими и химическими свойствами. Транс-изомеры более устойчивы, чем цис-изомеры.
