
№97. Триада железа: железо, кобальт, никель
Элементы располагаются в 4 периоде Периодической системе элементов
|
Fe |
Co |
Ni |
Порядковый номер |
26 |
27 |
28 |
Валентные электроны |
3d64s2 |
3d74s2 |
3d84s2 |
Строение электронной оболочки |
26Fe)2)8)14)2 |
27Co)2)8)14)3 |
28Ni)2)8)14)4 |
Степени окисления |
2,3,(4),6 |
2,3,(4) |
2,(3),(4) |
Тип решётки |
кубическая объёмноцентрированная |
гексагональная |
кубическая гранецентрированная |
Атомы элементов триады железа имеют на внешнем энергетическом уровне по 2 электрона, которые они отдают в химических реакциях. Однако в образовании химических связей участвуют и электроны 3d-орбиталей второго снаружи уровня. В своих устойчивых соединениях, эти элементы проявляют степень окисления +2, +3. Образуют оксиды состава RO и R2О3. Им соответствуют гидроксиды состава R(OH)2 и R(ОН)3. Наиболее устойчивыми являются соединения железа (III), кобальта (II) и никеля (II) – для них известны почти все соли.
Химическая активность металлов:
Fe, Co и Ni пассивируются концентрированными H2SO4, HNO3 и царской водкой
Ме растворяются в кислотах-неокислителях: Co+2HCl=CoCl2 10Fe+36HNO3(разб)=10Fe(NO3)3+3N2+18H2O 5Ni+12HNO3(разб)=5Ni(NO3)2+N2+6H2O
Не растворяются в щелочах
Реагируют с кислородом при нагревании: 4Fe+3O2=2Fe2O3; 3Co+2O2=Co3O4
Железо подвергается коррозии: 4Fe+3O2+6H2O=2Fe2O3·H2О
Железо реагирует с углеродом: 3Fe+C=Fe3C (цементит)
Ме реагируют с галогенами: FeHal3 (но FeI2), CoHal2 (но CoF3), NiHal2
Реагируют с неметаллами при нагревании: Fe+S2=FeS2, Fe+4P=FeP4, 3Ni+2S=Ni3S2, Co+3P=CoP3
Характерно свойство присоединять нейтральные молекулы, например, оксида углерода (II). Карбонилы Ni(CO)4, Fe(CO)5 и Со(СО)8
Оксиды и гидроксиды Co и Ni
NiO - Проявляет амфотерные свойства (основные преобладают). Восстанавливается водородом или другими восстановителями (С, Mg, Al) до металла
Co3O4 - На воздухе кобальт окисляется при температуре выше 300 °C. Все оксиды кобальта восстанавливаются водородом. Со3О4 + 4Н2 → 3Со + 4Н2О. Проявляет амфотерные свойства
Гидроксиды Co(OH)2 и Ni(OH)2 проявляют амфотерные свойства. Преимущественно основные
Гидроксиды Co(OH)3 и NiO(OH) проявляют основные свойства 4Co(OH)3+4H2SO4(разб)=4CoSO4+O2+10H2O, NiO(OH)+4HCl=NiCl2+Cl2+2H2O
Соединения Fe4+,Co4+ и Ni4+ неустойчивы
№98. Оксиды и гидроксиды Fe: FeO – основный оксид, окисляется при нагревании, восстанавливается водородом, коксом FeO+2HCl=FeCl2+H2O Fe2O3 – амфотерный оксид с преобладанием основных свойств, восстанавливается водородом Fe2O3+3H2=2Fe+3H2O Fe(OH)2 - амфотерный гидроксид с преобладанием основных свойств
Окисление 6Fe(OH)2+O2=2Fe3O4+6H2O
![]()
![]()
![]()
FeO(OH) (ржавчина) - метагидроксид железа - амфотерный гидроксид с преобладанием основных свойств.
Соединения элементов семейства железа в степени окисления +2 сходны между собой. В состоянии высших степеней окисления они проявляют окислительные свойства.
Восстановление соединений Fe(III)
Соединения Fe(III) –слабые окислители в кислой среде Fe2(SO4)3+H2S=2FeSO4+H2SO4+S Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4 2Fe2(SO4)3+2(NH3OH)HSO4=4FeSO4+N2O+4H2SO4+H2O Fe2(SO4)3+2KI=2FeSO4+K2SO4+I2
Влияние комплексообразования: 4K3[Fe(CN)6]+4KOH(конц)=4K4[Fe(CN)6]+2H2O+O2
Гидролиз
Гидролиз под действием производных слабых кислот
Fe2(SO4)3+3Na2S+4H2O=2FeOOH+3Na2SO4+3H2S Fe2(SO4)3+3Na2CO3+H2O=2FeOOH+3Na2SO4+3CO2
Биологическая роль железа
Т
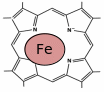 ранспорт
кислорода. Железо входит в ферменты в
виде комплекса, который называется
гем. Гем присутствует в гемоглобине, в
котором 4 активных центра (эмпирическая
формула – (C738H1166O208S2Fe)4).
ранспорт
кислорода. Железо входит в ферменты в
виде комплекса, который называется
гем. Гем присутствует в гемоглобине, в
котором 4 активных центра (эмпирическая
формула – (C738H1166O208S2Fe)4).Комплекс Fe2+ с порфирином. Гем содержит железо в центре порфиринового кольца (на рисунке)
Электрохимический транспорт: перенос энергии. Ферменты: пероксидаза, карбоксилаза, оксигеназа, нитрогеназа, гидрогеназа.
Ферредексина: [Fe4S4]2++e-=[Fe4S4]+ (2Fe3+:2Fe2+=Fe3+:3Fe2+)
Пероксидаза содержится преимущественно в лейкоцитах и слизистой тонкого кишечника у человека.
Комплексы железа, отличные от гема, встречаются, в важном ферменте рибонуклеотидредуктазе, который участвует в синтезе ДНК.
№99. Комплексные соединения железа, кобальта и никеля.
У элементов триады железа ярко проявляется способность d-элементов образовывать комплексные соединения.
Известны катионные аквакомплексы [Э(H2O)6]2+ и [Э(H2O)6]3+, аммиачные комплексы [Э(NH3)6]2+ и [Э(NH3)6]3+. Устойчивость аммиачных комплексов увеличивается в ряду Fe – Co – Ni. [Fe(NH3)6]2+ и [Co(NH3)6]2+ устойчивы только в твердой фазе и насыщенном водном растворе аммиака, аммиачный комплекс [Ni(NH3)6]2+ в водном растворе устойчив. Аммиачный комплекс железа (III) не устойчив, никеля (III) – не существует, а [Co(NH3)6]2+ – устойчив.
Многочисленны анионные комплексы элементов триады железа. Характерны галогенидные M+[Э2+Г3], M+2[Э2+Г4], M+3[Э2+Г6] и др., роданидные M+2[Э2+(CNS)4], M+4[Э2+(CNS)6], оксалатные M+2[Э2+(C2O4)2], M+3[Э3+(C2O4)3] комплексы. Особенно устойчивы цианидные комплексы, например: K3[Fe(CN)6] и K4[Fe(CN)6], которые используются в аналитической химии для обнаружения ионов Fe2+ и Fe3+.
Элементы триады железа образуют большое количество комплексных соединений с органическими лигандами, например: диметилглиоксимат никеля – реактив Чугаева и гемоглобин – внутрикомплексное соединение железа.
Соль Мора: формула - FeSO4·(NH4)2SO4·6H2O
Получение: FeSO4+(NH4)2SO4+6H2O=(NH4) 2Fe(SO4)2·6H2O
Взаимодействие соли Мора с раствором щёлочи:
2NaOH+(NH4)2Fe(SO4)2·6H2O
= Fe(OH)2 +Na2SO4+(NH4)2SO4
+ 6H2O
+Na2SO4+(NH4)2SO4
+ 6H2O
Качественной реакцией на железо (II) является реакция с K3[Fe(CN)6] (красной
кровяной солью). В данной реакции образуется синий малорастворимый осадок –
“турнбулева синь”:
(NH4)2Fe(SO4)2·6H2O + K3[Fe(CN)6] = KFe[Fe(CN)6] + K2SO4 + (NH4)2SO4 + 6H2O 3K3[Fe(CN)6] + 3Fe2+=3KFeII[FeIII(CN)6] (синее окрашивание)+6K+
Гексацианоферрат(II) калия (жёлтая кровяная соль): формула - K4[Fe(CN)6] Получение: 3Fe(CN)2 + 4KOH = 2Fe(OH)2↓ + K4[Fe(CN)6]
Служит качественной реакцией на ионы Fe3+. При взаимодействии ионов Fe3+ и [Fe(CN)6]4+ выпадает ярко-синий осадок берлинской лазури:
FeIIICl3+K4[FeII(CN)6]→KFeIII[FeII(CN)6]+3KCl K4[Fe(CN)6]+Fe3+=KFeIII[FeII(CN)6]↓+3K+
С H2SO4: K4[Fe(CN)6]+6H2SO4(конц)=(t) 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑.
Окисление 2K4[Fe(CN)6]+H2O2+2HCl=2K3[Fe(CN)6]+2KCl+2H2O
Влияние комплексообразования на устойчивость степени окисления +3 у кобальта и железа
Амфотерность гидроксидов железа и в определенной мере кобальта предопределяет возможность образования гидроксокомплексов, что особенно характерно для степени окисления +3.
Отсюда следует также вывод о том, что в комплексных соединениях устойчивость степени окисления +3 для кобальта существенно возрастает и становится наиболее характерной для этого элемента.
№100.. Подгруппа меди (11 группа, Металлы IВ группы)
|
Cu |
Ag |
Au |
Порядковый номер |
29 |
47 |
79 |
Валентные электроны |
3d104s1 |
3d105s1 |
4f145d106s1 |
Степени окисления |
1,2,(3) |
1,(2),(3) |
1,(2),3,(5) |
Тип решётки |
кубическая гранецентрированная |
||
У Cu, Ag и Au наблюдается проскок электрона. Общая электронная формула ns1(n-1)d10. Возбужденного состояния нет. Особенность заполнения d-подуровня объясняется его высокой устойчивостью. Это обуславливает химическую инертность простых веществ. Поэтому Ag и Au являются благородными металлами.
Химические свойства Cu, Ag, Au
C
 u,
Ag, Au уменьшение химической активности
u,
Ag, Au уменьшение химической активностиCu – наименее реакционно-способный 3d метал: 2Cu+O22CuO
 Cu2O+½O2
Cu+Cl2=CuCl2
2Cu+I2=2CuI
Cu2O+½O2
Cu+Cl2=CuCl2
2Cu+I2=2CuICu растворяется в кислотах-окислителях: 2Cu+2H2SO4(разб)+O2=2CuSO4+2H2O (медленно) Cu+2H2SO4(конц)=CuSO4+SO2+2H2O
Cu растворяется в результате комплексообразования 2Cu+4HI(конц)=2H[CuI2]+H2 2Cu+8NH3(конц)+O2+2H2O=2[Cu(NH3)4](OH)2
Cu реагирует при нагревании с S, Se, Te, P, Si, B: Cu+S=CuS Cu+2P=CuP2 15Cu+4Si=Cu15Si4
Ag, Au – благородные металлы, не реагируют с кислородом
Ag окисляется в кислой среде: Ag+2HNO3(конц)=AgNO3+NO2+H2O 2Ag+4HI(конц)=2H[AgI2]+H2 4Ag+2H2S+O2=2Ag2S+2H2O (очень медленно)
Au окисляется сильными окислителями Au+HNO3+4HCl=H[AuCl4]+NO+2H2O 2Au+2HCl+3Cl2=2H[AuCl4]
Ag, Au растворяются в цианидах 4Au+8NaCN+O2+H2O=4Na[Au(CN)2]+4NaOH (аналогично для серебра)
Ag, Au реагируют с галогенами, халькогенами (16 группа – O, S, Se, Te, Po) и фосфором P: 2Ag + Cl2= 2AgCl 2Au+Cl2=2AuCl3 4Au + 3P2= 2Au2P3
Оксиды и гидроксиды подгруппы меди
Оксид
и гидроксид Cu(II)
CuSO4+2NaOH Cu(OH)2+Na2SO4
CuSO4+2NaOH
Cu(OH)2+Na2SO4
CuSO4+2NaOH CuO+H2O+Na2SO4
Cu(OH)2–амфотерный
гидроксид,
Cu(OH)2+2HCl=CuCl2+2H2O
Cu(OH)2+2KOH(конц)=K2[Cu(OH)4]
CuO+H2O+Na2SO4
Cu(OH)2–амфотерный
гидроксид,
Cu(OH)2+2HCl=CuCl2+2H2O
Cu(OH)2+2KOH(конц)=K2[Cu(OH)4]
Гидроксид при стоянии легко отщепляет воду и при этом чернеет: Cu(OH)2=CuO+H2O
Оксид Ag(II) 2AgNO3+4KOH+K2S2O8=2AgO+2K2SO4+2H2O+2KNO3 диамагнитен AgIAgIIIO, AgO+2HClO4+3H2O=Ag(ClO4)2·4H2O ([Ag(H2O)4]2+) 2AgO+4HCl=2AgCl+Cl2+2H2O
Оксиды Cu, Ag, Au(I)
Оксиды нерастворимы в воде, гидроксиды неустойчивы Ag2O+H2O⇔2Ag++2OH– Ag2O+2HNO3=2AgNO3+H2O Ag2O + KOH ≠ не идёт 2AgNO3+2KOH=Ag2O+2KNO3+H2O Ag2O+4NH3+H2O=2[Ag(NH3)2]OH (аналогично Cu, Au)
Производные Ag+ плохо растворимы, кроме AgF, AgNO3, AgClO4 Реакции диспропорционирования Cu2O+H2SO4=CuSO4+Cu +H2O Au2O+2H2SO4=H[Au(SO4)2]+Au+H2O
Соли кислородных кислот Cu+, Au+ разлагаются водой
Соединения Cu, Ag и Au
Cu3+, Ag2+, Ag3+, Au3+-окислители
Cu1+, Au1+-диспропорционируютвводномрастворе
Ag1+, Cu2+ -наиболее устойчивы в водном растворе
Комплексные соединения. Комплексы Cu(II)
1. Аминокомплексы
Cu(OH)2+4NH3(р-р)+2H2O=[Cu(NH3)4(H2O)2](OH)2
Cu(OH)2+2en+2H2O=[Cu(en)2(H2O)2](OH)2 (хелатный комплекс)
[Cu(NH3)4(H2O)2]SO4+KOH≠не идёт
[Cu(NH3)4(H2O)2]SO4+2H2S=CuS+(NH4)2SO4+(NH4)2S+2H2O
2. Геометрия комплексов
CuCl2+2KCl=K2[CuCl4] искаженный тетраэдр
CuSO4+NH3(конц)=[Cu(NH3)4]SO4 квадрат
(NH4)2[Cu(NO3)4(H2O)] квадратная пирамида
CuCl2+CH3NH3Cl=(CH3NH3)3[CuCl5] тригональная бипирамида
CuCl2+CsCl=Cs[CuCl3] искаженный октаэдр
3. Наиболее устойчивые производные Au(I)
AuI+2PMe3=[Au(PMe3)2]I
[Au(PMe3)2]I+HCl≠не идёт
Na[Au(CN)2]+HCl
 AuCN↓+HCN+NaCl
AuCN↓+HCN+NaCl
Биологическая роль меди.
Медь является необходимым микроэлементом растительных и животных организмов. Это связано со следующими ее особенностями. Во-первых, ионы меди по сравнению с ионами других металлов жизни активнее реагируют и образуют более устойчивые комплексы с аминокислотами и белками. Во-вторых, ионы меди служат исключительно эффективными катализаторами, особенно в сочетании с белками. В-третьих, медь легко переходит из одного валентного состояния в другое, что особенно благоприятствует ее метаболическим функциям. Например, при активации молекулы кислорода в реакциях окисления органических соединений.
Медьсодержащие ферменты окисления оксигеназы [ОКГСu+] присоединяют молекулу кислорода с образованием пероксидной цепочки и окислением меди из Сu+ в Сu2+. Образовавшийся комплекс фермента с молекулой кислорода окисляет биосубстрат.
Общие закономерности (выводы)
1.Высшаяс.о. не соответствует числу валентных электронов, наиболее устойчивая с.о. различна для Cu, Ag, Au
2.С уменьшением с.о. усиливаются основные свойства, с увеличением с.о. – кислотные. Комплексообразование превалирует над кислотно-основными свойствами.
№101. Подгруппа цинка (12 группа, Металлы IIВ группы)
|
Zn |
Cd |
Hg |
|
Порядковый номер |
30 |
48 |
80 |
|
Валентные электроны |
3d104s2 |
4d105s2 |
4f145d106s2 |
|
Степени окисления |
2 |
(1),2 |
1,2 |
|
Структура |
искажённая гексагональная типа Mg |
очень сложная структура, основанная на гантелях Hg-Hg, не имеет аналогов |
||
Цинк является наиболее электроположительным элементом в группе, следовательно, он является хорошим восстановителем. Окислительно-восстановительный статус группы равен +2, причём ионы имеют достаточно стабильную d10 электронную конфигурацию, с заполненными подуровнями. Однако, ртуть легко переходит к статусу +1. Обычно, как, например, в ионах Hg22+, два иона ртути (I) соединяются в виде металл-металл и образуют диамагнитный образец. Кадмий может также формировать связи, в которых окислительно-восстановительный статус металла равен +1. Так же как и для ртути, в результате формируется связь металл-металл в виде диамагнитного соединения, в котором нет непарных электронов, делающих соединение сильно химически активным.
Особенность элементов подгруппы цинка: металлы12 группы – промежуточное положение между переходными металлами и p-элементами
Высшая с.о. наиболее устойчива для Zn, Cd, Hg; она соответствует числу валентных s-электронов. Вниз по группе увеличивается устойчивость с.о. +1.
Химические свойства Zn, Cd, Hg
Z
 n,
Cd, Hg Уменьшение
химической активности
n,
Cd, Hg Уменьшение
химической активностиZn, Cd реагируют с O2
2Zn+O2
 2ZnO
2Cd+O2
2ZnO
2Cd+O2 2CdO
2CdO
Zn, Cd растворяются в кислотах
Zn+H2SO4=ZnSO4+H2 Cd+HCl=CdCl2+H2
Zn растворяется с образованием комплексов:
Zn+2NaOH+2H2O=Na2[Zn(OH)4]+H2
Zn+4NH3+2H2O=[Zn(NH3)4](OH)2+H2
3Zn+NaNO2+5NaOH+5H2O=3Na2[Zn(OH)4]+NH3
Zn, Cd, Hg окисляются в кислой среде:
Me+2H2SO4(конц)=MeSO4+SO2+2H2O
Hg+4HNO3(конц)=Hg(NO3)2+2NO2+2H2O
Zn, Cd, Hg реагируют с галогенами, халькогенами, не реагируют с азотом, углеродом и водородом.:
Zn(тв)+Cl2=ZnCl2(тв) Cd(тв)+S(ж)=CdS(тв) Hg(ж)+Br2(ж)=HgBr2(ж)
Zn, Cd реагируют с фосфором: Zn+P=Zn3P2 Cd+P=CdP2
Zn реагирует с водяным паром Zn + H2O (газ) = ZnO+ H2
Hg образует амальгамы Na+Hg=Na3Hg2+NaHg+NaHg2+…
2NaHg2+2H2O=2NaOH+4Hg+H2
NaHg+HCl+NH3=NH4Hg+NaCl (амальгама аммония)
2NH4Hg=2Hg+2NH3+H2
