
- •7. *Общая характеристика и химические свойства германия, олова и свинца.
- •8.* Общая характеристика и химические свойства азота.
- •Получение
- •Химические свойства
- •Химические свойства
- •9. *Общая характеристика и химические свойства фосфора его получение в промышленности.
- •10. *Общая характеристика и химические свойства мышьяка, сурьмы и висмута.
- •11. Получение кислорода и пероксида водорода в промышленности и в лаборатории.
- •12. *Общая характеристика и химические свойства серы, селена и теллура.
- •13. Получение водорода в промышленности.
- •14.* Общая характеристика и химические свойства галогенов.
- •14. Фториды ксенона
- •15. Общая характеристика и свойства меди, золота, серебра
- •16. Общая характеристика и химические свойства элементов подгруппы цинка.
- •17. Общая характеристика и химические свойства подгруппы скандия.
- •18. Общая характеристика и химические свойства металлов подгруппы титана.
- •19. Общая характеристика и химические свойства элементов подгруппы ванадия.
- •20.* Общая характеристика и химические свойства хрома, молибдена и вольфрама.
- •21.* Общая характеристика и химические свойства марганца, технеция и рения.
- •22. Общая характеристика и химические свойства железа, кобальта и никеля.
- •23. Общая характеристика и химические свойства платиновых металлов.
- •24. Получение железа, никеля, хрома в промышленности.
- •25. Пирометаллургические способы получения металлов (свинец, медь, цинк) из сульфидных руд
- •26.Окислительное действие нитрата калия и хлората калия при нагревании (сплавлении).
- •27. Образование аммиакатов и гидроксокомплексов металлов и их разрушение кислотами и при нагревании.
- •28. Реакции термического разложения некоторых кислых солей ( NaHco3, NaH2po4, Na2hpo4, NaHso4).
28. Реакции термического разложения некоторых кислых солей ( NaHco3, NaH2po4, Na2hpo4, NaHso4).
2NaHCO3 =(t) Na2CO3 + CO2+ H2O NaH2PO4=(t) NaPO3 + H2O
2Na2HPO4=(t) Na4P2O7 + H2O
2NaHSO4=(t) Na2S2O7 + H2O
-
29. Гидролиз солей (по катиону, по аниону, одновременный гидролиз двух солей).
Поляризационное взаимодействие катионов и анионов с сильно полярными молекулами воды ведет к особой химической реакции ионного обмена, называемой гидролизом солей.
Молекулярная причина гидролиза – поляризационное взаимодействие ионов с сильно полярной молекулой воды. В результате катионы «вырывают» из молекулы воды ОН-, а анион – Н+. Другими словами, катионы и анионы вторгаются в равновесие диссоциации воды, нарушают его, в результате в случае катиона р-р становится кислым (гидролиз по катиону), в случае аниона – щелочным (гидролиз по аниону).
Гидролиз соли по катиону и по аниону одновременно можно представить в общем виде следующим образом:
Kt+ + A- + H2O=KtOH + HA
Константа гидролиза имеет вид:
К гидр=Kw/(Kдис осн*Кдис кисл)
Пусть общая концентрация соли, гидролизованной одновременно по катиону и аниону, равна с моль/л, степень гидролиза составляет h. Тогда:
[KtOH]=[HA]=hc
[Kt+]=[A-]=c-hc отсюда
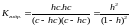 .
.
Гидролиз по катиону:
Продукты гидролиза подавляют вторую ступень, поэтому гидролиз реально протекает лишь по первой ступени: Ktn+ + H2O=KtOH(n-1)+ + H+
Кгидр=Kw/Kдис осн
Константа гидролиза − константа равновесия процесса гидролиза. Пусть с – общая концентрация катиона (общ. концентрация соли в случае симметричного электролита); h – степень гидролиза катиона Kt. Равновесные концентрации составляют:
[KtOH(n-1)+]=[H+]=hc;
[Ktn+]=c-hc
 .
.
Способы подавления гидролиза:
1) охлаждение раствора;
2) добавление кислоты в раствор для подавления гидролиза по катиону, добавление щелочи в раствор для подавления гидролиза по аниону.
Гидролиз по аниону: Продукты гидролиза подавляют вторую ступень, поэтому гидролиз реально протекает лишь по первой ступени: Am- + H2O= HA(m-1)- + OH- .
Kгидр=Kw/Kдис кисл
Константа гидролиза − константа равновесия процесса гидролиза. Пусть с – общая концентрация катиона (общ. концентрация соли в случае симметричного электролита); h – степень гидролиза аниона Аn. Равновесные концентрации составляют: [HA(m-1)-]=[OH--]=hc
[Am-]=c-hc
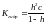 .
.
Способы усиления гидролиза солей:
1) разбавление раствора соли;
2) нагрев раствора, поскольку энтальпии гидролиза положительны;
3) добавление щелочи в раствор для усиления гидролиза по катиону, добавление кислоты в раствор для усиления гидролиза по аниону.
