
- •История открытия топливного элемента.
- •Типы и разновидность топливных элементов.
- •Топливные элементы на расплаве карбоната (рктэ)
- •Топливные элементы на основе фосфорной кислоты (фктэ)
- •Твердооксидные топливные элементы (тотэ)
- •Топливные элементы с прямым окислением метанола (помтэ)
- •Щелочные топливные элементы (щтэ)
- •Модуль топливного элемента
Топливные элементы представляют собой очень эффективный, надежный, долговечный и экологически чистый способ получения энергии.
Топливный элемент – это гальванический элемент, в котором химическая энергия топлива преобразуется электрохимическим путем в электрическую энергию. Топливо и окислитель при этом непрерывно и раздельно подводятся к ячейке, в которой они реагируют на двух электродах.


Рис.1 Внешний вид топливного элемента
Топливный элемент это первичный элемент, который в принципе производит ток, пока к нему подводятся активные вещества. В отличие от этого обычные первичные элементы получают электрическую энергию из «активной массы» электродных пластин и поэтому обладают ограниченной емкостью. То же самое можно сказать и обо всех вторичных элементах, так называемых аккумуляторах, которые после разряда активной массы должны снова заряжаться от внешнего источника тока.
К топливам, которые можно использовать для подобных элементов, относятся наряду с природными видами топлива, такими, как уголь и углеводороды, также и вещества, которые могут быть из них получены простым путем: спирты, альдегиды, окись углерода и водород.
Эти источники энергии обладают рядом преимуществ. К ним относятся: относительно малые удельный объем и вес, отсутствие движущихся частей, бесшумность и хорошая способность к перегрузке. Коэффициент полезного действия лежит между 30 и 75% и растет с уменьшением нагрузки в противоположность теплосиловым установкам и двигателям внутреннего сгорания. Достоинствами топливных элементов являются также доступность топлива, надежность (в топливном элементе отсутствуют движущиеся части), долговечность и простота эксплуатации.
Один из основных недостатков топливных элементов на сегодняшний день — их относительно высокая стоимость, но этот недостаток может быть вскоре преодолен — все больше компаний выпускают коммерческие образцы топливных элементов, они непрерывно совершенствуются, а их стоимость снижается.
Наиболее эффективно использование в качестве топлива чистого водорода, однако это потребует создания специальной инфраструктуры для его выработки и транспортировки. В настоящее время все коммерческие образцы используют природный газ и подобное топливо. Автотранспортные средства могут использовать обыкновенный бензин, что позволит сохранить существующую развитую сеть автозаправочных станций. Однако использование такого топлива приводит к вредным выбросам в атмосферу (хотя и очень низким) и усложняет (а следовательно, и удорожает) топливный элемент. В перспективе рассматривается возможность использования экологически чистых возобновляемых источников энергии (например, солнечной энергии или энергии ветра) для разложения воды на водород и кислород методом электролиза, а затем преобразования получившегося топлива в топливном элементе. Такие комбинированные установки, работающие в замкнутом цикле, могут представлять собой совершенно экологически чистый, надежный, долговечный и эффективный источник энергии.
Преимущества топливных элементов делают их пригодными для ряда интересных областей применения. Первоначально применявшиеся лишь в космической отрасли, в настоящее время топливные элементы все активней используются в самых разных областях — как стационарные электростанции, автономные источники тепло- и электроснабжения зданий, двигатели транспортных средств, источники питания ноутбуков и мобильных телефонов. Часть этих устройств является лабораторными прототипами, часть проходит предсерийные испытания или используется в демонстрационных целях, но многие модели выпускаются серийно и применяются в коммерческих проектах.
В топливных элементах содержащаяся в топливе энергия при электрохимическом производстве энергии непосредственно преобразуется в электрическую. Исключается окольный, связанный с потерями путь через тепловую и механическую энергии. Свободная энергия реакции окисления топлива
ΔG = ΔH – TΔS
Определяет э.д.с элемента:
E0
=
-
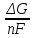
Топливо и окислитель подводятся к соответствующим электродам. Благодаря электрохимической активности реагентов на них устанавливается определенный потенциал: топливный электрод становится отрицательным, а кислородный электрод – положительным полюсом элемента. При соединении обоих полюсов через нагрузочное сопротивление реагенты электрохимически преобразуются, причем освобождающиеся на топливном электроде электроны текут через внешнюю цепь к противоположному электроду.
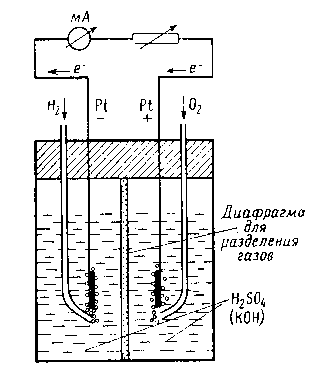
Рис. 2 Устройство Н2 – О2 – элемента.
Принцип работы топливного элемента можно пояснить на примере Н2 – О2 – элемента. В электролит с ионной проводимостью (например, серная кислота или калийная щелочь) погружены два платиновых электрода (рис. 2). Один электрод омывается водородом (отрицательный полюс), другой – кислородом (положительный полюс). Между двумя полюсами элемента возникает стационарное напряжение 0,9-1,2 В. При соединении обоих полюсов через нагрузочное сопротивление на каждую электрохимически прореагировавшую молекулу водорода от отрицательного полюса элемента текут два электрона к положительному полюсу, на котором электроны реагируют с адсорбированным кислородом. В отличие от обычного сгорания водорода и кислорода электрохимическое взаимодействие («холодное горение») происходит на двух отдельных друг от друга местах реакции. В Н2 – О2 – элементе с кислым электролитом под действием каталитических свойств электрода молекула Н2 на поверхности электрода распадается на два атома (Рис. 3). Атомы переходят в раствор в виде протонов, оставляя два электрона, которые текут через амперметр и нагрузочное сопротивление к положительному полюсу. На положительном полюсе кислород реагирует с протонами электролита и с двумя электронами с образованием воды.

Рис. 3
Отрицательный полюс:
2Надс. → 2H+ + 2е-
Положительный полюс:
1/2O2 + 2Н+ + 2е- → Н2О.
Эти формулы отражают идеальный суммарный процесс электрохимического восстановление кислорода. Фактически реакция усложняется образованием Н2О2 и окислов металла кислородного электрода. Потребляемые на кислородном электроде ионы Н+ вновь преобразуется на водородном электроде.
Суммарная реакция:
Н2 + 1/2 O2 → Н2О2
Электрохимическая реакция Н2 и О2 обратно электролиз воды, при котором благодаря приложение напряжения от внешнего источника тока называется процесс разложения воды на Н2 и О2. Как и в любом элементе для преобразования химической энергии в электрическую, электродвижущая сила (э.д.с.) Н2 – О2 – элемента определяется свободной энергии реакции. При низких температурах (<150 oC) теоретическое значение э.д.с. не достигается, так как ионизация кислорода протекает через промежуточные стадии образования Н2О2.
Э.д.с. топливных элементов, как правило, имеет порядок 1 В. отдача потоку электрохимического процесс зависит от количества зарядов, участвующих в элементарном акте реакции. При взаимодействии 1 моль водорода с 0 ,5 моль кислорода получается 2 фарадей.
Топливные элементы представляют собой очень эффективный, надежный, долговечный и экологически чистый способ получения энергии.
Первоначально применявшиеся лишь в космической отрасли, в настоящее время топливные элементы все активней используются в самых разных областях — как стационарные электростанции, автономные источники тепло- и электроснабжения зданий, двигатели транспортных средств, источники питания ноутбуков и мобильных телефонов. Часть этих устройств является лабораторными прототипами, часть проходит предсерийные испытания или используется в демонстрационных целях, но многие модели выпускаются серийно и применяются в коммерческих проектах.
История открытия топливного элемента.
Основные даты:
1838 Проведено первое систематическое научное исследование по эффекту топливного элемента/ячейки;
1845 Изобретен первый топливный элемент/ячейка (H2SO4 + платиновые электроды, H2 и O2);
1896 Разработан первый топливный элемент/ячейка для домашнего использования;
1921 Разрабатывается первый топливный элемент/ячейка на расплаве карбоната;
1930-e Исследуются топливные элементы/ячейки со щелочным электролитом;
1962 В США и Нидерландах развиваются исследования технологии твердых оксидов.
Принцип действия топливных элементов был открыт в 1839 году. Английский физик Вильям Гроув в 1839 г. исследовал электролиз воды в растворах серной кислоты на платиновых электродах, собирая водород и кислород в стеклянные сосуды. Отключив электролизер от внешнего источника тока и замкнув электроды, ученый обнаружил, что объем выделившихся газов в сосудах уменьшается, а в цепи вырабатывается электрический ток. Очевидно, Гроув реализовал гальванический элемент с двумя газовыми электродами и кислотным электролитом:
(–) (Pt) H2 | H2SO4 | O2 (Pt) (+).

Вильям Гроув (1811–1896)
Позднее, в 1842 г., Гроув изобрел прообраз ТЭ с электродами из платиновой фольги, покрытой слоем губчатой платины и H2SO4 в качестве электролита. Эту систему ученый использовал уже как ХИТ для электрохимического разложения H2O (рис. 4).
Рис. 4. Оригинальный гальванический элемент Гроува
Термин «топливный элемент» (Fuel Cell, FC) был предложен в 1889 г. английскими химиками Людвигом Мондом и Чарльзом Лангером, которые изучали возможность практического применения открытия Гроува, используя в качестве окислителя воздух, а в качестве восстановителя – различные виды топлива, в том числе метан.

Людвиг Монд (1839–1909)
Большую роль в судьбе топливных элементов сыграл немецкий ученый Вильгельм Фридрих Оствальд, всемирно известный организатор и первый президент Немецкого электрохимического общества. В 1894 году на одном из первых собраний этого общества Оствальд произносит речь во славу топливных элементов: «Я не знаю, достаточно ли ясно представляют себе, сколь несовершенен для нашего времени высоко развитой техники важнейший источник энергии, которым мы сейчас пользуемся, — паровая машина...»

Вильгельм Оствальд (1853–1932)
В то время еще господствовали пар и уголь, и на тепловых электростанциях КПД достигал только 10 процентов.
В. Оствальд продолжал: «...Путь, которым можно решить самый важный из всех технических вопросов — вопрос получения дешевой энергии, должен быть теперь найден электрохимией. Если мы будем иметь элемент, производящий электроэнергию непосредственно из угля и кислорода воздуха в количестве, более или менее соответствующем теоретическому, то это будет техническим переворотом, превосходящим по своему значению изобретение паровой машины... Как будет устроен такой гальванический элемент, в настоящее время можно только предполагать... В таком элементе происходили бы те же самые химические процессы, что и в обычной печи: с одной стороны засыпался бы уголь, с другой — подавался кислород, а удалялся бы продукт их взаимодействия — углекислота... Только подумайте, как изменятся индустриальные районы! Ни дыма, ни сажи, ни паровых машин, никакого огня…»
Оствальд предсказал топливным элементам великое будущее и выдвинул идею использования топливных элементов для крупномасштабной генерации электроэнергии с использованием угля в качестве восстановителя. Однако реализовать эту идею на практике не удалось до сих пор.
В конце 1930х начинается работа над топливными элементами со щелочным электролитом и к 1939 году построен элемент, использующую никелированные электроды под высоким давлением. В ходе Второй Мировой Войны разрабатываются топливные элементы для подлодок британского флота и в 1958 году представлена топливная сборка, состоящая из щелочных топливных элементов диаметром чуть более 25 см.
В 1950х и 1960х годах одна из самых ответственных задач для топливных элементов родилась из потребности Национального управления по аэронавтике и исследованиям космического пространства США (NASA) в источниках энергии для длительных космических миссий. Щелочной топливный элемент NASA использует в качестве топлива водород и кислород, соединяя эти два химических элемента в электрохимической реакции. На выходе получаются три полезных в космическом полете побочных продукта реакции – электричество для питания космического аппарата, вода для питья и систем охлаждения и тепло для согревания астронавтов.
Интерес еще сильнее возрос в 1980е, когда промышленный мир пережил нехватку нефтяного топлива. В этот же период мировые страны также озаботились проблемой загрязнения воздуха и рассматривали способы экологически чистого получения электроэнергии.
В настоящее время технология производства топливных элементов (ячеек) переживает этап бурного развития.
