
- •Абсолютная и относительная погрешности.
- •Классификация погрешностей
- •5. Генеральная и выборочная совокупность
- •6. Среднее арифметическое выборочной совокупности. Случайное отклонение.
- •7. Выборочное стандартное отклонение. Дисперсия
- •8. Среднеквадратичное отклонение
- •9. Нормальное распределение
- •10. Распределение Стьюдента
- •11. Требование к пробе анализа. Генеральная, средняя, лабораторная и анализируемая проба
- •12. Отбор проб газов, жидкостей и твердых веществ.
- •13.Проб продуктов питания и продовольственного сырья.
- •14. Принципы подготовки проб к анализу.
- •15. Метод разложения проб
- •16. Растворение проб.
- •17. Сплавление пробы.
- •18. Пиролиз пробы.
- •19. Методы разделения и концентрирования проб.
- •20. Сущность титриметрии
- •21. Стандартизация растворов титрантов.
- •22. Точка эквивалентности
- •27. Гальванический элемент
- •29. Метод прямой кондуктометрии
- •30. Безэлектродная кондуктометрия
- •32. Сущность потенциометрического анализа. Окислительно-восстановительный потенциал и его зависимость от концентрации и температуры.
- •40. Кулонометрия при постоянной силе тока
- •41. Теоретические основы вольтамперометрии
- •42. Схема установки полярографического анализа
- •43. Методы полярографии
- •44. Метод дифференциальной полярографии
- •45. Инверсионная вольтамперометрия
- •49. Принципиальная схема хроматографа
- •52. Радиоактивность. Методы регистрации радиоактивности
27. Гальванический элемент
28. Общие принципы электрохимических методов анализа. Классификация электродов и электродных систем.
Данные методы анализа связаны с направленным движением заряженных частиц, т. е. с электрическим током, возникающим при действии ЭДС или разности потенциалов. В электрохимических процессах электрический ток протекает в проводниках второго рода – электролитах, т. е. в растворах веществ. Заряженными частицами в электролитах явл-ся положительные и отрицательные ионы, образующиеся при электролитической диссоциации полярных молекул диссоциированного вещ-ва (различных солей, кислот, оснований) полярными молекулами р-ля (воды) или другими физико-химическими механизмами.
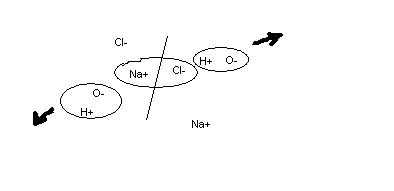
В электрохимических устройствах имеется как min 2 электрода, причем на одном из них постоянно или в данный момент времени возникает или подается положительный потенциал, а на втором электроде – отрицательный. При этом положительные ионы электролита будут двигаться к отриц электроду, а отрицательные – к положит. Возникает ток в электролите.
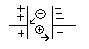
И только возле самих электродов возможна отдача отрицательными ионами электронов плюсовому электроду, а плюсовые ионы могут забрать электроны у отрицательного электрода.
Электроды и электродные системы классифицируются:
- по агрегатному состоянию: твердые (металлические), жидкие (ртуть), газообразные (водород)
- кинематическому исполнению: неподвижные, подвижные (совершают поступательное и вращат движение)
- по контакту с электролитом: контактирующие, безконтактные
- по способу взаимодействия с электролитами: пассивные, активные (могут растворяться в электролитах)
- твердые электроды: металлические (золото), неметалич (графит)
- электродные системы: с наложением тока из вне (с электродам подается внешняя ЭДС), без наложения тока из вне.
29. Метод прямой кондуктометрии
30. Безэлектродная кондуктометрия
31. Кондуктометрическое титрование и его области применения.
Наибольшее распространение имеет косвенный метод кондуктометрии – кондуктометрическое титрование, кот широко применяется при титровании окрашенных и мутных р-ров, когда обычные цветовые индикаторы не применимы, т к изменение цвета в точки эквивалентности увидеть невозможно. При титровании определяемого вещ-ва А р-ром вещ-ва В в точке эквивалентности наступает резкое изменение электропроводности р-ра. Например при титровании с получением нерастворимого или слабо диссоциирующего соединения при добавлении титранта (при его недостатке) электропроводность р-ра снижается, т к число свободных ионов уменьшается при их переходе в нерастворимое состояние, а в случае избытка титранта электропроводность р-ра начинает увеличиваться.
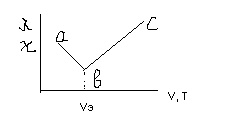
Участок ab соответствует недостатку титранта, bc – избытку. Min на кривой титрования – точка b соответствует минимуму ионов носителя токов, а значит точки эквивалентности. Т. о. по эквивалентному объему Vэ титранта можно определить концентрацию растворенного вещ-ва в р-ре. Углы наклонов участков ab и bc зависят от подвижности ионов, получаемых из вещ-ва А и В.
Замена менее подвижных ионов на более подвижные приводит к росту электропроводности р-ра и наоборот. Увеличение концентрации иона также приводит к росту электропроводности. Поэтому быстрота увеличения или уменьшения электропроводности при титровании зависит от соотношения: подвижности ионов, имеющихся в р-ре до и после добавления титранта; от концентрации ионов до и после добавления титранта. Подвижность иона, т е быстрота его разгона в электрическом поле определяется его электрическим зарядом и массой, кот зависит от атомной массы атома.
Т е больше заряд и меньше массавыше подвижность иона.
Встречаются и такие кривые титрования:
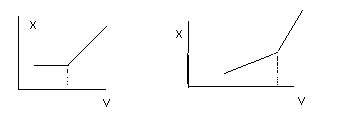
Точки перегиба линии соотв точкам эквивалентности, но 1 рисунок характерен при титровании водного р-ра нитрата серебра водным р-ром BaCl2. При избытке титранта ионов серебра в р-ре не остается, но в р-ре добавляются ионы Ba и Cl.
2 рисунок характерен процессам титрования слабой кислоты сильным основанием, либо наоборот слабого основания сильной кислотой.
