
- •1 Параметры и связи параметров движения мт
- •3 Криволинейное дв-е мт и его параметры.
- •4 Законы Ньютона для мт
- •5 Эквивалентность работы и энергии при дв-и мт
- •6 Законы взаимодействия мт(сохр-я) в завис-ти от типа взаим-я
- •7 Энергия мт в поле центральных сил
- •8 Силы, проявляющиеся при взаимодействии тел в природе
- •9 Колебательное движение материальной точки
- •10 Понятие центра массы тела и методика определения
- •11,Момент инерции тел, пример его определения. Теорема Штейнера
- •12 Методика сложения сил, прилож-х к разл-м точкам тела и определения их вклада в изменение состояния дв-я
- •13.Параметры и основные законы вращательного движения тел
- •14 Полная механическая энергия тел, степени свободы тел
- •15. Условия статического состояния тел, виды статического состояния
- •16,Колебательное движение твёрдого тела.
- •17 Физическая модель идеального газа, микро и макро параметры
- •18.Мкт.Внутр энергия идеального газа
- •19 Распределение частиц идеального газа по скоростям
- •20.Законы — начала термодинамики
- •21,Работа газа и его теплоёмкость в изопроцессах
- •22,Закон сохранения энергии в изо- и адиабатном процессах.
- •23.Термодинамический цикл. Цикл Карно.
- •24,Теплопроводность газа
- •25 Внутреннее трение в газе
- •26,Диффузия в газе
- •27.Газ в поле тяготения. Барометрическая формула и распределение Больцмана
- •28.Уравнение политропического процесса, уравнение Пуассона
- •29.Термодинамическое определение энтропии
21,Работа газа и его теплоёмкость в изопроцессах
Работу
газа, совершаемую при изопроцессах,
можно найти следующим образом: При
изобарном процессе ( ):
):
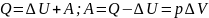 ;
;
При
изохорном процессе (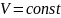 ):
):
 ;
;
При
изотермическом процессе (
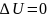 ):
):
 ;
;
При
адиабатном процессе ( ):
):
 ,
где
,
где
 - теплоёмкость газа при постоянном
объёме.
- теплоёмкость газа при постоянном
объёме.
Теплоемкость
газа — это отношение тепла, сообщенного
газу, к изменению температуры
 ,
которое при этом произошло.
,
которое при этом произошло.
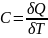
Молярная
теплоемкость — теплоемкость 1 моля
газа.
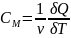
Теплоемкость идеального газа в изопроцессах:
Адиабатический.В
адиабатическом процессе теплообмена
с окружающей средой не происходит, то
есть
 .
При изменении объема температура и
давление меняются, то есть . Следовательно,
теплоемкость идеального газа в
адиабатическом процессе также равна
нулю:
.
При изменении объема температура и
давление меняются, то есть . Следовательно,
теплоемкость идеального газа в
адиабатическом процессе также равна
нулю:
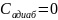 .
.
Изотермический
В
изотермическом процессе постоянна
температура, то есть
 .
При изменении объема газу передается
(или отбирается) некоторое количество
тепла. Следовательно, теплоемкость
идеального газа стремится к бесконечности:
.
При изменении объема газу передается
(или отбирается) некоторое количество
тепла. Следовательно, теплоемкость
идеального газа стремится к бесконечности:
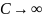 .
.
Изохорный
В
изохорическом процессе постоянен объем,
то есть
 .
Таким образом,
.
Таким образом,
 где
где
 число степеней свободы частиц газа.
число степеней свободы частиц газа.
Изобарный
В изобарном
процессе
:

Полезные
формулы:
![]() Изменение
внутренней энергии
идеального
одноатомного газа.
К
Изменение
внутренней энергии
идеального
одноатомного газа.
К![]() оличество
теплоты, переданное телу,
идет
на изменение его внутренней энергии
и
на совершение им работы (Первый
закон термодинамики).
оличество
теплоты, переданное телу,
идет
на изменение его внутренней энергии
и
на совершение им работы (Первый
закон термодинамики).
![]() Количество
теплоты при
нагревании и охлаждении газа.
Количество
теплоты при
нагревании и охлаждении газа.
![]() Работа
газа при
изобарном процессе (p = const)
Работа
газа при
изобарном процессе (p = const)
22,Закон сохранения энергии в изо- и адиабатном процессах.
Закон сохр-я энергии в изо- и адиабатном процессах и есть первое начало термодинамики. Оно гласит о том, что кол-во теплоты газа равна сумме работы, которую совершил газ и изменению внутренней энергии газа.
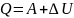
Или для бесконечно малых величин:
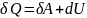
Этот закон применим для каждого изопроцесса:
Изотермический процесс (T=const)
dU=0
отсюда:
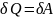 – вся теплота расходуется на совершение
работы.
– вся теплота расходуется на совершение
работы.
 ;
;
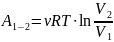
Изохорный процесс (V=const)
dV=0 ; dA=0
 – вся подводимая
теплота идёт во внутреннюю энергию.
– вся подводимая
теплота идёт во внутреннюю энергию.
 – молярная
теплоёмкость;
– молярная
теплоёмкость;
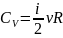 – удельная теплоёмкость
– удельная теплоёмкость
Изобарный процесс (P=const)


 – здесь полностью
выполняется 1ое начало ТД.
– здесь полностью
выполняется 1ое начало ТД.
Адиабатный процесс (Q=0)

 – газ совершает
работу
– газ совершает
работу
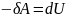 – над газом
совершают работу
– над газом
совершают работу

23.Термодинамический цикл. Цикл Карно.
Замкнутый процесс – это любой процесс, в результате которого газ выходит из одного состояния, проходит стадию и возвращается в начальное состояние.
Цикл Карно.
Состоит из 4ёх стадий. При переводе газа из состояния 1 в состояние 2 протекает изотермический процесс. При переводе газа из 2 в 3 протекает адиабатный процесс, из состояния 3 в 4 протекает изотермический, и при переводе из 4 в 1 протекает адиабатный процесс. Рассмотрим эти стадии.
1-2


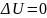
2-3
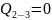 ;
;
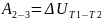
3-4


4-1
 ;
;

КПД (коэфф. полезного действия) вычисляется по ф-ле:
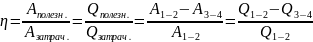

Также работу, совершаемую газом, можно найти путём вычисления площади подкривой процесса.
Зная
теплоёмкость газа, которая вычисляется
по ф-ле
 можно найти КПД замкнутого цикла:
можно найти КПД замкнутого цикла:
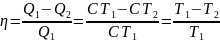
Где
 – сообщённая теплота
– сообщённая теплота
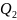 – теплота, которую
забрали у газа
– теплота, которую
забрали у газа
 – температура той
системы, от которой газ поглотил тепло
– температура той
системы, от которой газ поглотил тепло
 – температура
холодильника, при которой отводилась
теплота
– температура
холодильника, при которой отводилась
теплота
