
- •15. Соединения щелочных элементов с неметаллами – получение, свойства гидридов, галогенидов, сульфидов, нитридов, карбидов, силицидов.
- •16. Соединения щелочных элементов с кислородом – оксиды, пероксиды, надпероксиды, озониды – получение, свойства.
- •17. Гидроксиды щелочных элементов. Получение, свойства, применение.
- •19. Общая характеристика элементов II а группы.
- •20. Бериллий. Получение и свойства металлического бериллия, применение в технике бериллия и его сплавов. Гидроксид бериллия, его амфотерность. Соли бериллия и бериллаты, их гидролиз.
- •24. Переработка и использование природных соединений кальция (известь, мрамор, мел). Гипс, его свойства. Производство цемента, процессы «схватывания» и твердения цемента.
- •25. Природные воды, их состав. Жесткость воды (общая, временная, постоянная). Устранение жесткости воды: физические и химические методы. Методы деаэрации воды.
- •26. Общая характеристика элементов III а группы(13-й группы).
- •30. Алюминий. Производство металлического алюминия. Физические и химические свойства алюминия. Сплавы алюминия, их применение. Роль алюмосиликатов в неживой природе (цеолиты, глины).
- •31. Получение и строение безводных галогенидов алюминия. Гидрид алюминия и гидридоалюминаты щелочных элементов.
14.Общая характеристика щелочных элементов. Нахождение в природе. Получение щелочных элементов в металлическом состоянии из природного сырья. Изменение химической активности щелочных элементов в металлическом состоянии по ряду литий – цезий (отношение к воде, кислороду, азоту).
Щелочные металлы — это элементы 1-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы I группы): литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr, и унуненний Uue. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
В Периодической системе они следуют сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на внешнем энергетическом уровне: их электронная конфигурация ns1. Очевидно, что валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа. Поэтому для всех щелочных металлов характерны восстановительные свойства. Это подтверждают низкие значения их потенциалов ионизации (потенциал ионизации атома цезия — один из самых низких) и электроотрицательности (ЭО).
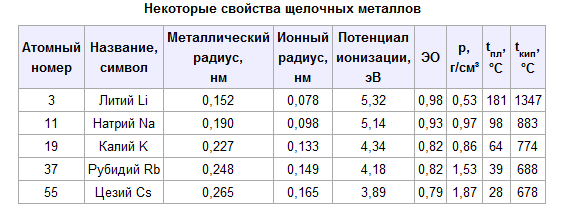
Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их можно резать скальпелем. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
Щелочные металлы встречаются в природе в форме соединений, содержащих однозарядные катионы. Многие минералы содержат в своём составе металлы главной подгруппы I группы. Например, ортоклаз, или полевой шпат, состоит из алюмосиликата калия K2[Al2Si6O16], аналогичный минерал, содержащий натрий — альбит — имеет состав Na2[Al2Si6O16]. В морской воде содержится хлорид натрия NaCl, а в почве — соли калия — сильвин KCl, сильвинит NaCl • KCl, карналлит KCl • MgCl2 • 6H2O, полигалит K2SO4 • MgSO4 • CaSO4 • 2H2O.
Натрий и калий относятся к наиболее распространенным в природе элементам: их содержание в земной коре составляет 2,0 и 1,1 % атомных процентов. Остальные щелочные металлы встречаются реже. Скопления минералов, содержащий литий, редки. Рубидий и цезий встречаются в виде примесей к калию, а следы франция находят в урановых рудах.
Натрий и калий относятся к жизненно важным элементам. Натрий сосредоточен в основном в крови и лимфе (в крови 0,6 % NaCl), калий необходим для работы сердца, печени, селезёнки. Интересно, что соотношения этих элементов в зародышах теплокровных приближается к содержанию в морской воде. Калий необходим для жизни растений (90 % добываемого калия используется для производства химических удобрений).
Рубидий накапливается у животных в мышцах, несущих большую нагрузку (сердце, грудина у животных). Соединения лития и цезия токсичны.
Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, и иногда даже и азоту (Li, Cs) их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.
1. Взаимодействие с водой. Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий:
![]()
При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет.
2. Взаимодействие с кислородом. Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла.
Только литий сгорает на воздухе с образованием оксида стехиометрического состава:
![]()
При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2:
![]()
В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды:
![]()
3. С азотом и углеродом непосредственно соединяется только литий. Образование его нитрида (Li3N) медленно идет в атмосфере азота уже при обычных температурах.
Таким образом, литий и его аналоги являются исключительно реакционноспособными металлами (причем активность их по направлению от Li к Cs обычно возрастает). Во всех своих соединениях щелочные металлы одновалентны.
Получение:
1. Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чаще всего — хлоридов, образующих природные минералы:
![]()
катод: Li+ + e → Li
анод: 2Cl− — 2e → Cl2
2. Иногда для получения щелочных металлов проводят электролиз расплавов их гидроксидов:
![]()
катод: Na+ + e → Na
анод: 4OH− — 4e → 2H2O + O2
3. Щелочной металл может быть восстановлен из соответствующего хлорида или бромида кальцием, магнием, кремнием и др. восстановителями при нагревании под вакуумом до 600-900 °C:
![]()
Чтобы реакция пошла в нужную сторону, образующийся свободный щелочной металл (M) должен удаляться путём отгонки. Аналогично возможно восстановление цирконием из хромата. Известен способ получения натрия восстановлением из карбоната углём при 1000 °C в присутствии известняка.
Поскольку щелочные металлы в электрохимическом ряду напряжений находятся левее водорода, то электролитическое получение их из растворов солей невозможно; в этом случае образуются соответствующие щёлочи и водород.
15. Соединения щелочных элементов с неметаллами – получение, свойства гидридов, галогенидов, сульфидов, нитридов, карбидов, силицидов.
Щелочные металлы реагируют со многими неметаллами. При нагревании они соединяются с водородом с образованием гидридов, с галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием, соответственно, галогенидов, сульфидов, нитридов, фосфидов, карбидов и силицидов:
![]()
![]()
![]()
![]()
![]()
При наличии следов влаги щелочные металлы воспламеняются в атмосфере хлора. Взаимодействие Cs, Rb и К с жидким бромом сопровождается сильным взрывом, тогда как Na и Li при обычных температурах реагируют только поверхностно. С иодом реакции протекают энергично лишь при подогревании. Во всех случаях взаимодействия с галогенами продуктом реакции является соответствующая соль (ЭГ). Образование сульфида (Э2S) при растирании щелочного металла с порошком серы сопровождается взрывом. При нагревании в атмосфере водорода литий и его аналоги образуют гидриды (ЭН), имеющие характер типичных солей, в которых отрицательным ионом является водород (Н–). С азотом и углеродом непосредственно соединяется только литий. Образование его нитрида (Li3N) медленно идет в атмосфере азота уже при обычных температурах. Напротив, карбид лития (Li2C2 ) может быть получен из элементов лишь при нагревании.
По внешнему виду и большинству физических свойств гидриды щелочных металлов похожи на соответствующие галоидные соли (соли галогенов). Так, лучше других изученный LiH образует твердые бесцветные кристаллы (типа NaCl), в отсутствие воздуха плавящиеся без разложения при 680 °С.
Солеобразная природа рассматриваемых гидридов была также непосредственно доказана выделением водорода при электролизе расплавленного LiH на аноде.
Гидриды щелочных металлов являются сильными восстановителями, а при взаимодействии их с водой происходит бурная реакция по схеме:
ЭН + Н2О = Н2 + ЭОН
или в ионах:
Н– + Н+ = Н2
Бинарные солеобрзаные соединения (карбиды, нитриды, силициды, сульфиды) подвергаются необратимому гидролизу.
16. Соединения щелочных элементов с кислородом – оксиды, пероксиды, надпероксиды, озониды – получение, свойства.
Состав продуктов, образующихся при сгорании щелочных металлов на воздухе или в кислороде, зависит от природы металла. Так, литий образует оксид Li2О, натрий — пероксид Na2О2, калий, рубидий и цезий — супероксиды (надпероксиды) КО2, RbО2, CsО2.
Все эти вещества имеют ионную кристаллическую решетку. Пероксиды содержат диамагнитный ион [O2]2-, а супероксиды — парамагнитный [O2]-.
Оксиды М2O образуются при термическом разложении пероксидов или супероксидов в вакууме или инертной атмосфере, при взаимодействии щелочного металла или его азида с нитратом или нитритом:
10К + 2KNO3 = 6К2O + N2
5NaN3 + NaNO3 = 3Na20O + 8N2
Их можно получить также путем дозированного окисления металлов, однако в этом случае конечный продукт будет содержать примеси. Цвет оксида изменяется от белого (Li2O и Na2O) к желтому (К2O, Rb2O) и оранжевому (Cs2O). Удобным способом получения оксида натрия является взаимодействие натрия с расплавленным едким натром:
2NaOH + 2Na = 2Na2O + Н2
Образующийся белый порошок оксида Na2O возгоняется.
Пероксид лития получают по реакции пероксида водорода со спиртовым раствором LiOH. Образующийся гидрат гидропероксида лития разрушают нагреванием в вакууме:
2LiOH + 2Н2O2 + Н2O = 2LiOOH•ЗН20
2LiOOH•ЗН2O = Li2O2 + 4Н2О + ½ O2
При температуре выше 350 °С пероксид лития распадается на оксид и воду.
Чистый пероксид натрия бесцветен, однако даже небольшая примесь NaO2 придает ему желтую окраску.
Известны гидропероксиды состава МООН, образующиеся при взаимодействии пероксида щелочного металла с абсолютным этиловым спиртом на холоду. Получен также гидропероксид аммония NH4OOH, выделяющийся в виде белого осадка при пропускании сухого аммиака через крепкий раствор перекиси водорода.
Для всех щелочных металлов и аммония получены озониды МO3, в состав которых входит парамагнитный ион [03]-. Солеобразные КO3, RbO3, CsO3 получают действием озона на пероксиды, супероксиды или гидроксиды:
ЗКОH(тв.) + 2O3 = 2КO3 + КОН•Н20 + ½ O2
КO2 + O3 = KO3 +O2
Образующийся озонид экстрагируют жидким аммиаком. Все озониды представляют собой оранжево-красные кристаллические вещества. Они чрезвычайно взрывоопасны и неустойчивы (КO3 разлагается при 20 °С за 11 дней).
Пероксиды, надпероксиды и озониды щелочных металлов при нагревании разлагаются:
М2O2(тв.) = М2O(тв.) + 1/2 O2(г.)
Их термическая устойчивость увеличивается с ростом радиуса катиона.
При взаимодействии пероксидов и надпероксидов с углекислым газом происходит выделение кислорода, что используют для регенерации воздуха в замкнутых помещениях:
2КО2 + СO2 = К2СO3 + 3/2 O2
Пероксиды, надпероксиды и озониды являются сильными окислителями:
4Na2O2 + PbS + 4H2SO4 = PbSO4 + 4Na2SO4 + 4H2O
Na2O2 + CO = Na2CO3
В присутствии воды они разлагаются по следующим схемам:
М202 + 2Н20 = 2МОН + Н202
2М02 + 2Н20 = 2МОН + Н202 + 02
4М03 + 2Н20 = 4МОН + 502
