
- •Предмет химической термодинамики. Термодинамические системы, виды термодинамических систем, параметры состояния, параметры процесса;
- •Первый закон термодинамики. Функции состояния системы и их свойства
- •3. Закон Гесса. Следствия из закона Гесса. Тепловые эффекты химических процессов и методы их вычисления. Стандартные энтальпии образования и сгорания веществ.
- •4. Предмет химической кинетики. Скорость химических реакций и факторы ее определяющие. Закон действия масс.
- •5. Влияние температуры на скорость химической реакции:эмпирическое правило Вант-Гоффа, уравнение Аррениуса. Энергия активации.
- •6. Понятия о катализе, катализаторах и ингибиторах. Природа катализа.
- •7. Практическое использование гетерогенного катализа на примере производства аммиака или серной кислоты.
5. Влияние температуры на скорость химической реакции:эмпирическое правило Вант-Гоффа, уравнение Аррениуса. Энергия активации.
Скорость химических реакций сильно зависит от темпера-туры. Согласно эмпирическому правилу Вант-Гоффа (1884) при повышении температуры на 10 градусов скорость большинства реакций возрастает в 2—4 раза. Число, показывающее, во сколько раз возрастает скорость реакции при повышении температуры на 10 градусов, называется температурным коэффициентом (γ) скорости данной реакции.
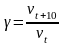

Уравнение Аррениуса связывает константу скорости реакции с ее энергией активации:
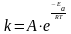
где: k - константа скорости реакции;
A —предэкспоненциальный множитель (множитель Аррениуса), постоянный для данной реакции;
e— основание натурального логарифма;
Ea- энергия активации, Дж/моль;
Т – температура, K;
R – универсальная газовая постоянная, 8,314 Дж/моль K.
Та дополнительная энергия, которую надо придать молеку-лам реагирующих веществ для того, чтобы сделать их активными, называется энергией активации Еа. Она определяется природой реагирующих веществ и служит важной кинети¬ческой харак-теристикой любой химической реакции.
6. Понятия о катализе, катализаторах и ингибиторах. Природа катализа.
Катализом называется изменение скорости химической реакции под действием веществ, химический состав и количество которых в результате реакции остаются неизменными. Эти вещества получили название катализаторов.
Скорость химической реакции в присутствии катализаторов может увеличиваться или уменьшаться. В первом случае говорят о положительном, во втором — об отрицательном катализе. Отрицательный катализ часто называют ингибированием, а вещества, вызвавшие его, — ингибиторами.
Различают гомогенный и гетерогенный катализ. При гомгенном катализе катализатор и реагирующие вещества образуют одну фазу. При гетерогенном катализе катализатор находится в системе в виде самостоятельной фазы, отделенной от других частей системы поверхностью раздела.
7. Практическое использование гетерогенного катализа на примере производства аммиака или серной кислоты.
Катализ широко используется в химической промышленности и в смежных с ней отраслях, так как это способствует резкому повышению производительности технологических процессов. Окисление сернистого ангидрида в серный при получении серной кислоты, конверсия углеводородного сырья до водорода и оксида углерода(II)—исходного компонента для получения аммиака и метанола, окисление аммиака при производстве азотной кислоты, получение жидкого моторного топлива на основе ископаемых углей, гидрогенизация растительных масел и др. — вот далеко не полный перечень примеров промышленного применения каталитических реакций.
8. Биологические катализаторы и их особенности. Явление комплементарности.
Явления катализа имеют место и в природных системах, в частности в биологических. Катализаторы в этом случае обычно называют ферментами, а реакции с их участием — ферментативными. Ярким примером ферментативного процесса может служить фотосинтез.
Ферменты могут быть выделены из живых организмов и в ряде случаев получены в виде индивидуальных химических соединений.
Явление комплементарности: Каталитическое действие ферментов связано с образованием промежуточного соединения одного из исходных веществ с ферментом, которое затем, после взаимодействия со вторым исходным веществом превращается в конечный продукт реакции. На последней стадии этого цикла происходит регенерация фермента.
