
3. Электрохимическая коррозия
При взаимодействии металлов с растворами электролитов коррозия идет преимущественно по электрохимическому механизму. При этом поверхность металла разделяется на участки с меньшим потенциалом, где протекает анодный процесс растворения металла, и участки с большим потенциалом, на которых идет катодный процесс восстановления (эти участки не корродируют). Анодный процесс может быть записан следующим образом:
![]() . (3.1)
. (3.1)
На катодных участках в разбавленных водных растворах протекают обычно следующие восстановительные процессы:
-
в нейтральной или щелочной средах (![]() )
)
![]() ;
(3.2)
;
(3.2)
-
в кислой среде (![]() )
и в деаэрированных растворах
)
и в деаэрированных растворах
![]() .
(3.3)
.
(3.3)
Для определения
возможности электрохимической коррозии
металла в данном электролите необходимо
сравнить равновесный потенциал участков,
на которых протекает процесс (3.1) -
![]() ,
с равновесными потенциалами участков,
на которых идут процессы (3.2) -
,
с равновесными потенциалами участков,
на которых идут процессы (3.2) -
![]() или (3.3) -
или (3.3) -
![]() .
Если потенциал
будет отрицательнее любого из этих
потенциалов, процесс электрохимической
коррозии возможен.
.
Если потенциал
будет отрицательнее любого из этих
потенциалов, процесс электрохимической
коррозии возможен.
Равновесные потенциалы анодного и катодных процессов могут быть найдены по уравнению
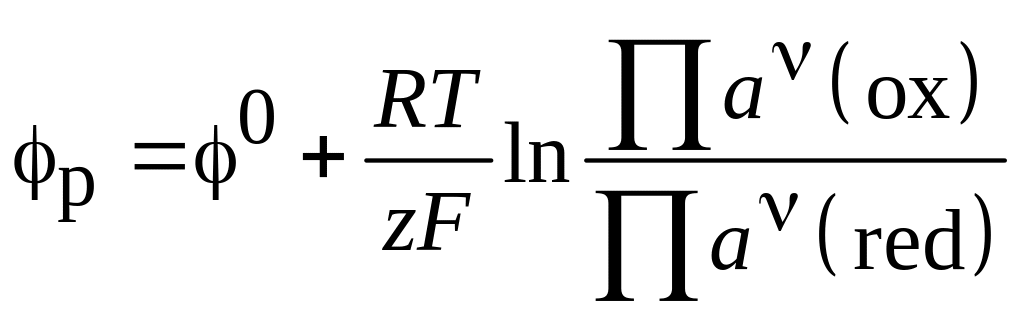 , (3.4)
, (3.4)
где
![]() - стандартный потенциал электродного
процесса;
- стандартный потенциал электродного
процесса;
![]() и
и
![]() - произведения активностей реагентов,
участвующих в электродной реакции, для
окисленного и восстановленного состояний
системы; n
- стехиометрические коэффициенты; z
- число электронов, участвующих в реакции.
- произведения активностей реагентов,
участвующих в электродной реакции, для
окисленного и восстановленного состояний
системы; n
- стехиометрические коэффициенты; z
- число электронов, участвующих в реакции.
Учитывая, что активности газообразных веществ можно принять равными парциальным давлениям, для процессов (3.1)-(3.3) запишем:
 ; (3.5)
; (3.5)
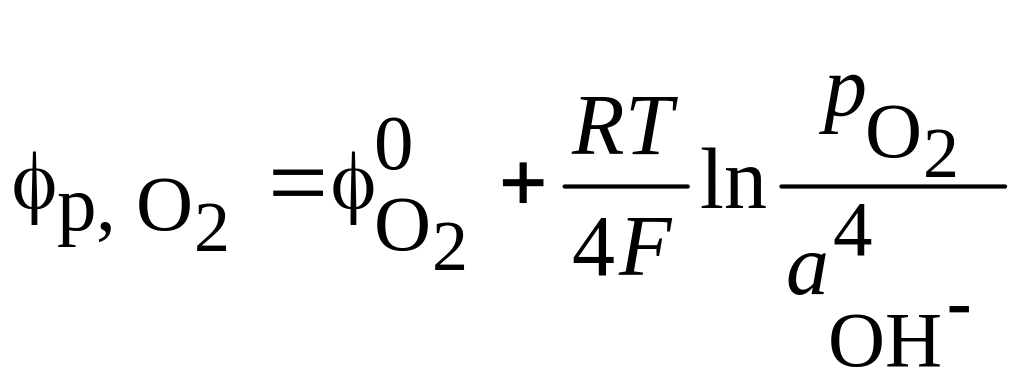 ; (3.6)
; (3.6)
 . (3.7)
. (3.7)
Уравнения (3.6) и
(3.7) могут быть приведены к более удобному
для расчетов виду. Принимая во внимание,
что ионное произведение воды
![]() ,
,
![]() В,
В,
![]() ,
а показатель кислотности электролита
,
а показатель кислотности электролита
![]() ,
и переходя к десятичным логарифмам,
получим:
,
и переходя к десятичным логарифмам,
получим:
![]() ; (3.8)
; (3.8)
![]() . (3.9)
. (3.9)
При температуре
К величина
![]() ,
а
,
а
![]() В.
В.
Рассчитаем,
например, равновесные потенциалы
процессов (3.2) и (3.3), протекающих на
поверхности электрода, погруженного в
водный раствор с
![]() .
Пусть данный раствор находится в
равновесии с атмосферой воздуха при
общем давлении
.
Пусть данный раствор находится в
равновесии с атмосферой воздуха при
общем давлении
![]() атм и
К. В этом случае
атм и
К. В этом случае
![]() атм и
атм и
![]() атм и согласно уравнениям (3.8) и (3.9)
атм и согласно уравнениям (3.8) и (3.9)
![]() В;
В; ![]() В.
В.
При коррозии
металлов в некоторых электролитах
появляются вторичные продукты коррозии
- труднорастворимые соли или гидроксиды
этих металлов (![]() ,
где А - анион). В этом случае необходимо
рассчитывать равновесный потенциал
процесса
,
где А - анион). В этом случае необходимо
рассчитывать равновесный потенциал
процесса
![]() . (3.10)
. (3.10)
Этот же равновесный потенциал можно получить, если в уравнение Нернста для процесса (3.1) (см. уравнение (3.5)) подставить активность ионов металла, соответствующую произведению растворимости соединения (см. [4, c. 214]),
![]() . (3.11)
. (3.11)
Активность анионов
при этом определяется концентрацией
другой (легкорастворимой) соли с тем же
анионом. При образовании гидроксидов
активность анионов
![]() можно определить, зная кислотность
электролита рН
можно определить, зная кислотность
электролита рН
![]() ,
,
отсюда
![]() .
(3.12)
.
(3.12)
Пример.
Определить равновесный потенциал
анодных участков железного электрода
в воде. Продуктом коррозии является
![]() .
.
Решение.
Поскольку в результате коррозии
образуется труднорастворимое соединение
(![]() ),
рассчитываем потенциал процесса:
),
рассчитываем потенциал процесса:
![]() ;
;
![]() В;
В;  .
.
Активности железа и труднорастворимого соединения могут быть приняты равными единице. Активность ионов определяем из уравнения (3.12), принимая и :
![]() ;
;
![]() В.
В.
Произведем расчет равновесного потенциала другим способом.
Запишем уравнение
Нернста для процесса
![]() (
(![]() В)
В)
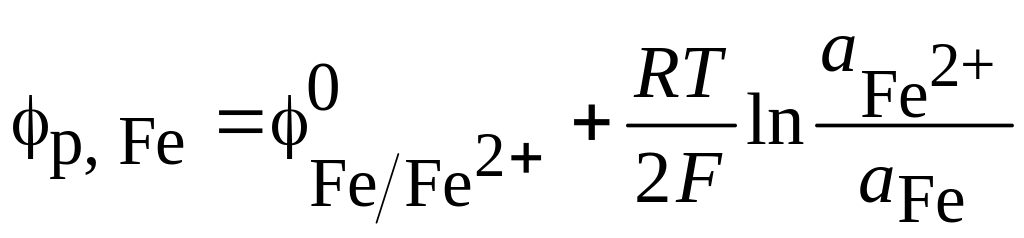 .
.
Активность катионов железа в воде ( ) определяется по уравнениям (3.11) и (3.12):
![]() ;
;
![]() ,
В.
,
В.
В том случае, когда металл имеет разные степени окисления, равновесие между катионами разной валентности устанавливается при одном и том же значении анодного потенциала. Это дает возможность по стандартным электродным потенциалам судить о том, ион какой валентности преобладает при анодном растворении, а также рассчитывать константу равновесия реакции диспропорционирования.
Пример.
Рассчитать константу равновесия реакции
![]() при 25°С.
Ион какой валентности преобладает при
анодном растворении железа?
при 25°С.
Ион какой валентности преобладает при
анодном растворении железа?
Решение. На аноде возможны следующие процессы:
; ![]() В
В
и
![]() ;
; ![]() В.
В.
В условиях равновесия
![]() или в соответствии с уравнением (3.4)
или в соответствии с уравнением (3.4)
![]() .
.
Отсюда
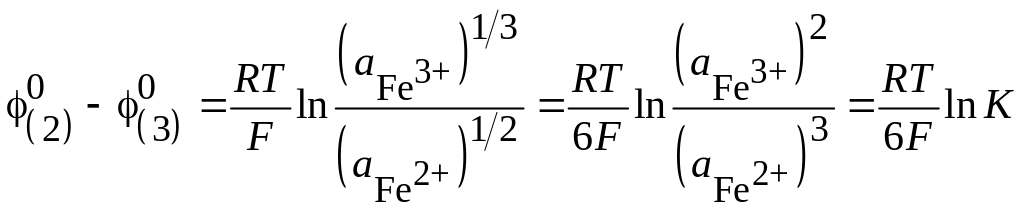 ;
;
![]() ;
; ![]() .
.
Таким образом,
концентрация активных катионов
![]() пренережимо мала по сравнению с
концентрацией катионов
пренережимо мала по сравнению с
концентрацией катионов
![]() .
.
Обычно в справочниках
даны значения электродных потенциалов
относительно водородного электрода
сравнения, стандартный потенциал
которого (![]() )
условно принят равным нулю при всех
температурах. На практике часто пользуются
другими (более удобными с практической
точки зрения) электродами сравнения:
каломельным (К), хлорсеребряным (ХС) или
медно-сульфатным (МС).
)
условно принят равным нулю при всех
температурах. На практике часто пользуются
другими (более удобными с практической
точки зрения) электродами сравнения:
каломельным (К), хлорсеребряным (ХС) или
медно-сульфатным (МС).
Потенциалоопределяющими реакциями на этих электродах являются следующие:
К: ![]() ,
, ![]() В. (3.13)
В. (3.13)
ХС: ![]() ,
, ![]() В. (3.14)
В. (3.14)
МС: ![]() ,
, ![]() В. (3.15)
В. (3.15)
Потенциалы данных
электродов сравнения определяются
активностями соответствующих ионов,
т.е. концентрациями электролитов (для
К и ХС электродов электролитом обычно
служит раствор KCl,
а для МС электрода - раствор
![]() )
и могут быть определены при помощи
уравнения Нернста (3.4).
)
и могут быть определены при помощи
уравнения Нернста (3.4).
Активности ионов в водных растворах определяют по формуле
![]() ,
(3.16)
,
(3.16)
где g - среднеионный коэффициент активности, зависящий от концентрации электролита; m - моляльная концентрация раствора (моль/кг растворителя).
Определим, например,
потенциал 0,1 н (децинормального)
каломельного электрода сравнения.
Концентрация 0,1 н означает, что литр
раствора электролита содержит 0,1 г-экв
соли KCl.
В разбавленном растворе соли одновалентного
металла моляльная концентрация
приблизительно равна нормальной
концентрации, т.к. г-экв в этом случае
тождественен молю, а в литре раствора
содержится приблизительно килограмм
растворителя. Коэффициент активности
аниона
![]() в растворе данной концентрации возьмем
из [1, c.
130]. Для 0,1 m
раствора KCl
-
в растворе данной концентрации возьмем
из [1, c.
130]. Для 0,1 m
раствора KCl
-
![]() .
Тогда
.
Тогда

Аналогично могут
быть определены равновесные потенциалы
других электродов сравнения. При
пересчете на водородную шкалу электродных
потенциалов, измеренных по отношению
к другим, перечисленным выше электродам
сравнения, следует к значениям измеренных
потенциалов
![]() прибавить значение потенциала электрода
сравнения по водородной шкале
прибавить значение потенциала электрода
сравнения по водородной шкале
![]() ,
т. е.
,
т. е.
![]() .
(3.17)
.
(3.17)
Если потенциал электрода не равен равновесному значению, то через данный электрод будет протекать ток определенной полярности и плотности. Связь между перенапряжением h (величиной отклонения потенциала от равновесного значения) и возникающей при этом плотностью электрического тока i определяется общим уравнением электрохимической кинетики
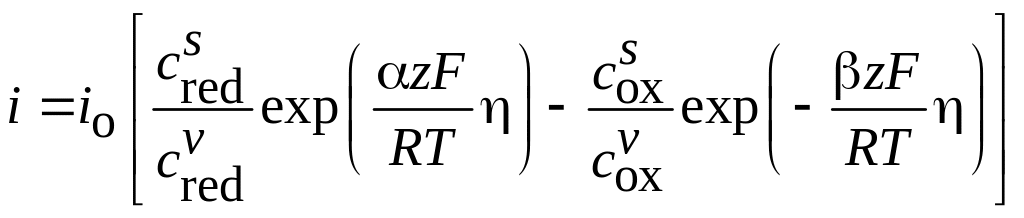 , (3.18)
, (3.18)
где
![]() - плотность тока обмена соответствующего
электродного процесса;
- плотность тока обмена соответствующего
электродного процесса;
![]() и
и
![]() - концентрации восстановленной и
окисленной форм вещества, участвующего
в электродном процессе соответственно
в приповерхностном слое (s)
и в объеме электролита (v);
a
и b
- коэффициенты переноса (
- концентрации восстановленной и
окисленной форм вещества, участвующего
в электродном процессе соответственно
в приповерхностном слое (s)
и в объеме электролита (v);
a
и b
- коэффициенты переноса (![]() ,
часто
,
часто
![]() );
);
![]() - перенапряжение.
- перенапряжение.
При
малых значениях перенапряжения (до 50
мВ), разлагая экспоненты уравнения
(3.18) в ряд
и ограничиваясь двумя его членами (![]() ),
можно получить прямолинейную зависимость
плотности тока от перенапряжения:
),
можно получить прямолинейную зависимость
плотности тока от перенапряжения:
![]() ,
где K
- коэффициент пропорциональности.
,
где K
- коэффициент пропорциональности.
При достаточно больших значениях перенапряжения уравнение (3.18) также может быть упрощено. Например, для диффузионного режима электродного процесса (концентра-ционная поляризация)
![]() ,
(3.19)
,
(3.19)
![]() ,
(3.20)
,
(3.20)
где
![]() ,
,
![]() ,
,
![]() - плотности анодного, катодного и
предельного токов соответственно. В
соответствии с уравнением (3.18) при
диффузионном режиме катодного процесса
и значительном удалении процесса от
равновесия величина катодной плотности
тока перестает зависеть от перенапряжения
- катодный процесс протекает в режиме
предельного тока диффузии. Соответствующая
вольтамперная характеристика электрода
показана на рис. 3.1.
- плотности анодного, катодного и
предельного токов соответственно. В
соответствии с уравнением (3.18) при
диффузионном режиме катодного процесса
и значительном удалении процесса от
равновесия величина катодной плотности
тока перестает зависеть от перенапряжения
- катодный процесс протекает в режиме
предельного тока диффузии. Соответствующая
вольтамперная характеристика электрода
показана на рис. 3.1.

Если электродный процесс контролируется электрохимической реакцией (химическая поляризация), то при больших значениях перенапряжения его зависимость от плотности тока может быть описана уравнением Тафеля
![]() ,
(3.21)
,
(3.21)
где b
- постоянная (для данных процесса,
материала электрода и электролита)
величина, зависящая от температуры.
Значения величин b
и
![]() для некоторых процессов приведены,
например, в [5, c.
54].
для некоторых процессов приведены,
например, в [5, c.
54].
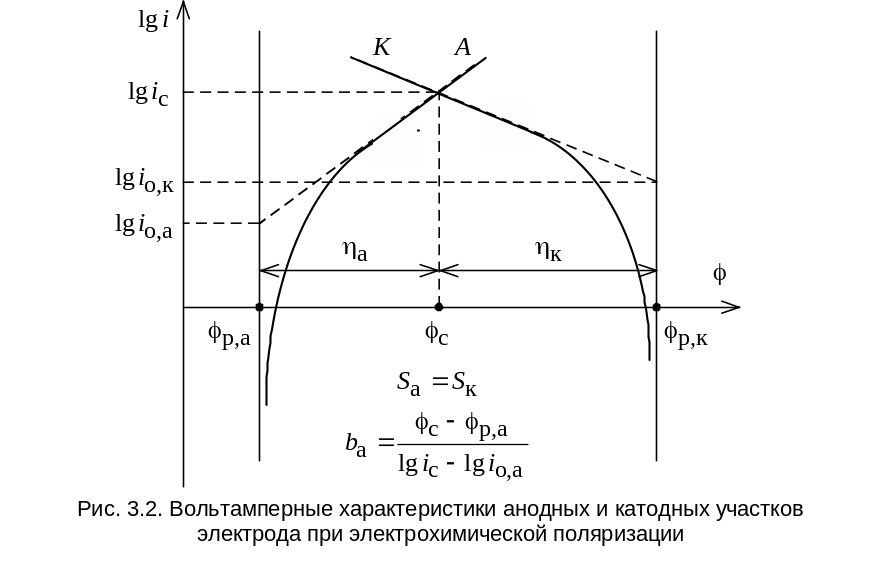
Согласно уравнению
(3.21) на экспериментально найденной
зависимости перенапряжения от плотности
тока, представленной в координатах «![]() »,
при больших значениях h
должен наблюдаться прямолинейный
участок (при условии, что процесс
контролируется электрохимической
стадией). Экстраполяция данного участка
на ось
»,
при больших значениях h
должен наблюдаться прямолинейный
участок (при условии, что процесс
контролируется электрохимической
стадией). Экстраполяция данного участка
на ось
![]() (т.е. при
(т.е. при
![]() )
позволяет определить величину
,
а угловой коэффициент наклона
прямолинейного участка к оси перенапряжений
)
позволяет определить величину
,
а угловой коэффициент наклона
прямолинейного участка к оси перенапряжений
![]() - величину b
(см. рис. 3.2).
- величину b
(см. рис. 3.2).
Анодные и катодные
участки электрода имеют свои вольтамперные
характеристики. Сам электрод (в отсутствии
внешнего тока) будет иметь промежуточный
потенциал между равновесными потенциалами
анодных и катодных участков. Этот
потенциал, называемый стационарным или
компромиссным, устанавливается таким
образом, чтобы величина анодного тока
(![]() )
была равна (по модулю) величине катодного
тока (
)
была равна (по модулю) величине катодного
тока (![]() )
)
![]() ;
;
![]() ,
(3.22)
,
(3.22)
где
![]() и
и
![]() - суммарные площади анодных и катодных
участков соответственно.
- суммарные площади анодных и катодных
участков соответственно.
Плотность анодного тока связана со скоростью коррозии металла на анодных участках:
![]() .
(3.23)
.
(3.23)
Пример.
Определить стационарный потенциал и
скорость коррозии стального электрода
в растворе кислоты (![]() ).
Принять
).
Принять
![]() .
Угловые коэффициенты тафелевских
зависимостей (
)
равны ±0,15
В. Плотности токов обмена (
)
железа и выделения водорода на стальном
электроде равны
.
Угловые коэффициенты тафелевских
зависимостей (
)
равны ±0,15
В. Плотности токов обмена (
)
железа и выделения водорода на стальном
электроде равны
![]() и
и
![]()
![]() соответственно. Активность ионов железа
в растворе равна 0,1.
соответственно. Активность ионов железа
в растворе равна 0,1.
Решение. Величина плотности коррозионного тока и стационарный потенциал электрода могут быть найдены при решении системы уравнений Тафеля:
![]() ;
(3.24)
;
(3.24)
![]() .
(3.25)
.
(3.25)
Индексы «а» и «к»
относятся к анодному процессу
![]() и к катодному процессу (3.3) соответственно.
и к катодному процессу (3.3) соответственно.
Определим равновесные потенциалы анода и катода по уравнениям (3.12) и (3.9):
![]() В;
В;
![]() В.
В.
Вычтем уравнение (3.25) из уравнения (3.24)
![]() .
.
Отсюда
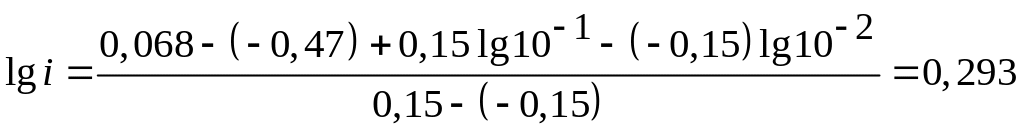 ;
; ![]() .
.
Скорость коррозии на анодных участках в соответствии с уравнением (3.23) равна
![]() .
.
Стационарный потенциал электрода определим из уравнения (3.24)
![]() В.
В.
Снизить скорость коррозии металла можно уменьшив величину тока через анодные участки его поверхности. Для этого можно, например, подключить защищаемую металлическую деталь к отрицательному полюсу внешнего источника тока, а вспомогательный инертный электрод - к положительному полюсу. В этом случае при пропускании через защищаемую деталь катодного тока стационарный потенциал смещается в отрицательном направлении и величина тока через анодные участки, а следовательно, и скорость коррозии уменьшаются. Если стационарный потенциал защищаемого изделия сместить до равновесного потенциала анодных участков, то скорость электрохимической коррозии можно снизить до нуля. В этом случае говорят о полной катодной защите, а соответствующий потенциал называют критическим потенциалом катодной защиты.
В зависимости от условий процесс электрохимической коррозии может протекать с катодным, анодным или омическим контролем. Особый интерес представляет катодный контроль процесса, когда скорость коррозии ограничивается скоростью процесса (3.2) с участием кислорода или скоростью процесса (3.3) с участием водорода. В первом случае говорят, что процесс идет с кислородной деполяризацией, во втором - с водородной деполяризацией.
Процесс (3.3) обычно протекает в кинетическом режиме. При увеличении площади катодных участков увеличивается количество разряжающихся на них в единицу времени ионов водорода. Если катодный процесс лимитировал скорость коррозии, то она также увеличивается. Так, например, скорость коррозии сталей в разбавленных кислотах возрастает при увеличении в этих сталях содержания углерода, т.к. при этом увеличивается площадь катодных участков цементита.
Процесс (3.2) часто
идет в диффузионном режиме. В этом случае
скорость коррозии также возрастает при
введении в металл катодных добавок. Но,
начиная с некоторой концентрации
катодных включений, дальнейшее увеличение
их количества перестает влиять на
скорость процесса (подробнее см. [4, c.
244]). Таким образом, микрокатоды работают
так, как будто
![]() ,
т.е. можно считать, что катодный процесс,
протекающий в режиме предельного тока
диффузии по кислороду, идет на всей
поверхности металлического изделия.
,
т.е. можно считать, что катодный процесс,
протекающий в режиме предельного тока
диффузии по кислороду, идет на всей
поверхности металлического изделия.
Если данной изделие
будет иметь электрический контакт с
деталью, изготовленной из более
благородного металла, то на всей
поверхности детали будет идти катодный
процесс и площадь катодных участков
увеличится в (![]() )
раз, где
)
раз, где
![]() - площадь изделия,
- площадь изделия,
![]() - площадь детали. При условии, что процесс
коррозии продолжает лимитироваться
диффузией кислорода к катодным участкам,
скорость процесса окисления увеличится
в то же число раз, т.е. будет выполняться
соотношение
- площадь детали. При условии, что процесс
коррозии продолжает лимитироваться
диффузией кислорода к катодным участкам,
скорость процесса окисления увеличится
в то же число раз, т.е. будет выполняться
соотношение
![]() ,
(3.26)
,
(3.26)
где П
- глубинный показатель коррозии изделия
в контакте с деталью из более благородного
металла, мм/год;
![]() - то же при отсутствии контакта детали
и изделия.
- то же при отсутствии контакта детали
и изделия.
Таким образом,
следует избегать контакта разнородных
металлов при работе конструкции в
электролите, особенно когда площадь
поверхности более благородного (менее
электроотрицательного металла)
значительно превышает площадь поверхности
менее благородного металла (![]() ).
).
Для защиты металлов от коррозии наряду с катодной защитой, описанной выше, широко применяется нанесение защитных металлических покрытий. Одним из способов нанесения такого покрытия является электролитическое осаждение металла на поверхность защищаемой детали. Количество осаждаемого металла пропорционально количеству затраченного на это электричества, поэтому толщину покрытия (h, см) можно рассчитать, используя закон Фарадея
![]() ,
(3.27)
,
(3.27)
где I - сила тока, А; t - продолжительность электролиза, с; М - молярная масса осаждаемого металла, г/ моль; В - выход по току, %; z - валентность металла; F - постоянная Фарадея, Кл/моль; r - плотность металла, г/см3; S - площадь поверхности покрытия, см2. Уравне- ние (3.27) может быть использовано также для определения толщины слоя, снимаемого с детали при электрохимическом полировании или размерной обработке.
