
- •Работа 1. Изучение механизма электрохимической коррозии металлов на модели микроэлемента
- •1.Теоретическая часть
- •2. Методика проведения работы
- •3. Порядок работы
- •3.1. Экспериментальное построение коррозионной диаграммы "ток - потенциал"
- •3.2. Исследование влияния перемешивания раствора на скорость коррозии
- •3. Исследование влияния добавок кислоты в раствор
- •2. Методика и порядок проведения работы
- •3. Обработка результатов измерений
- •Контрольные вопросы
- •Литература
- •Работа №3. Влияние концентрации серной кислоты на скорость коррозии углеродистои стали
- •1. Теоретическая часть
- •2. Методика и порядок проведения работы
- •Контрольные вопросы
- •Литература
- •Работа №5. Катодная защита металлов от электрохимической коррозии.
- •1. Теоретические основы метода катодной защиты
- •2. Описание установки и порядок проведения.
- •2. Порядок проведения работы
- •Контрольные вопросы:
- •Литература:
- •Работа №7 исследование процесса коррозии металлов в кислотах
- •1. Теоретическая часть
- •2. Методика работы.
- •3. Порядок работы
- •Контрольные вопросы
- •Библиографический список
2. Порядок проведения работы
Стальной образец зачистить наждачной бумагой, обезжирить, просушить и взвесить с точностью до ±0,1мг. Погрузить стальной и два оловянных электрода в раствор электролита в соответствии со схемой на рис.6.1. Водный электролит состава: SnCl2·2H2O - 50 г/л, NaF - 40 г/л, HCl (1,19 г/см3) - 2 г/л, столярный клей - 1 г/л готовит лаборант до начала занятий.
Включить источник питания постоянного тока и с помощью реостата установить по амперметру величину пропускаемого тока 0,5-1 А/дм2. Продолжительность электролиза составляет 20 минут. После нанесения оловянного покрытия электроды вынимают из электролита, промывают водой и сушат. Затем стальной образец взвешивают и измеряют площадь его поверхности, покрытую оловом. Опыт повторяют со вторым образцом с отличающейся в 1,5-2 раза плотностью тока.
Для определения полярности покрытия измеряют вольтметром разность потенциалов между исследуемым стальным образцом и другим стальным электродом без оловянного покрытия. Измерения проводят в двух электролитах разной природы: неорганическом – 3% раствор NaCl и органическом - 3% раствор щавелевой кислоты H2C2O4.
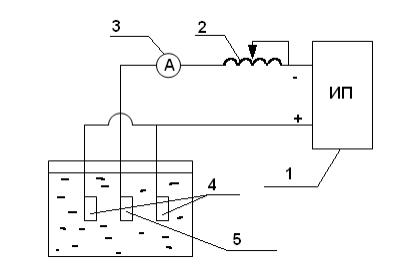
Рис. 6.1. Схема установки для гальванического лужения:
1 - источник питания постоянного тока; 2 - реостат; 3 - амперметр; 4 - оловянные аноды;
5 - исследуемый стальной образец
Определение толщины слоя олова проводят с помощью водного раствора состава: FeCl3·6H2O - 90 г/л, CuSO4 ·5H2O - 146 г/л, уксусная кислота (30 %) - 348 мл/л. Раствор в зависимости от температуры способен за 1 минуту растворить слой олова различной толщины: при 283 К – 2,78 мкм, при 288 – 3,08 мкм, при 293 К – 3,50 мкм, при 298 К – 3,80 мкм. Растворение происходит по реакции
Sn + 2FeCl3 = SnCl2 + 2FeCl2 (6.8)
Медный купорос служит индикатором полного растворения слоя олова, так как при взаимодействии с железом образует розовое пятно металлической меди. На поверхность образца наносят каплю раствора и по секундомеру отсчитывают время. По истечении одной минуты каплю удаляют фильтровальной бумагой. Если розового пятна не появилось, на то же место наносят еще одну каплю. Опыт повторяют несколько раз до появления меди. Толщину слоя олова рассчитывают по времени его растворения.
Средний выход слова по току (В, %) рассчитывают по формуле
![]()
где mФ и mT - фактическая и теоретически рассчитанная по закону Фарадея масса выделившегося при электролизе олова, г; F = 96500 Кл/моль - постоянная Фарадея; I - сила тока, А; τ - время электролиза, с; М = 118,7 г/моль - молярная масса олова.
Расчетную толщину (h, см.) защитного слоя олова определяют по формуле
h=mФ/(Sρ) (6.I0)
где S - площадь поверхности стального образца, покрытая слоем олова, см2; ρ = 7,3 г/см3 - плотность слова. Найденную величину h сравнивают с определенной капельным методом.
Результаты испытаний заносят в табл.6.1, делают выводы о качестве покрытия, его толщине, выходе олова по току, полярности покрытия относительно стального образца.
Таблица 6.1
Результаты испытаний
|
1-й образец |
2-й образец |
|
|
|
|
|
|
|
|
|
|
|
|
сила тока I, A напряжение U, В плотность тока i, мА/см2 температура электролита Т, К продолжительность электролиза τ, с |
|
|
|
|
|
по расчету по капельному методу |
|
|
в неорганическом электролите (раствор NaCl) в органическом электролите (раствор H2C2O4)
|
|
|
