
- •Теории химического строения
- •Основные положения теории бутлерова:
- •2. Положение о зависимости свойств от химического строения.
- •3. Положение о взаимном влиянии атомов.
- •6. Классификация органических реакций по механизму
- •Пространственное строение предельных углеводородов
- •Способы получения предельных углеводородов
- •Лабораторные способы получения алканов
- •Физические свойства предельных углеводородов
- •I. Замещение
- •II. Окисление
- •IV. Изомеризация предельных углеводородов
- •Номенклатура
- •Способы получения
- •Химические свойства олефинов
- •1. Реакции присоединения
- •2. Реакции окисления
- •3. Реакции полимеризации
- •4. Реакции аллильного замещения
- •Физические свойства
- •Особенности электронного строения диенов с сопряженными связями
- •1. Реакции присоединения
- •Классификация
- •Способы получения
- •Физические свойства
- •Химические свойства
- •I.Реакции нуклеофильного замещения
- •Реакции отщепления галогена
- •III. Реакции отщепления галогеноводорода
- •Карбонильные соединения
- •Способы получения
- •Отличие химических свойств альдегидов и кетонов
- •Химические свойства
- •III. Реакции окисления и восстановления
- •Реакции восстановления
- •Карбоновые кислоты
- •Номенклатура
- •Способы получения
- •4) Дегидратация кислот
- •Определение
- •Классификация
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Основные признаки ароматичности
- •Ароматические соединения
- •Гомологический ряд, изомерия и номенклатура ароматических углеводородов
- •Названия ароматических радикалов
- •Способы получения ароматических углеводородов
- •Б. Синтетические способы получения ароматических углеводородов
- •Химические свойства
- •Механизм электрофильного замещения
- •Нитрование гомологов бензола
- •Реакции присоединения (нетипичны)
- •Галоидпроизводные ароматических углеводородов Классификация, изомерия, номенклатура
- •Получение
- •Физические свойства галогенопроизводных ароматических углеводородов
- •Химические свойства
- •Нитросоединения ароматического ряда
- •1.Нитросоединения с нитрогруппой в ядре
- •Физические свойства
- •Химические свойства
- •II. Реакции в ядре
- •II. Нитросоединения с группой no2 в боковой цепи
- •Способы получения
- •Химические свойства ароматических нитросоединений с группой no2 в боковой цепи
- •Ароматические сульфокислоты
- •Физические свойства
- •Химические свойства
- •I тип реакций. Реакции, характерные для органических кислот.
- •II тип реакции. Восстановление сульфогруппы
- •III тип реакций. Реакции нуклеофильного замещения сульфогруппы
- •IV тип реакций. Реакции электрофильного замещения в ядре идут в соответствии с правилами замещения
- •27. Ариламины. Ароматические амины Классификация
- •I. По положению аминогруппы относительно ароматического ядра.
- •II. По количеству радикалов, связанных с азотом
- •III. По количеству аминогрупп
- •Получение
- •Физические свойства
- •Химические свойства
- •II. Реакции замещения водорода в аминогруппе
- •IV. Окисление
- •V. Реакции замещения в ароматическом ядре
- •VI. Реакции конденсации ароматических аминов с другими органическими и неорганическими соединениями
- •Диазо- и азосоединения
- •Ароматические диазосоединения
- •1. Реакция диазотирования - -получение солей диазония.
- •Химические свойства солей диазония
- •I. Реакции с выделением азота
- •II. Реакции диазосоединений без выделения азота
- •Азокрасители
- •Связь строения с цветностью
- •Ароматические оксисоединения
- •Классификация
- •Физические свойства фенолов
- •Химически свойства фенолов
- •I. Реакции подвижного водорода в группе он
- •II. Реакции электрофильного замещения в ядре
- •III. Окислительно-восстановительные реакции
- •IV. Конденсация фенолов с другими органическими соединениями
- •Ароматические альдегиды и кетоны
- •Способы получения
- •II. Частные способы получения альдегидов и кетонов
- •Физические свойства
- •Химические свойства
- •Ароматические кислоты
- •Способы получения
- •Физические свойства
- •Химические свойства
- •Полициклические ароматические углеводороды и их производные
- •Ароматические углеводороды с изолированными ядрами
- •Способы получения
- •Физические свойства
- •Химические свойства
- •Наиболее важные группы многоядерных соединений. Группа дифенила
- •Группа трифеиилметана
- •Полициклические ароматические углеводороды с конденсированными ядрами
- •Получение
- •Физические свойства
- •Особенности химических свойств
- •Ароматические моноциклические пятичленные гетероциклы
- •Номенклатура гетероциклических соединений
- •Способы получения
- •Физические свойства
- •34. Шестичленные гетероциклы с одним гетероатомом
- •Получение
Химические свойства олефинов
Химические свойства олефинов обусловлены природой двойных связей. π-связь мало прочная, выокополяризуемая, поэтому она легко разрывается и этиленовые могут вступать в реакции присоединения.
1. Реакции присоединения
1)+Н2 (kat ni, pt,rd) 2) +cl2 3)+HCl присоединение галогенводорода идет по правилу марковникова – водород присоединяется к наиболее гидрированному атому. Правило нарушается в присут перекисей (эффект Караша) 4) +H2O (kat H3PO4)
2. Реакции окисления
Благодаря легкости разрыва -связи олефины хорошо окисляются. Различаются следующие виды реакций окисления:
1. С разрывом только -связи.
а) окисление по Вагнеру – действие разбавленного водного раствора KMnO4 при комнатной температуре – приводит к образованию гликолей
СH2=CH2 + O CH2-CH2 + HOH CH2-CH2
O OH OH
окись этилена этиленгликоль
2. Окисление с разрывом углеродной цепи происходит при действии сильных окислителей и при нагревании, например:
KMnO4 + H2SO4; продуктами реакций могут быть кетоны и карбоновые кислоты
O O
CH3-C=CH-CH3
+ 3O
 CH3-C
+ CH3-C
CH3-C
+ CH3-C
CH3 CH3 OH
2-метил-2-бутен
3. Озонирование – окисление озоном О3.
При действии озона сначала происходит его присоединение по двойной связи с образованием озонидов.
O-O-O O – O CH3
СH2=C-CH3 + O3 CH2-C-CH3 +H2O CH2 (формальдегид) + C
CH3 CH3 O CH3
3. Реакции полимеризации
Это соединение нескольких или многих молекул в одну без изменения состава, происходящее за счет разрыва двойных связей. Существует два вида полимеризации олефинов:
1. Ступенчатая полимеризация – происходит в присутствии катализаторов (H2SO4, AlCl3), приводит к образованию димеров, тримеров, тетрамеров и т.д., причем на каждой стадии полученный продукт выделяется как устойчивое соединение. Реакция идет по механизму электрофильного присоединения
2. Цепная полимеризация протекает под действием инициаторов или катализаторов по цепному механизму. Низкомолекулярные продукты полимеризации не могут быть выделены, т.к. не являются устойчивыми веществами. Реакция приводит к образованию высокомолекулярных соединений.
4. Реакции аллильного замещения
При высоких температурах в газовой фазе при условиях, способствующих свободно-радикальным реакциям) у олефинов происходят реакции замещения атомов водорода в -звене по отношению к ненасыщенному атому углерода с сохранением двойной связи.
1. Реакция Шешукова – высокотемпературное хлорирование.
CH2=CH-CH3
+ Cl2
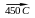 CH2=CH-CH2Cl
CH2=CH-CH2Cl
2. Окисление кислородом при высоких температурах.
H
CH2=CH-CH3 + O2 CH2=CH-CH2 H2O + CH2=CH-C
O-OH O
(альдегид акриловой кислоты)
Алкины. Строение. Получение. Свойства. Реакции присоединения и подвижного водорода.
Это углеводороды открытого строения с одной тройной связью, общая формула ряда – СnH2n-2 (такая же, как у диеновых углеводородов), т.е. они изомерны диеновым углеводородам.
Гомологический ряд |
Изомерия |
Номенклатура |
|
Рациональная |
Систематическая |
||
С2Н2 |
СН СН |
ацетилен |
этин |
С3Н4 |
СН3-С СН |
метилацетилен |
пропин |
СН3-СН2-С СН |
этилацетилен |
1-бутин |
|
С4Н6 |
СН3-С С-СН3 |
диметилацетилен |
2-бутин |
Получение.
Промышленное получение ацетилена.
1) Из карбида кальция (исходное сырье – кокс, известняк).
CaCO3 CaO + CO2
CaO
+ 3C
 CaC2
+ CO
CaC2
+ CO
C H CH
Ca + O CaO + + Q
C H CH
2) Пиролиз углеводородов.
CH4
+ CH4
 CH
CH
+ 3H2
CH
CH
+ 3H2
Лабораторные методы получения
1. Алкилирование ацетилена, т.е. замена водорода на алкил.
CH CH + Na ½ H2 + CH C-Na
(NH3 жидкий)
СH C-Na + ClCH3 NaCl + CH C-CH3
2. Дегидрогалогенирование геминальных и вицинальных дигалогенопроизводных.
H Cl
H-C-C-H
 CH
CH
CH
CH
H Cl -2HCl –Н2О
Хлористый этилиден (геминальное дигалогенопроизводное)
H Cl
H-C-C-CH3 CH C-CH3
Cl H -2HCl
Хлористый пропилен (вицинальное строение)
3. Электронное строение ацетиленовых углеводородов. В молекуле ацетилена каждый атом углерода соединяется только с двумя другими атомами: Н-С С-Н. Поэтому в гибридизации участвуют 2 электрона, один – s и один р – электрон, образуя в результате две гибридные орбитали. Происходит sp‑гибридизация. Наиболее устойчивое состояние молекулы достигается при наиболее симметричном расположении этих двух sp-орбиталей, т.е. под углом 180о друг к другу, образуя -связи С-С и С-Н.
В двух взаимно перпендикулярных плоскостях к оси -связей располагаются электронные орбитали 2-х негибридизированных р-электронов, за счет бокового перекрывания которых образуются 2 -связи.4 атома расположены на прямой, т.е. молекула ацетилена имеет линейное строение. Наблюдается значительное укорочение С С связи, длина которой составляет 1,20 А0.
Благодаря
наличию двух пар подвижных
 -электронов
тройная связь легко поляризуется за
счет влияния заместителей.
-электронов
тройная связь легко поляризуется за
счет влияния заместителей.
4. Физические свойства.
1) Ацетиленовые углеводороды имеют несколько более высокие Ткип. и d204, чем олефины(этиленовые).
2) Агрегатное состояние: С2-С3 - газы
С4-С16 – жидкости
С17 и более – твердые вещества
3) Заметно растворимы в воде (1 объем С2Н2 на 1 объем воды)
4) Смесь ацетилена с воздухом взрывоопасна в широких пределах
5. Химические свойства
Благодаря малой прочности -связей ацетиленовые углеводороды легко вступают в реакции присоединения, окисления, полимеризации, идущие с разрывом -связей. Механизм этих реакций чаще всего ионный: электрофильный или нуклеофильный, благодаря легкой поляризуемости тройной связи. Ацетилены, имеющие незамещенный Н у ненасыщенного атома углерода, способны замещать его на и некоторые другие металлы, т.е. проявляют кислотные свойства.
I. Реакции присоединения:
1) Гидрирование.
СН
СН
+ Н2
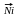 СН2=СН2
СН2=СН2
 СН3-СН3
СН3-СН3
2) Реакции электрофильного присоединения галогенов и галогеноводородов происходят также ступенчато.
Br Br
СН
СН
+ Br2
CН=СН
 CН-СН
CН-СН
Br Br Br Br
дибромэтилен тетрабромэтилен
СН
СН
+ НСl
CН2=СН-Сl
 CН3СНCl2
CН3СНCl2
хлорвинил хлористый этилиден(2,2-дихлорпропан)
Присоединение ННаl протекает в соответствии с правилом Марковникова. Реакции нуклеофильного присоединения. Реакция электрофильная.
3) реакции нуклеофильного присоединения.
а) присоединение спиртов:
СН3ОН + КОН СН3ОК + Н2О
Спирт в присутствии твердого КОН образует алкоголят, который диссоциирует с образованием аниона СН3ОК СН3О- + К+
СН3О- - нуклеофильный реагент, вызывает протекание реакции по нуклеофильному механизму
СН
СН
+ СН3О-
СН=СН-ОСН3
 СН2-СН-О-СН3
+ ОН- ( метил виниловый эфир)
СН2-СН-О-СН3
+ ОН- ( метил виниловый эфир)
б) присоединение HCN
CН
СН
+ Н-С
N
 СН2=СН-С
N
СН2=СН-С
N
акрилонитрил
в) присоединение уксусной кислоты
О
СН
СН
+ СН3-С -ОН
 СН2=СН-О-С-СН3
СН2=СН-О-С-СН3
О
винилацетат
4) Гидратация ацетиленовых углеводородов (реакция Кучерова)
Н
СН
СН
+ НОН
 СН2=СН
СН3-С=О
СН2=СН
СН3-С=О
ОН уксусный альдегид
II. Реакции окисления
Хорошо окисляются сильными окислителями за счет разрыва тройной связи с образованием двух молекул карбоновых кислот.
СН3-С С-СН2-СН3 + 3О + Н2О СН3-С=О + СН3-СН2-С=О
ОН ОН
Метилэтилацетилен (КМnО4) уксусная пропионовая
кислота кислота
Если тройная связь у конца цепи, то образуется одна молекула карбоновой кислоты и СО2.
СН3-СН2-С СН + 4О СН3-СН2-СООН + СО2
пропионовая кислота
III. Реакции полимеризации и конденсации
Образование ароматических углеводородов.
 высокая температура
пропуск через
раскаленные трубки
высокая температура
пропуск через
раскаленные трубки
Циклическая полимеризация 4-х молекул происходит в присутствии карбонила никеля:


Линейная ступенчатая полимеризация.
СН
СН+СН
СН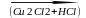 СН2=СН-С
СН
СН2=СН-С
СН СН2=СН-С
С-СН=СН2
СН2=СН-С
С-СН=СН2
винилацетилен дивинилацетилен
Конденсация с альдегидами или кетонами
а) реакция Фаворского
СН3 СН3
СН
СН
+ С-СН3
 СН
С-С-СН3
СН
С-С-СН3
О ОН диметилацетиленилкарбинол
б) реакция Реппе
СН
СН+СН2 СН=СН-СН2
СН2-СН=С-СН2
СН=СН-СН2
СН2-СН=С-СН2
О ОН ОН ОН
пропинол бутиндиол
Реакции замещения водорода металлом – образование ацетиленидов
1. Образование ацетиленидов щелочных и щелочно-земельных металлов.
а) взаимодействие с металлическим натрием;
б) взаимодействие с Мg-органическими соединениями:
СН3-С СН+С2Н5МgBr C2Н6 + СН3-СН=СН-MgBr
1-пропенилмагнийбромид
2. Взаимодействие с гидроокисями или солями тяжелых металлов:
СН СН + 2[Ag(NH3)2]ОН Ag-C C-Ag + 4NH3 + 2H2O
грязно-белый осадок
алкадиены. Классификация. Физические свойства. Эффект сопряжения.
Диеновыми углеводородами называются углеводороды открытого строения с двумя двойными связями. Общая формула СnH2n+2. В зависимости от расположения двойных связей они подразделяются на 3 вида:
1. Углеводороды с кумулированными связями (две двойные связи рядом).
CH2=C=CH2 |
аллен |
1, 2-пропадиен |
CH3-CH=C=CH2 |
метилаллен |
1, 2-бутадиен |
Эти соединения мало устойчивы и не имеют большого распространения.
2. Углеводороды с изолированными связями (две двойные связи, разделенные более чем одной простой), например:
CH2=CH-CH2-CH=CH2 |
1, 4-пентадиен |
3. Углеводороды с сопряженными связями (две двойные связи, расположенные через одну простую):
CH2=CH-CH=CH2 |
дивинил |
1,3-пентадиен |
CH2=C-CH=CH2 CH3 |
изопрен |
2-метил-1,3-бутадиен |
Наибольшее значение имеет 3-я группа. Их мы и будем рассматривать.
