
- •Теории химического строения
- •Основные положения теории бутлерова:
- •2. Положение о зависимости свойств от химического строения.
- •3. Положение о взаимном влиянии атомов.
- •6. Классификация органических реакций по механизму
- •Пространственное строение предельных углеводородов
- •Способы получения предельных углеводородов
- •Лабораторные способы получения алканов
- •Физические свойства предельных углеводородов
- •I. Замещение
- •II. Окисление
- •IV. Изомеризация предельных углеводородов
- •Номенклатура
- •Способы получения
- •Химические свойства олефинов
- •1. Реакции присоединения
- •2. Реакции окисления
- •3. Реакции полимеризации
- •4. Реакции аллильного замещения
- •Физические свойства
- •Особенности электронного строения диенов с сопряженными связями
- •1. Реакции присоединения
- •Классификация
- •Способы получения
- •Физические свойства
- •Химические свойства
- •I.Реакции нуклеофильного замещения
- •Реакции отщепления галогена
- •III. Реакции отщепления галогеноводорода
- •Карбонильные соединения
- •Способы получения
- •Отличие химических свойств альдегидов и кетонов
- •Химические свойства
- •III. Реакции окисления и восстановления
- •Реакции восстановления
- •Карбоновые кислоты
- •Номенклатура
- •Способы получения
- •4) Дегидратация кислот
- •Определение
- •Классификация
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Основные признаки ароматичности
- •Ароматические соединения
- •Гомологический ряд, изомерия и номенклатура ароматических углеводородов
- •Названия ароматических радикалов
- •Способы получения ароматических углеводородов
- •Б. Синтетические способы получения ароматических углеводородов
- •Химические свойства
- •Механизм электрофильного замещения
- •Нитрование гомологов бензола
- •Реакции присоединения (нетипичны)
- •Галоидпроизводные ароматических углеводородов Классификация, изомерия, номенклатура
- •Получение
- •Физические свойства галогенопроизводных ароматических углеводородов
- •Химические свойства
- •Нитросоединения ароматического ряда
- •1.Нитросоединения с нитрогруппой в ядре
- •Физические свойства
- •Химические свойства
- •II. Реакции в ядре
- •II. Нитросоединения с группой no2 в боковой цепи
- •Способы получения
- •Химические свойства ароматических нитросоединений с группой no2 в боковой цепи
- •Ароматические сульфокислоты
- •Физические свойства
- •Химические свойства
- •I тип реакций. Реакции, характерные для органических кислот.
- •II тип реакции. Восстановление сульфогруппы
- •III тип реакций. Реакции нуклеофильного замещения сульфогруппы
- •IV тип реакций. Реакции электрофильного замещения в ядре идут в соответствии с правилами замещения
- •27. Ариламины. Ароматические амины Классификация
- •I. По положению аминогруппы относительно ароматического ядра.
- •II. По количеству радикалов, связанных с азотом
- •III. По количеству аминогрупп
- •Получение
- •Физические свойства
- •Химические свойства
- •II. Реакции замещения водорода в аминогруппе
- •IV. Окисление
- •V. Реакции замещения в ароматическом ядре
- •VI. Реакции конденсации ароматических аминов с другими органическими и неорганическими соединениями
- •Диазо- и азосоединения
- •Ароматические диазосоединения
- •1. Реакция диазотирования - -получение солей диазония.
- •Химические свойства солей диазония
- •I. Реакции с выделением азота
- •II. Реакции диазосоединений без выделения азота
- •Азокрасители
- •Связь строения с цветностью
- •Ароматические оксисоединения
- •Классификация
- •Физические свойства фенолов
- •Химически свойства фенолов
- •I. Реакции подвижного водорода в группе он
- •II. Реакции электрофильного замещения в ядре
- •III. Окислительно-восстановительные реакции
- •IV. Конденсация фенолов с другими органическими соединениями
- •Ароматические альдегиды и кетоны
- •Способы получения
- •II. Частные способы получения альдегидов и кетонов
- •Физические свойства
- •Химические свойства
- •Ароматические кислоты
- •Способы получения
- •Физические свойства
- •Химические свойства
- •Полициклические ароматические углеводороды и их производные
- •Ароматические углеводороды с изолированными ядрами
- •Способы получения
- •Физические свойства
- •Химические свойства
- •Наиболее важные группы многоядерных соединений. Группа дифенила
- •Группа трифеиилметана
- •Полициклические ароматические углеводороды с конденсированными ядрами
- •Получение
- •Физические свойства
- •Особенности химических свойств
- •Ароматические моноциклические пятичленные гетероциклы
- •Номенклатура гетероциклических соединений
- •Способы получения
- •Физические свойства
- •34. Шестичленные гетероциклы с одним гетероатомом
- •Получение
III. Реакции окисления и восстановления
1) Окисление альдегидов
а) реакция серебряного зеркала:
O
СH3-CОН +2[Ag(NH3)2]OH 3NH3 + H2O + 2Ag + CH3-C
ONH4
2) Окисление кетонов протекает значительно труднее. Кетоны не окисляются слабыми окислителями Сильными окислителями они окисляются с разрывом цепи. Окисление кетонов происходит в соответствии с правилами Попова:
Действие окислителя направлено в основном на соседний с карбонилом атом углерода, что приводит к разрыву цепи и образованию двух молекул кислот.
У несимметричных кетонов главным направлением реакции является окисление менее гидрированного соседнего звена.
Реакции восстановления
1) Восстановление до углеродов по Клеменсону.
CH3-C-CH3 + 2Zn + 4HCl(HgCl2) CH3-CH2-CH3 + H2O + 2ZnCl2
O
Роль HgCl2 – образование амальгамы цинка.
Карбоновые кислоты. Номенклатура. Получение.
Карбоновые кислоты
Карбоновые кислоты можно рассматривать как продукты окисления углеводородов третьей степени (когда на один атом углерода приходится три атома кислорода).
H OH O
CH3-C-H + 3O CH3-C-OH H2O + CH3-C
H OH OH
O
Функциональная группа карбоновых кислот –С называется
OH
карбоксильной группой (карбонил + гидроксил).
Номенклатура
Рациональная номенклатура
Соединения рассматриваются как продукты замещения атомов водорода в уксусной кислоте радиалами.
CH3 O
CH3-C - C триметилуксусная кислота
CH3 OH
Систематическая (IUPAC)
За основу принимается самая длинная цепь, включающая группу СООН. Нумерация производится от группы СООН. К названию углеводорода, соответствующего самой длинной цепи, добавляется окончание “-овая” кислота.
5 4 3 2 1 O
СH3-CH-CH2-CH2-C 4-метилпентановая кислота
CH3 OH
Карбоксильная группа обозначается приставкой “карбоксиалкил”.
8 7 6 5 4 3 2 1
HOOC-CH2-CH2-CH2-CH-CH2-CH2-COOH 4-карбоксиметилоктандионовая
CH2-COOH кислота
Способы получения
1. Окисление углеводородов
а) Окисление предельных углеводородов С20-С40 (см. свойства парафинов);СН3-СН3 +[O]=СН3СООН
б) Окисление олефинов
R1-CH=CH-R2 + 4O R1-C=O + R2-C=O
OH OH
2. Окисление первичных спиртов и альдегидов (см. свойства спиртов и альдегидов)
3. Магний-органический синтез
O
СH3I + Mg CH3-MgJ +CО2 CH3-C Mg(OH)I + CH3-COOH
OMg J
H3PO4 OH
4. Гидролиз гемитригалогенопроизводных
СH3-C-Cl3
+ HOH
 CH3-C-Cl2
(OH)
CH3-C
OCl
(хлорангидрид уксусной кислоты)
CH3-COOH
CH3-C-Cl2
(OH)
CH3-C
OCl
(хлорангидрид уксусной кислоты)
CH3-COOH
химические свойства карбоновых кислот
1) Кислотные свойства
а) Диссоциация в водном растворе
CН3-СООН CН3 – С=О + H+
O-
По степени диссоциации – это слабые кислоты. Наиболее сильная – муравьиная кислота. У других кислот углеводородный радикал, обладающий электродонорными свойствами, отталкивает электроны к водороду (положительный индукционный эффект), и кислотность снижается.
Степень диссоциации увеличивается при введении в радикал электроноакцепторных групп, например, групп С=О, ОН, Cl. Чем ближе эти группы расположены к СООН, тем сильнее кислота. Например, у хлоруксусной кислоты
Cl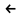 CH2
C
OH
Кд=1,5.10-3
CH2
C
OH
Кд=1,5.10-3
О
у трихлоруксусной
Cl
Cl C C-O-H Кд=2,1.10-1
Cl
т.е. трихлоруксусная кислота аналогична сильным минеральным кислотам.
2) Образование солей происходит при взаимодействии с металлами, окисями, гидроокисями металлов, с некоторыми другими солями и аммиаком
а) 2HCOOH + Mg H2 + (HCOO)2Mg
формиат магния
б) 2СH3COOH + CaO (CH3COO)2Ca + H2O
ацетат кальция
в) С2H5COOH + NaOH H2O + C2H5COONa
пропионат натрия
г) CH3COOH + NaHCO3 CH3COONa + CO2 + H2O
д) CH3COONa + AgNO3 CH3COOAg + NaNO3
е) CH3COOH + NH3 [CH3COO-]N+H4
3) Образование производных карбоновых кислот путем замещения гидроксила (реакции ацилирования)
а) Образование хлорангидридов кислот
O O
CH3-C + PCl5 CH3-C + POCl3 + HCl
OH Cl
б) Образование амидов карбоновых кислот
O O
CH3-C + NH3 CH3-C + H2O амид укс-ой кислоты
OH NH2
в) Образование сложных эфиров со спиртами (см. свойства спиртов)
