- •2. Основные термодинамические параметры состояния.
- •3.Теплота и работа
- •4.Уравнение состояния идеальных газов.
- •5.Первый закон термодинамики.
- •Аналитическое выражение первого закона термодинамики.
- •Энтальпия.
- •Теплоемкость газов. Энтропия.
- •6. Второй закон термодинамики.
- •7. Термодинамические процессы идеальных газов (изобарный, изотермический, изохорный)
- •8. Термодинамические процессы идеальных газов (политропные, адиабатные)
- •9. Термодинамический кпд и холодильный коэффициент циклов.
- •10. Прямой обратимый цикл Карно.
- •11. Обратный обратимый цикл Карно.
- •12. Циклы паротурбинных установок. Циклы Ренкина на насыщенном и перегретом паре.
- •13. Классификация холодильных установок, хладагенты и требования к ним.
- •14. Основные виды переноса теплоты
- •15. Конвективный теплообмен. Виды движения теплоносителей.
- •16. Классификация теплообменных аппаратов. Теплоносители.
- •17. Расчет рекуперативных Теплообменных аппаратов.
- •18. Типы тепловых электростанций. Классификация.
- •19. Технологический процесс преобразования химической энергии топлива в электроэнергию на тэс.
- •20. Классификация атомных реакторов
- •21. Устройство о ядерных реакторов различного типа
- •22. Ресурсы, потребляемые аэс, ее продукция, отходы производства
- •23. Технологические схемы производства электроэнергии на аэс.
- •24. Паровые турбины. Устройство паровой турбины
- •25. Проточная часть и принцип действия турбины
- •26.Типы паровых турбин и область их использования
- •27. Основные технические требования к паровым турбинам и их характеристики
- •29. Гту с изохорным подводом теплоты. Термодинамический кпд и работа цикла с изохорным подводом теплоты. Достоинства и недостатки гту.
- •30. Пгу. Их классификация. Достоинства и недостатки.
- •31. Котельные установки. Общие понятия и определения
- •32. Классификация котельных установок.
- •33. Каркас и обмуровка котла.
- •34. Тепловой и эксергетический балансы котла. Составляющие приходной части теплового баланса.
- •35. Общее уравнение теплового баланса ку. Составляющие расходной части теплового баланса.
- •36. Схемы подачи воздуха и удаления продуктов сгорания
- •37. Естественная и искусственная тяга. Принцип работы дымовой трубы.
- •38. Паросепарирующие устройства котлов
- •39. Пароперегреватели. Назначение, устройство, виды.
- •40. Водяные экономайзеры ку. Назначение, конструкция, виды
- •41. Воздухоподогреватели ку. Назначение, конструкция, виды
- •42. Топливо, состав и технические характеристики топлива Понятие условного топлива, высшей и низшей теплоты сгорания
- •43. Классификация систем теплоснабжения и тепловых нагрузок
- •44. Тепловые сети городов
- •45. Теплоэлектроцентрали. Преимущества раздельной и комбинированной выработки электроэнергии и тепла
- •47. Классификация нагнетателей. Области применения
- •48. Производительность, напор и давление, создаваемые нагнетателем
- •49. Мощность и кпд нагнетателей. Совместная работа насоса и сети.
- •50. Классификация двигателей внутреннего сгорания.
- •52. Основные теплоносители теплообменных аппаратов
- •54. Устройство двс. История развития и параметры работы двс Отличия реальной и идеальной индикаторных диаграмм двс.
- •55. Нетрадиционные и возобновляемые источники энергии
- •56. Прямое преобразование солнечной энергии. Солнечные водоподогреватели.
- •57. Подогреватели воздуха. Солнечные коллекторы.
- •58. Преобразование солнечной радиации в электрический ток
- •59. Гидроэнергетика. Основные принципы использования энергии воды. Устройство русловой гэс
- •60. Приливные электростанции
- •61.Ветрогенераторы. Возможность применения. Устройство и категории ветрогенераторов.
- •62. Типы ветрогенераторов. Установки с горизонтальной осью вращения. Преимущества и недостатки.
- •63. Типы ветрогенераторов. Установки с вертикальной осью вращения. Преимущества и недостатки.
- •64. Водородная энергетика
- •Принцип работы топливного элемента:
Теплоемкость газов. Энтропия.
Отношение
элементарного количества теплоты
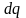 ,
полученное телом при бесконечно малом
изменении его состояния, к изменению
температуры
,
полученное телом при бесконечно малом
изменении его состояния, к изменению
температуры
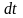 называется удельной теплоемкостью тела
в данном процессе:
называется удельной теплоемкостью тела
в данном процессе:
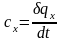 (1.13.1)
(1.13.1)
Величина
в уравнении зависит не только от интервала
температур, но и от вита процесса подвода
теплоты, характеризуемого некоторым
постоянным параметром
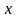 ,
которым может быть объем тела
,
которым может быть объем тела
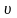 ,
давление
и др. общее количество теплоты, полученное
в данном процессе, определяется выражением
,
давление
и др. общее количество теплоты, полученное
в данном процессе, определяется выражением
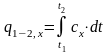 (1.13.2)
(1.13.2)
На примере идеального газа. Имеем
 ,
или заменив
на
,
или заменив
на
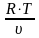 ,
получим
,
получим
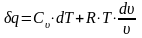
Разделив обе части последнего уравнения на , находим
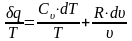 (1.13.3)
(1.13.3)
Выражение
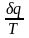 при обратимом изменении состояния газа
есть полный дифференциал некоторой
функции переменных
и
(
при обратимом изменении состояния газа
есть полный дифференциал некоторой
функции переменных
и
(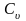 зависит только от температуры, а
зависит только от температуры, а
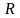 -
величина постоянная). Клаузиус назвал
эту функцию энтропия и обозначил
в джоулях на градус (Дж/К).
-
величина постоянная). Клаузиус назвал
эту функцию энтропия и обозначил
в джоулях на градус (Дж/К).
Таким образом, дифференциал энтропии для обратимого изменения состояния определяется как
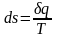 (1.13.4)
(1.13.4)
Удельная энтропия является параметром состояния, и изменение ее в любом термодинамическом процессе полностью определяется крайними состояниями тела и не зависит от пути процесса.
Интегрируя определяем
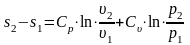 (1.13.5)
(1.13.5)
6. Второй закон термодинамики.
Закон, позволяющий указать направление теплового потока и устанавливающий максимально возможный предел превращения теплоты в работу в тепловых машинах, представляет собой новый закон, полученный из опыта. Это и есть второй закон термодинамики, имеющий общее значение для всех тепловых процессов.
В 50-х годах прошлого столетия Клаузиусом была дана наиболее общая и современная формулировка второго закона термодинамики в виде следующего постулата: «Теплота не может переходить от холодного тела к более нагретому сама собой даровым процессом (без компенсации)». Постулат Клаузиуса, как и все другие формулировки второго закона, выражает собой один из основных, но не абсолютных законов природы, так как он был сформулирован применительно к объектам, имеющим конечные размеры в окружающих нас земных условиях.
В 1851 г. Томсоном была высказана другая формулировка второго закона термодинамики, из которой следует, что не вся теплота, полученная, от теплоотдатчика, может перейти в работу, а только некоторая ее часть. Часть теплоты должна перейти в теплоприемник.
7. Термодинамические процессы идеальных газов (изобарный, изотермический, изохорный)
К основным процессам, имеющим большое значение, как для теоретических исследований, так и для практических работ в технике, относятся: изохорный, протекающий при постоянном объеме; изобарный, протекающий при постоянном давлении; изотермический,, протекающий при постоянной температуре; адиабатный, протекающий при отсутствии теплообмена с внешней средой.
Кроме того, существует группа процессов, являющихся при определенных условиях обобщающими для основных процессов. Эти процессы называются политропными и характеризуются постоянством теплоемкости в процесса.
Для всех процессов устанавливается общий метод исследований, который заключается в следующем;
выводится
уравнение кривой процесса на
- и
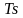 -диаграммах;
-диаграммах;
устанавливается зависимость между основными параметрами рабочего тела в начале и конце процесса;
определяется изменение внутренней энергии по формуле, справедливой для всех процессов идеального газа:
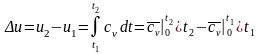 ,
,
или при постоянной теплоемкости:
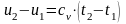 ;
;
вычисляется работа изменения объема газа по основной формуле:
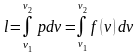 ;
;
определяется удельное количество теплоты, участвующее в процессе, по формуле:
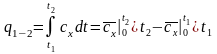 ;
;
определяется изменение удельной энтальпии в процессе по формуле, справедливой для всех процессов идеального газа:
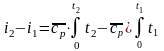
или для постоянной теплоемкости:
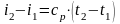 ;
;
определяется
изменение удельной энтропии идеального
газа по формулам:
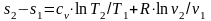 ,
,
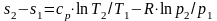 .
.
Рассматриваемые процессы считаются обратимыми.
Изохорный процесс
Процесс,
протекающий при постоянном объеме,
называют изохорным
( ,
или
,
или
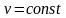 ).
Кривая процесса называется изохорой.
).
Кривая процесса называется изохорой.
При постоянном объеме давление газа изменяется прямо пропорционально абсолютным температурам:
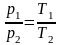 .
(1.17.1)
.
(1.17.1)
Внешняя работа газа при равна нулю, так как . Следовательно,
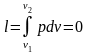 .
.
Удельная
располагаемая (полезная) внешняя работа
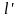 ,
которая может быть передана внешнему
объекту работы, равна:
,
которая может быть передана внешнему
объекту работы, равна:
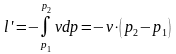 .
.
Если процесс 1-2 осуществляется с увеличением давления, то удельное количество теплоты в нем подводится, при этом увеличиваются внутренняя энергия и температура газа. Если давление в процессе понижается, то удельное количество теплоты отводится, уменьшаются внутренняя энергия и температура газа.
Изменение удельной энтропии в обратимом изохорном процессе определяем из уравнения:
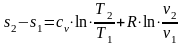 ,
,
Изменение энтропии при постоянной теплоемкости равно
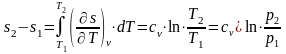 .
(1.17.2)
.
(1.17.2)
Как
видно из данного уравнения, изохора на
–
диаграмме
представляет собой кривую 1-2
(рис.
1.17.1). Подкасательная к кривой 1–2
в
любой ее точке дает значение истинной
теплоемкости
 .
.

Рис. 1.17.1
Изобарный процесс
Процесс,
протекающий при постоянном давлении,
называют изобарным
(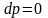 ,
или
,
или
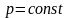 ).
Кривая процесса называется изобарой.
).
Кривая процесса называется изобарой.
Это соотношение называется законом Гей-Люссака. Для процесса 1-2
 .
(1.17.3)
.
(1.17.3)
В изобарном процессе объемы одного и того же количества газа изменяются прямо пропорционально абсолютным температурам.
При расширении газа его температура возрастает, при сжатии – уменьшается.
Удельная работа изменения объема при этом выражается следующим уравнением:
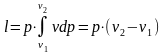 ,
(1.17.4)
,
(1.17.4)
или
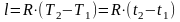 .
(1.17.5)
.
(1.17.5)
Для обратимого изобарного процесса при постоянной теплоемкости изменение удельной энтропии находится по уравнению:
 ,
,
Но
при
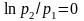 ,
поэтому
,
поэтому
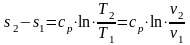 .
(1.17.6)
.
(1.17.6)
В
случае изохорного и изобарного процессов
в одном интервале температур
возрастание энтропии будет больше в
изобарном
процессе, так как
 всегда
больше
.
всегда
больше
.
Изотермный процесс
Процесс,
протекающий при постоянной температуре,
называют изотермическим
( ,
или
,
или
 ).
Кривая процесса называется изотермой
(рис. 18.2).
).
Кривая процесса называется изотермой
(рис. 18.2).
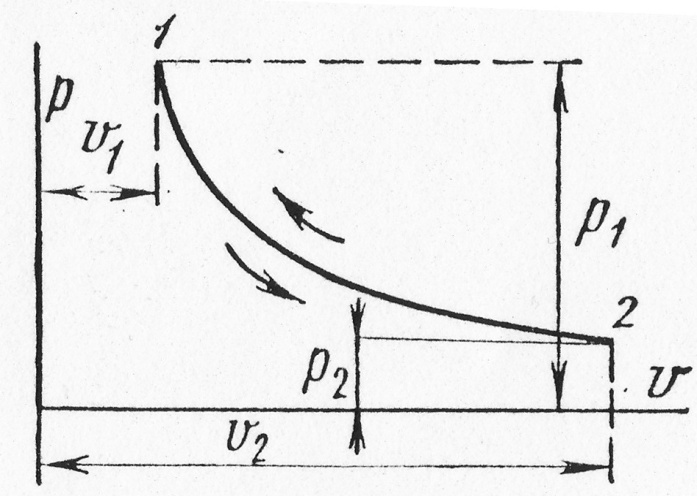
Рис. 1.17.2
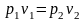 и
и
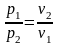 (1.17.7)
(1.17.7)
При постоянной температуре объем газа изменяется обратно пропорционально его давлению (закон Бойля – Мариотта).
На – диаграмме изотермный процесс представляет собой равнобокую гиперболу.
Зная уравнение изотермного процесса для идеального газа, можно подсчитать работу процесса.
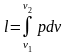
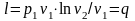 .
(1.17.8)
.
(1.17.8)
Удельная располагаемая внешняя работа определяется по формуле:
 ,
(1.17.9)
,
(1.17.9)
т.
е. в изотермном процессе идеального
газа
 ,
или
удельная работа изменения объема,
располагаемая
(полезная) работа и удельное количество
теплоты, полученное телом, равны между
собой.
,
или
удельная работа изменения объема,
располагаемая
(полезная) работа и удельное количество
теплоты, полученное телом, равны между
собой.

откуда
 и
и
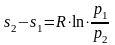 (1.17.10)
(1.17.10)
Удельное
количество теплоты, участвующее в
изотермическом процессе, равно
произведению изменения удельной энтропии
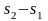 на
абсолютную температуру
:
на
абсолютную температуру
: