
- •10. Расчет массы навески анализируемой пробы.
- •11.Титриметрический анализ.Виды титриметрического анализа. Понятие титр и титрование,эквивалентная точка.
- •12.Методы нейтрализации при титриметрическом анализе. Виды индикаторов. Что такое «хромофор и ауксохромы»? теория цветности.
- •Зависимость кривых титрования от концентрации и константы равновесия.
Зависимость кривых титрования от концентрации и константы равновесия.
Для точного определения конечной точки титрования необходимо, чтобы на кривой титрования вблизи точки эквивалентности наблюдался перегиб (скачок). Это требование устанавливает пределы как для минимальной определяемой концентрации, так и для минимальной константы равновесия, приемлемой для реакции титрования. На рис. 3 представлены кривые титрования сильной кислоты сильным основанием и слабой кислоты сильным основанием. Видно, что при уменьшении концентрации скачок становится менее выраженным. Нижний предел концентрации зависит от конкретной реакции и метода определения конечной точки титрования, но проводить титрование при концентрациях ниже 10–4 М уже затруднительно. Рисунок 5 иллюстрирует влияние константы равновесия реакции титрования на кривую титрования. Для реакций нейтрализации в водных растворах константа равновесия в случае сильной кислоты и сильного основания составляет 1014, а для слабой кислоты и сильного основания – 1014Ka, где Ka – константа диссоциации кислоты. По мере уменьшения константы равновесия уменьшается и величина скачка. Чтобы визуальное определение конечной точки титрования было надежным, константа равновесия не должна быть меньше 106. При инструментальном контроле титрования или расчете положения конечной точки титрования на основании полученных данных константа равновесия может составлять всего 102.
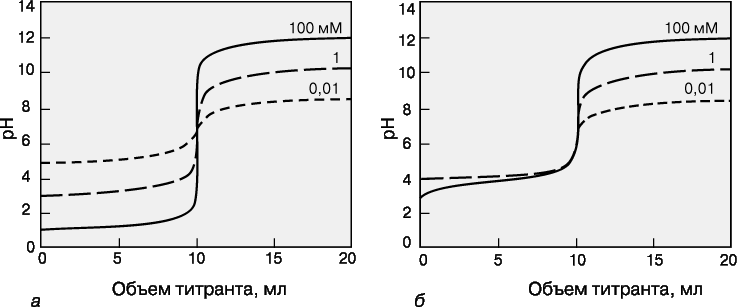
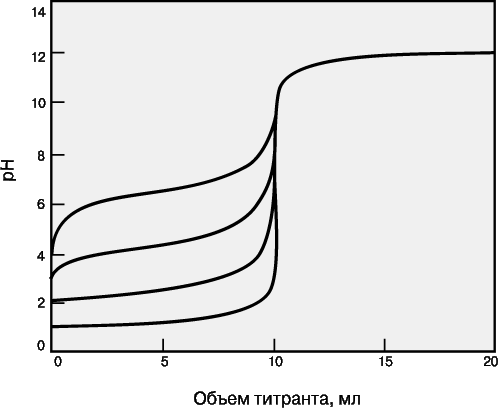
Рисунок 5
На рис показаны участки кривых титрования различного рода и соответствующее расположение на них конечной точки ЕР. При титровании кислоты сильным основанием значение водородного показателя рН в конечной точке тем выше, чем меньше степень диссоциации кислоты. Через Н+ обозначена сильная (например, соляная) кислота. Химическое состояние раствора титранта меняется по ходу титрования. Это может выразиться в изменении значения рН, окислительно-восстановительного потенциала или потенциала ионов металла, которые поддаются измерению или передаются другой, присутствующей тут же химической системе (индикатору, изменяющему цвет). Измеряемая величина изображается графически (в виде кривой титрования) в зависимости от количества добавленного титрующего раствора, откладываемого по оси абсцисс. Такие кривые имеют характерную форму и могут быть подразделены на две группы. При титровании сильных кислот сильными основаниями и при осадочном титровании, а нередко и при хелатометрическом титровании получается характерная кривая типа / (рис. 1—НО). При титровании слабых кислот сильными основаниями или наоборот, а также при окислительно-восстановительном титровании получается характерная кривая II.Кривые обоих типов имеют точку перегиба, которая точно совпадает с конечной точкой титрования или в некоторых случаях отклоняется от нее совсем незначительно. Кривые типа // имеют также и точку перегиба с пологим поворотом. Эта точка соответствует половине расхода реактива до конечной точки титрования. Ордината этой точки (рН или окислительно-восстановительный потенциал) приближенно соответствует показателю pKa титруемой кислоты или основания или их окислительно-восстановительному стандартному (нормальному) потенциалу. рКа и рКв- можно найти провести касательную к кривым титрования кислоты( в нижней части графика) или щелочи (график рисуется как для титрования кислоты, но наоборот, они пересекаются в центральной части .рКв можно найти проведя касательную к кривой титрования в верхней части графика). В точках пересечения касательных с осью ординат и найдем рКа и рКв.
