
Политропный процесс
Политропный процесс — термодинамический
процесс, во время которого удельная
теплоёмкость ![]() газа остаётся
неизменной. Предельными частными
явлениями политропного процесса
являются изотермический
процесс и адиабатный
процесс. В случае идеального
газа изобарный
процесс и изохорный
процесс также являются политропическими.
газа остаётся
неизменной. Предельными частными
явлениями политропного процесса
являются изотермический
процесс и адиабатный
процесс. В случае идеального
газа изобарный
процесс и изохорный
процесс также являются политропическими.
Для идеального газа уравнение политропы может быть записано в виде:
![]() ,
,
где величина ![]() называется
показателем политропы.
называется
показателем политропы.
Из уравнения Клапейрона нетрудно получить выражения, устанавливающие связь между p, V и Т в любых двух точках на политропе:

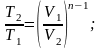
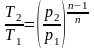 .
.
Работа расширения газа в политропном процессе имеет вид:
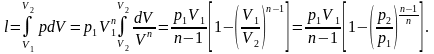
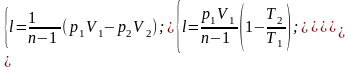
Количество подведенной (отведенной) в процессе теплоты можно определить с помощью уравнения первого закона термодинамики : q=(u2-u1)+l. Так как
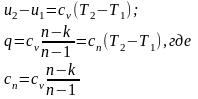
представляет собой теплоемкость идеального газа в политропном процессе. При постоянных сv, k и n теплоемкость cn=const, поэтому политропный процесс иногда определяют как процесс с постоянной теплоемкостью.
Изменение энтропии:
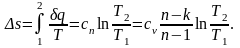
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов.
В зависимости от процесса можно определить значение n:
1. Изотермический процесс: ![]() ,
так как
,
так как ![]() ,
значит
,
значит ![]() ,
значит
,
значит ![]() .
.
2. Изобарный процесс: ![]() ,
так как
,
так как ![]() .
.
3. Адиабатный процесс: ![]() ,
это следует из уравнения
Пуассона. Здесь
,
это следует из уравнения
Пуассона. Здесь ![]() — показатель
адиабаты.
— показатель
адиабаты.
4. Изохорный процесс: ![]() ,
так как
,
так как ![]() ,
значит
,
значит ![]() ,
значит
,
значит ![]() ,
значит, чтобы
,
значит, чтобы ![]() обратились
в 1, n должна быть бесконечность.
обратились
в 1, n должна быть бесконечность.
Вопросы:
Второй закон термодинамики
В чем заключается тепловая смерть
Энтропия
Энтропия изолированной системы
Энтальпия
Политропный процесс
Работа и теплота в политропном процессе
Список литературы:
http://www.xumuk.ru/encyklopedia/2/6008-11.jpg
http://ru.wikipedia.org/wiki
http://stringer46.narod.ru/Processes-of-thermodynamics.htm
http://www.terver.ru/adiabaticheskiy_procces.php
http://www.teploenergetik.com/teoreticheskie-osnovyi-teplotehniki/4.3-politropnyiy-protsess.html
