
Углеводы
Углеводы
– это соединения, структура которых
выражается общей формулой
![]() ,
где n
больше или равно 4.
,
где n
больше или равно 4.
Биологическая роль
Углеводы широко распространены как в растительном, так и в животном мире. До 90% сухого вещества растений приходится на углеводы, в животных организмах – около 2% сухого вещества.
В растениях углеводы образуются в результате фотосинтеза из диоксида углерода и воды с участием солнечной энергии и хлорофилла:
![]()
Животные не способны сами синтезировать углеводы и используют углеводы, синтезируемые растениями.
Классификация углеводов
Углеводы в зависимости от строения, величины молекул и физических, химических свойств подразделяются на моносахариды, олигосахариды и полисахариды, расщепляющиеся при гидролизе на моносахариды.
Моносахариды (монозы)
Моносахариды – соединения, в основе которых лежит неразветвленная углеродная цепь, при одном из атомов углерода которой находится карбонильная группа, а при всех остальных – по одной гидроксигруппе.
Моносахариды обычно имеют названия с суффиксом –оза, например, глюкоза, фруктоза, рибоза и т. д.
Обычно моносахаридами называют соединения с длиной углеродной цепи не менее трех атомов. В зависимости от числа углеродных атомов в молекуле различают триозы (n=3), тетрозы (n=4), пентозы (n=5) и т. д. В зависимости от того, входит в состав моносахарида альдегидная или кетогруппа, их разделяют на альдозы и кетозы.

Для изображения строения моносахаридов используют проекционные формулы Фишера. В формулах Фишера цепь углеродных атомов располагается в одну линию. Нумерация цепи начинается с атома углерода альдегидной группы или с крайнего атома углерода, к которому ближе располагается кетогруппа.
Циклические формулы принято изображать формулами Хеуорса.
Для перехода от формул Фишера к формулам Хеуорса нужно знать следующие правила:
Изобразить цикл в виде плоского многоугольника. Нумерацию атомов углерода в цикле производить по часовой стрелке.
Атомы и группы атомов, которые в формуле Фишера находятся справа от цепи, в формуле Хеуорса располагаются под плоскостью цикла, и наоборот.
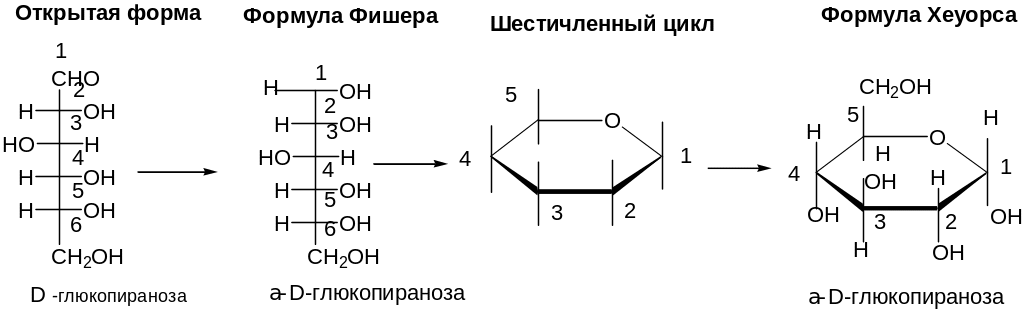
Направление оптического вращения обозначают знаками плюс и минус, а буквами D и L обозначают принадлежность данного моносахарида к D- или L-ряду.
Физические свойства
Моносахариды – кристаллические бесцветные вещества. Имеют сладкий вкус. Хорошо растворимы в воде и Нерастворимы в эфире, плохо растворимые в спирте.
Химические свойства
Мутаротация.
В водных растворах монозы существуют в виде оксо-циклотаутомеров. Реакция сопровождается появлением a- и b- аномеров.
Кристаллические
формы
![]() -и
b-глюкозы
вполне устойчивы, но
в
растворе каждая из них медленно
превращается в равновесную смесь обеих
форм. За этим процессом легко проследить
по уменьшению оптического вращения
a-аномера
(+112 градусов) или по возрастанию
оптического вращения
b-аномера
(+18,7 градусов) до равновесного значения,
составляющего 52,5 градусов.
-и
b-глюкозы
вполне устойчивы, но
в
растворе каждая из них медленно
превращается в равновесную смесь обеих
форм. За этим процессом легко проследить
по уменьшению оптического вращения
a-аномера
(+112 градусов) или по возрастанию
оптического вращения
b-аномера
(+18,7 градусов) до равновесного значения,
составляющего 52,5 градусов.
Из этого следует, что процесс изменения оптического вращения при установлении равновесия называется мутаротацией.
Это явление обычно наблюдается для восстанавливающих сахаров (т. е. таких, в которых карбонильная функция существует в форме полуацеталя).
Мутаротация катализируется кислотами и солями. В твердом состоянии монозы находятся исключительно в циклической форме.
2. Эпимеризация.
Называется также перегруппировкой Лобри-де-Брюина – Ван-Экейнштейна. Протекает при обработке моноз слабыми (меньше 1 %) растворами щелочей. В ходе перегруппировки возникает промежуточное соединение – ендиол
 .
.
Превращения
ендиола могут привести к образованию
кетозы или к двум альдозам, различающимся
только конфигурацией атома
![]() .
Так из D-глюкозы
при обработке слабощелочными растворами
образуется смесь D-глюкозы,
D-
маннозы и D-фруктозы.
.
Так из D-глюкозы
при обработке слабощелочными растворами
образуется смесь D-глюкозы,
D-
маннозы и D-фруктозы.
Альдозы, отличающихся только конфигурацией атома углерода, ближайшего к альдегидной группе, называются эпимерами, поэтому вся реакция получила название эпимиризации. Образующаяся при реакции кетоза (фруктоза) является структурным, а не пространственным изомером, то есть не относится к эпимерам.
3.Ретроальдольное расщепление
Происходит под влиянием более концентрированных, чем для эпимеризации, водных растворов щелочей и, как правило, при нагревании. При таком расщеплении получается сложная смесь соединений, молекулы которых состоят, в основном, из трех атомов углерода (глицериновый альдегид, диоксиацетон) и более коротких молекул (формальдегид, гликолевый альдегид).
Реакция идет по механизму, обратному механизму альдольной конденсации.
4. Образование фенилозазонов
Наблюдается при действии на монозы трехкратного количества фенилгидразина.

При кислотно-католизируемом гидролизе или обработке бензальдегидом фенилозазоны превращаются в озоны, восстановление которых амальгамой натрия в слабокислой среде позволяет перейти от альдоз к кетозам:
 .
.
5.Окисление
а) Окисление под действием слабых (мягких) окислителей с образованием глюконовой кислоты.
В
качестве слабых окислителей используют
аммиачный раствор гидроксида серебра
(реактив Толленса); реактив Фелинга –
смесь
![]() с калий-натрий-тартратом; раствор брома
в воде (бромную воду); разбавленный
раствор
с калий-натрий-тартратом; раствор брома
в воде (бромную воду); разбавленный
раствор
![]() .
.

D-глюкоза D-глюконовая
кислота

Глюкоза глюконовая
Кислота
Реакции с реактивом Толленса («реакция серебряного зеркала») и реактивом Фелинга являются качественными реакциями на альдозы.
б) Окислители со средней окисляющей способностью, например концентрированная , превращающуют в карбоксильную группу не только альдегидную, но и первично-спиртовую группу, окисляя альдозы до сахарных кислот:

в)
Окисление
![]() приводит к образованию смеси формальдегида
с муравьиной кислотой, т. е. происходит
деструкция цепи:
приводит к образованию смеси формальдегида
с муравьиной кислотой, т. е. происходит
деструкция цепи:

г)
Окисление
моноз, имеющих защищенную (не способную
реагировать) альдегидную групп, например
простых эфиров с группировкой
![]() у первого углеродного атома,
концентрированной
приводит к образованию уроновых кислот:
у первого углеродного атома,
концентрированной
приводит к образованию уроновых кислот:

Гликозид D-глюкуроновая
D-глюкозы кислота
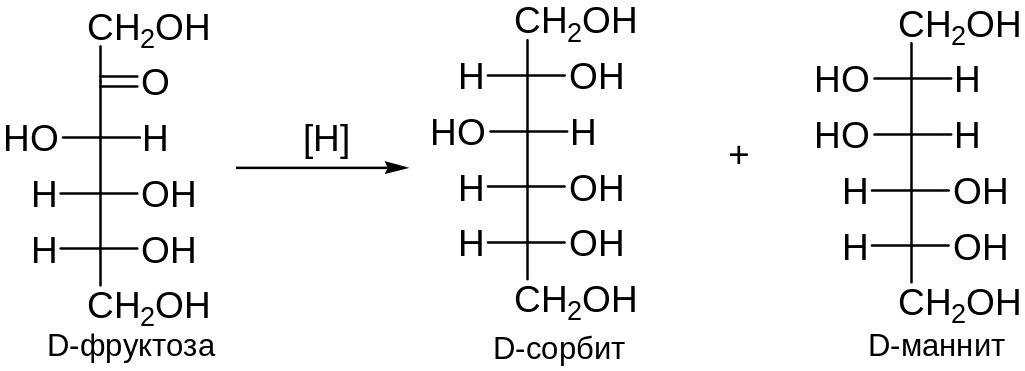
6. Восстановление моноз
При восстановлении моноз получаются полиолы, называемые сахарными спиртами. Так, из глюкозы и фруктозы получают шестиатомный спирт сорбит, из маннозы – манит, из галактозы – дульцит, из ксилозы – пятиатомный спирт ксилит и т. д.

D-глюкоза D-Сорбит
(глюцит)
Для восстановления используют амальгаму натрия в водной, водно-спиртовой или спиртовой среде; водород в присутствии катализаторов (Ni, Pt, Pd) и гидриды металлов.
При восстановлении альдоз образуется один спирт, а при восстановлении кетоз – два стереоизомерных полиола:
7. Дегидратация
Идет плд действием минеральных кислот и приводит к производным фурана.
Пентозы теряют три молекулы воды, превращаясь в фурфурол (2-фуран-альдегид):

Гексозы также дают производные фурана – 5-гидроксиметилфурфурол, который, теряя молекулу муравьиной кислоты, превращается в левулиновую кислоту (2-оксопентановую):
 левулиновая
кислота
левулиновая
кислота
8. Укорочение цепи (синтез Воля)
Позволяет
перейти от монозы с большим числом
атомов углерода в цепи к соединениям с
более короткой цепью вплоть до
глицеринового альдегида.
9. Удлинение цепи
Углеродная цепь наращивается циангидридным методом:

затем идет гидролиз нитрила с образованием лактона кислоты, при восстановлении которого получается моноза, содержащая на один атом углерода больше, чем исходная.
10. Алкилирование
а) При обработке моноз спиртами в присутствии газообразного HCl получаются ацетали, называемые гликозидами. В данных условиях в реакцию вступает только гликозидный гидроксил, спиртовые гидроксильные группы в реакции не учавствуют. Образующийся алкилгликозид является смесью аномеров (в формулах Хеуорса и конформационных формулах неопределенная конфигурация гликозидного гидроксила изображается горизонтально расположенным волнистым валентным штрихом):

Гликозиды, в которых связь с алкильным остатком, образована через атом кислорода, называют О-алкилгликозидами. Они легко гидролизуются водными растворами кислот, но устойчивы к гидролизу в щелочных условиях.
б) Действие на монозы алкилгалогенидов в смеси с оксидом серебра или диалкилсульфатов в щелочной среде приводит к алкилированным моносахаридам. Обычно эту реакцию проводят с О-метилгликозидами для получения исчерпывающе метилированных моноз.

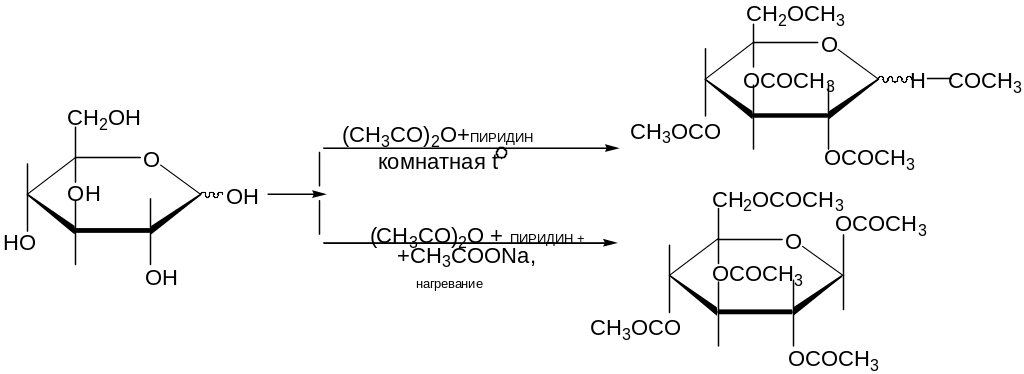
11. Ацилирование моноз
Происходит
при действии на монозы, хлорангидридов
или ангидридов кислот, в присутствии
кислых (![]() )
или основных (пиридин, ацетат натрия)
катализаторов:
)
или основных (пиридин, ацетат натрия)
катализаторов:
12. Брожение
Отличительным свойством моносахаридов является их способность вступать в анаэробное (без доступа кислорода) расщепление под влиянием микроорганизмов или выделенных из них ферментов. Такие процессы называются брожением.
Наиболее легко подвергаются брожению глицериновый альдегид, диоксиацетон и гексозы. Легче подвергаются брожению монозы D-ряда, то есть встречающиеся в природе, чем монозы L-ряда.
Спиртовое брожение – это расщепление глюкозы в анаэробных условиях смесью ферментов, зимазой, которую выделяют дрожжевые грибки.


Уксуснокислое брожение. Если брожение осуществляется в присутствии кислорода, то в качестве основного продукта получают уксусную кислоту.

Таким образом получают “винный уксус” (пищевую уксусную кислоту) специально, но этот процесс ответственен также за “прокисание” вина при нарушении технологии спиртового брожения и при негерметичном хранении неокрепшего вина.
Молочнокислое брожение. Известны два вида молочнокислого брожения. При ферментативном брожении под действием Lactobacillus delbruckii

Этот
процесс реализуется в производстве
молочной кислоты, кисломолочных
продуктов, хлеба, при силосовании кормов
в сельском хозяйстве. В ином варианте
ферментативного брожения (Bacterium
lactis
aerogene![]() s)
образуются молочная кислота, уксусная
кислота, этиловый спирт,
s)
образуются молочная кислота, уксусная
кислота, этиловый спирт,
![]() и некоторые другие соединения. Такое
брожение идет при квашении плодов и
овощей.
и некоторые другие соединения. Такое
брожение идет при квашении плодов и
овощей.
Лимоннокислое брожение:

Маслянокислое брожение:
![]()
Известны и другие типы брожения, например, ацетон-бутиловое и др.
Важнейшие представители
1.Ксилоза(древесный сахар).Входит в состав полисахаридов ксиланов, содержащихся в древесине, соломе, кукурузных кочерыжках, лузге подсолнечника. При гидролизе получают D-ксилозу.
Ксилоза – бесцветное кристаллическое вещество.
Ксилоза не усваивается организмом человека и не подвергается брожению.
При
нагревании ксилозы в водных растворах
серной кислоты происходит циклизация
и отщепление воды. Образуется
гетероциклическое соединение фурфурол
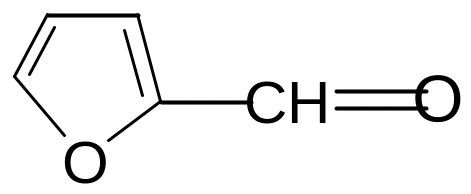 .
.
2. Рибоза. Входит в состав рибонуклеиновых кислот и может быть получена их гидролизом.
Бесцветное крисаллическое вещество, хорошо растворимое в воде
Рибоза используется в синтезе нуклеозидов.
3. 2-Дезоксирибоза
Образует бесцветные металлы, хорошо растворимые в воде. В кристаллическом виде существует в виде фуранозы.
Дезоксирибоза используется в синтезах нуклеозидов.
4. Глюкоза(виноградный сахар).
В свободном виде содержится во фруктовых соках.
В
кристаллическом виде можно получить
оба аномера D-глюкозы
a
– и
![]() -формы.
Оба являются бесцветными кристаллическими
веществами с приятным сладким вкусом,
оптически активны.В растворе наблюдыется
мутаротация. Чистую глюкозу получают
кислотным гидролизом крахмала.
-формы.
Оба являются бесцветными кристаллическими
веществами с приятным сладким вкусом,
оптически активны.В растворе наблюдыется
мутаротация. Чистую глюкозу получают
кислотным гидролизом крахмала.
Используют глюкозу в пищевой промышленности, медицине, для синтеза глюконовой и аскорбиновой кислот, в качестве восстановителя в текстильной промышленности, для получения этилового спирта.
5. Галактоза.
Встречается в природе в свободном виде, в виде гликозидов, дисахаридов (лактозы), полисахаридов. Она входит в состав стероидных алкалоидов, выделенных из растении семейства пасленовых, например соланина, содержащегося в картофеле.
6. Фруктоза(плодовый сахар, левулоза.
Распространена в растительном мире. Содержится в помидорах, яблоках. Больше всего ее в пчелином меде (до 50%).
Получают фруктозу гидролизом сахарозы.
Фруктоза – наиболее сладкая из всех сахаров. Она в 1,5 раза слаще сахарозы и в 3 раза слаще глюкозы. Используют фруктозу в медицине как ценный продукт питания
7.Сорбоза и аскорбиновая кислота.Кетогексоса сорбоза содержится в природных продуктах, принадлежит к L-ряду .Получают микробиологическим окислением D-сорбита. В кристаллическом состоянии существует в форме пиранозы. Оптически активна.
L-Сорбоза служит исходным веществом для синтеза аскорбиновой кислоты (витамина С).
L-Аскорбиновая кислота – бесцветное кристалличекое вещество с кислым вкусом, хорошо растворяется в воде, оптически активна. Содержится во многих фруктах и овощах. Важный витамин. Является сильным восстановителем, так как имеет едиольную структуру. Суточная потребность в ней для человека – не менее 50мг.
8. Гликозиды. Связь между агликоном и остатком монозы (гликозидная связь) может осуществляться через атомы кислорода, азота и углерода. В зависимости от этого различают O-,N- и С-гликозиды:
В природе наиболее распространены O- и N-гликозиды. Большое количество О-гликозидов встречается в растениях, например ванилин- -D- глюкопиранозин в стручках ванили; кониферин в составе лигнина; амигдалин в косточках горького миндаля, абрикосов, слив, вишен, в листьях лавровишни и пр. Наиболее распространенными в природе N-гликозидами являются компоненты нуклеиновых кислот – нуклеозиды:
Значительно реже встречаются С- гликозиды. Такие гликозиды, в которых агликонами служат остатки аденина являются антибиотиками.
Все гликозиды устойчивы к щелочному гидролизу.
Олигосахариды
Олигосахариды – низкомолекулярные сахароподобные углеводы, содержащие от двух до десяти остатков моносахаридов (обычно гексоз), соединенных гликозидными связями.
Простейшим из них являются дисахариды.
Дисахариды
Дисахариды – продукты конденсации двух моносахаридов.
Физические свойства
Дисахариды – типичные сахароподобные углеводы; это твердые кристаллические вещества, хорошо растворимые в воде, имеющие сладкий вкус.
Химические свойства
Связывание двух моносахаридных остатков может привести к двум типам структур:
связывание осуществляется за счет гликозидных гидроксилов обеих моноз – невосстанавливающие дисахариды;
связывание осуществляется за счет гликозидного гидроксила одной молекулы и спиртового гидроксила другой – восстанавливающие дисахариды.
Восстанавливающие
дисахариды имеют свободный полуацетальный
гидроксил и, следовательно, способны к
оксо-циклотаутомерии. В ходе мутаротации
они приобретают альдегидную группу и
становятся способными участвовать в
реакциях с реактивами Толленса и Фелинга
в роли восстановителей ионов
![]() и
и
![]() .
Для восстанавливающих дисахаридов
такие реакции неосуществимы.
.
Для восстанавливающих дисахаридов
такие реакции неосуществимы.
Рассмотрим важнейшие представители:
1.
Сахароза
(a-D-глюкопиранозидо-b-
D-фруктофуранозид)
– тростниковый сахар.

Содержится в сахарном тростнике, сахарной свекле, различных фруктах, ягодах, овощах.
При нагревании сахарозы с водными растворами кислот или с водой в присутствии фермента инвертазы происходит гидролиз с образованием смеси ,которая называется инвертированным сахаром. Он содержится в пчелином меде.
При нагревании до температуры выше 185 градусов сахароза буреет, разлагаясь с выделением воды и образуя так называемую карамель – смесь некристаллизующихся веществ (процесс карамелизации).
Сахароза легко расщепляется ферментативно в организмах человека и животных. Она является ценным пищевым продуктом и исходным для получения этилового спирта.
Мальтоза [4-(a-D-глюкопиранозидо)-D- глюкопираноза] – солодовый сахар.
В свободном виде не встречается. Образуется из крахмала или гликогена под действием фермента диастазы.
Лактоза [4-( -D-галактопиранозидо)-D- глюкопираноза] – молочный сахар.
Один из важнейших сахаров молока. Найдена также в пыльцевых трубках ряда растений.
4.Целлобиоза [4-( -D-глюкопиранозидо)-D- глюкопираноза].
Содержится в прорастающих семенах, косточках абрикосов, пасоке деревьев.
