
Реакция поликонденсации типа «голова-хвост»
![]()
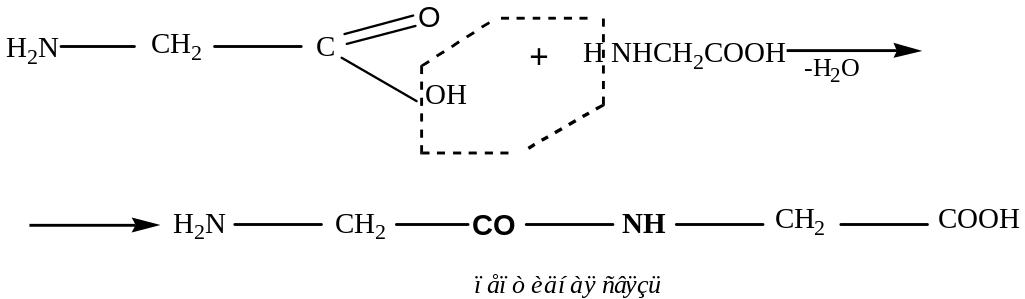
2) Синтез же пептида с заданной последовательностью аминокислот осуществляется в несколько этапов:
а) защита тех аминных или карбоксильных групп, которые не должны участвовать в реакции;
б) образование пептидной связи;
в) снятие защитных групп.
Защитные группы должны надежно закрывать аминную и карбоксильную группы в процессе синтеза и потом легко сниматься без разрушения пептидной связи.
Защита аминогруппы наиболее просто проводится ацилированием:
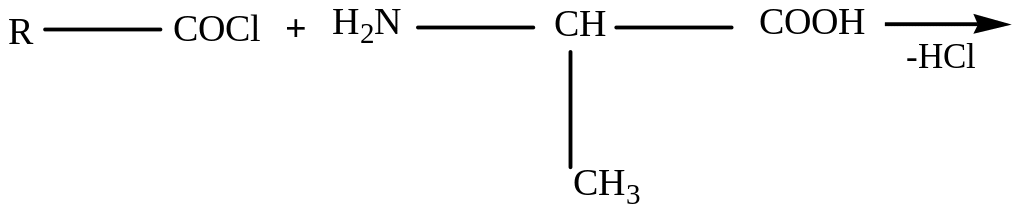
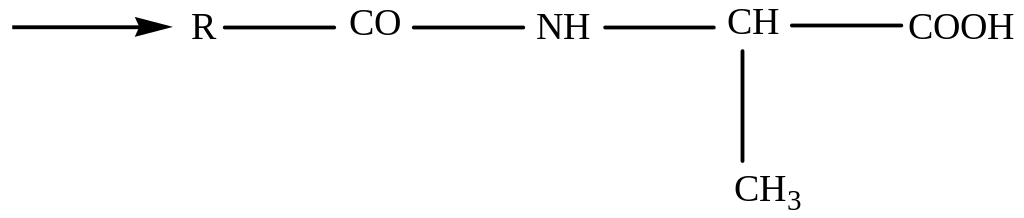
Карбоксильную группу для защиты превращают в сложноэфирную (реакция этерификации):
![]()
Для образования пептидной связи или активируют карбоксильную группу N-ацилаланина, превращая его в хлорангидрид, или проводят конденсацию в присутствии сильных водоотнимающих веществ:

Затем снимают защитные группы в таких условиях, чтобы не затрагивалась пептидная связь.
Химические свойства
Так как молекула любого белка содержит на одном конце аминогруппу –NH2, а на другом конце – карбоксильную группу –СООН, то это легко объясняет их амфотерные свойства.
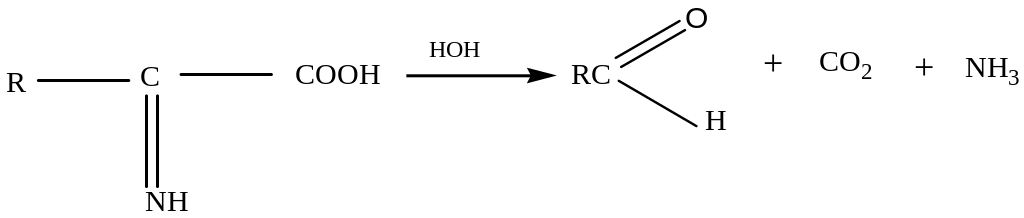
Гидролиз белков
В лабораторных условиях и в промышленности проводится кислотный гидролиз.
Реакция проходит ступенчато.
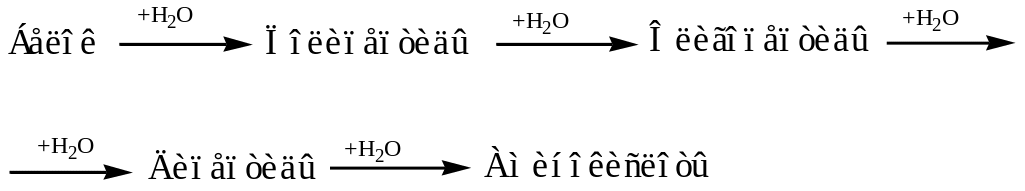
2) Цветные качественные реакции на белки
а) Биуретовая реакция (ее дают все белки)
Реакция заключается в обработке белка солями меди в щелочной среде. В ходе реакции образуется комплексное (хелатное) соединение, наблюдается фиолетовое окрашивание.
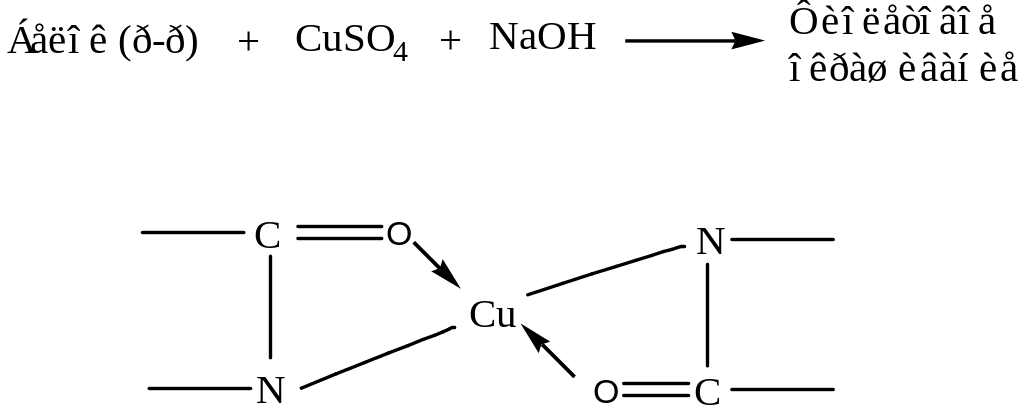
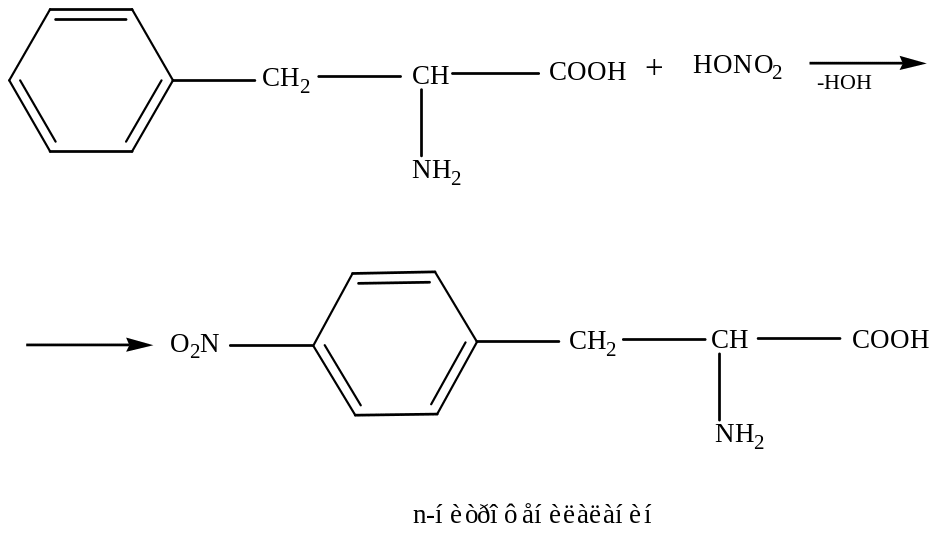
б) Ксантопротеиновая реакция (ее дают не все белки)
При действии на белок концентрированной азотной кислоты появляется желтое окрашивание, что связано с образованием нитропроизводных ароматических аминокислот. При дальнейшей обработке соединения аммиаком наблюдается переход желтого окрашивания в оранжевое.
в) Реакция Милона
При кипячении раствора белка с раствором нитрата ртути в смеси азотной и азотистой кислот Hg(NO)2 + HNO3 + HNO2 происходит выпадение красно-коричневого осадка.
г) Нингидринная реакция (на все белки)
При кипячении с водным раствором нингидрина появляется сине-фиолетовая окраска. Общая схема реакции:

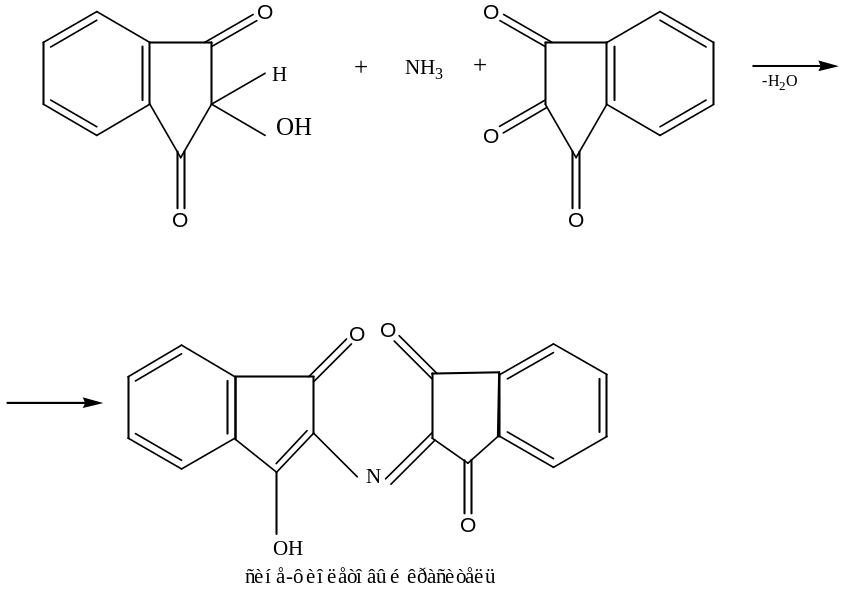
д) Цистеиновая реакция (реакция на остатки S-содержащих аминокислот)
При нагревании белка со щелочью в присутствии солей свинца выпадает черный осадок сульфида свинца (ІІ) PbS, что и свидетельствует о присутствии серосодержащих аминокислот.
![]()
Строение белковых молекул
Существуют 4 уровня структурной организации белковых молекул: первичная, вторичная, третичная и четвертичная.
Первичная структура представляет собой специфическую последовательность аминокислот в полипептидной цепи.
Последовательность аминокислот в полипептидных цепях белков оказывает огромное влияние на их свойства. Пептиды, состоящие из аминокислот одного типа, часто оказываются малорастворимыми вследствие сильных внутримолекулярных взаимодействий. Если однородность цепи нарушается в результате включения в нее других аминокислот, то можно ожидать, что внутримолекулярные взаимодействия будут ослаблены.
Вторичная структура белков отражает расположение полипептидной цепи в пространстве. Полипептидная цепь может существовать в нескольких видах: 1) β-форма; 2) α-спираль; 3) неупорядоченная структура.
Наиболее распространенным и выгодным положением является α-спираль. Пептидные цепи α-спирали свернуты таким образом, что возможно образование водородных связей между амидными водородными атомами и карбонильными группами, разделенными 3-4 аминокислотными фрагментами. Водородные связи почти параллельны основной оси спирали, а расстояние между витками составляет около 0,55 нм. На один виток α-спирали приходится около3,6 остатка аминокислот. При образовании спирали радикалы аминокислотных остатков располагаются снаружи, что обуславливает возможность образования третичной структуры белка.
В β-форме полипептидные цепи расположены в плоскости слегка изогнуты. Несколько цепей образуют слой, изгибы которого похож на складки ткани или бумаги.
Компактная, плотная структура, образующаяся при укладке организованной во вторичную структуру молекулы белка, называется третичной структурой. В зависимости от третичной структуры различают белки фибриллярные (нитевидные), нерастворимые в воде, водных растворах кислот, оснований, солей, и глобулярные, третичная структура которых имеет вид компактных клубочков. Глобулярные белки растворимы в воде, кислотных, основных и солевых растворах.
Для некоторых белков характерно образование ассоциатов из нескольких полипептидных цепей, каждая из которых имеет определенную первичную, вторичную и третичную структуру. Между полипептидными цепями (субъединицами) в четвертичной структуре существуют водородные, ионные, гидрофобные и другие связи.
