
Белки. Общие сведения
Белки – высокомолекулярные соединения (молекулярная масса от 104 до 107), макромолекулы которых состоят из остатков α-аминокислот, соединенных пептидными связями -СО-NH-.
В состав белков входят 20 различных α-аминокислот. Основные из них перечислены ниже.
Одноосновные моноаминокислоты
1) Глицин (гликокол)

2) Аланин (α-аминопропионовая кислота, 2-аминопропионовая кислота)

3) Валин (α-аминоизовалериановая кислота)
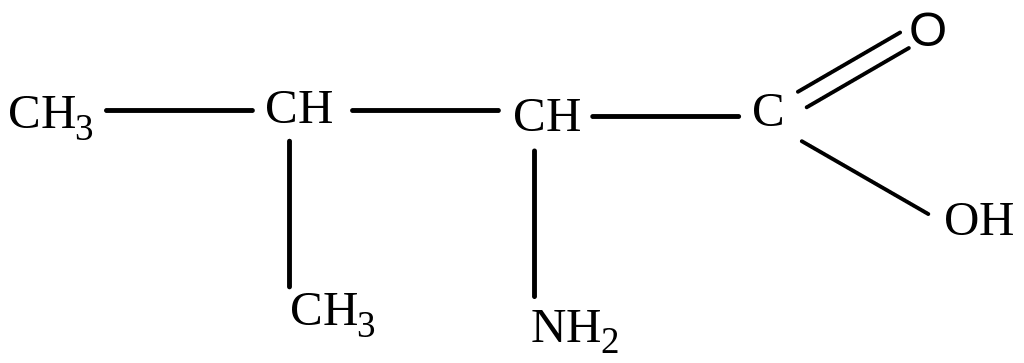
4) Лейцин (α-аминоизокапроновая кислота)
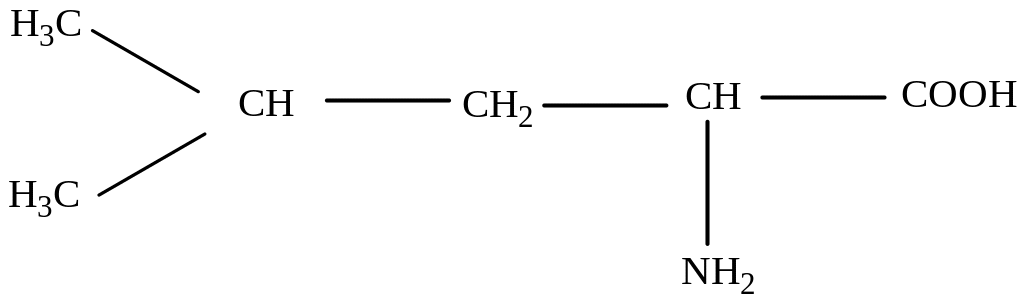
5) Изолейцин (2-амино-3-метилпентановая кислота)
Двухосновные моноаминокислоты
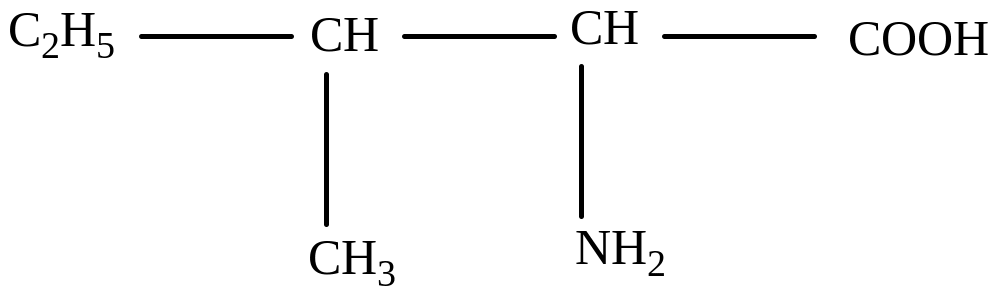
Аспарагиновая (α-аминоянтарная)

Глутаминовая (α-аминоглутаровая)
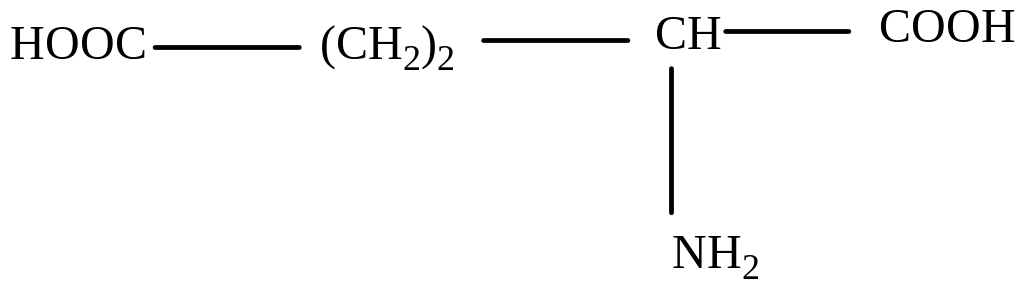
Одноосновные диаминокислоты
Лизин (α, ε-диаминокапроновая кислота)
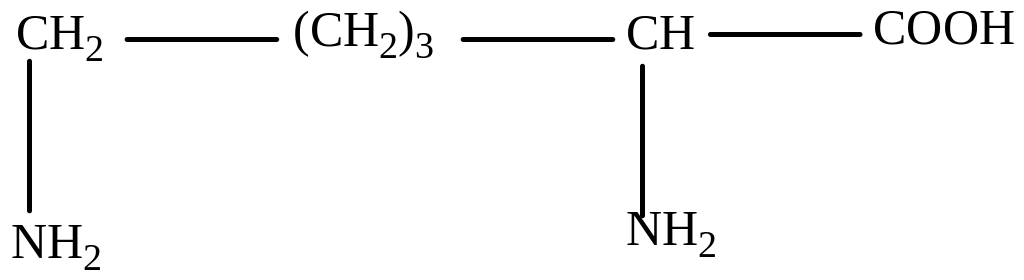
Аргинин
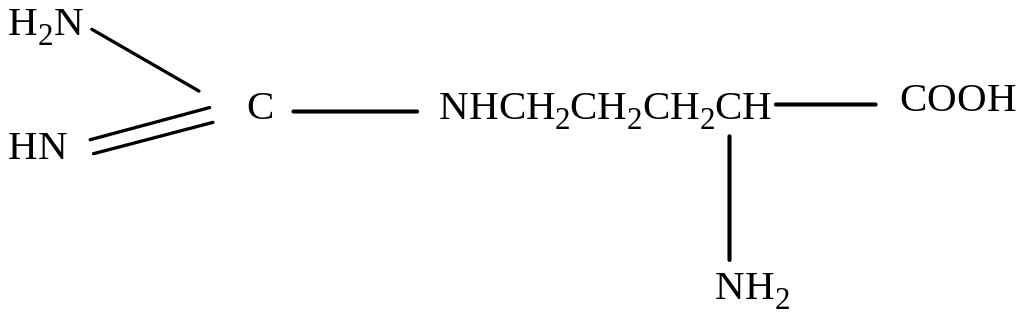
Оксиаминокислоты
Серин (β-оксиаланин)
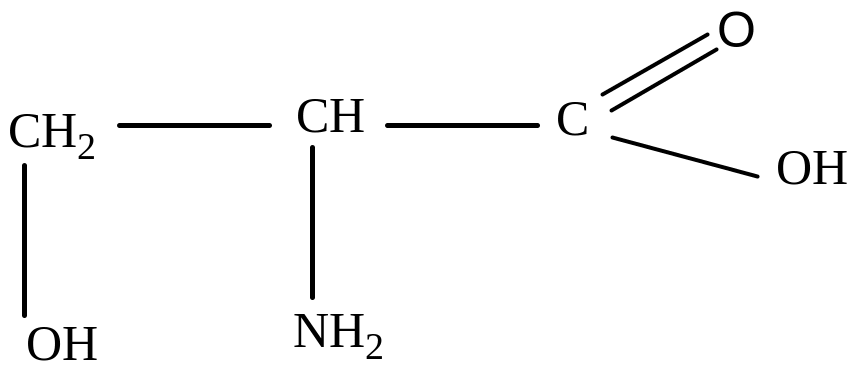
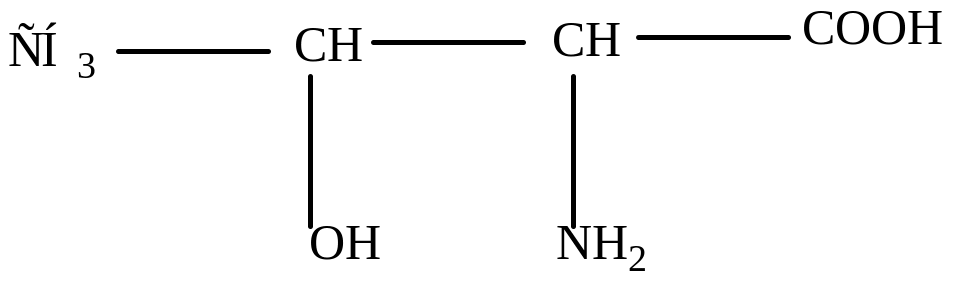
Треонин (β-окси- α-аминомасляная кислота)
Серосодержащие аминокислоты
Цистеин (β-меркаптоаланин)
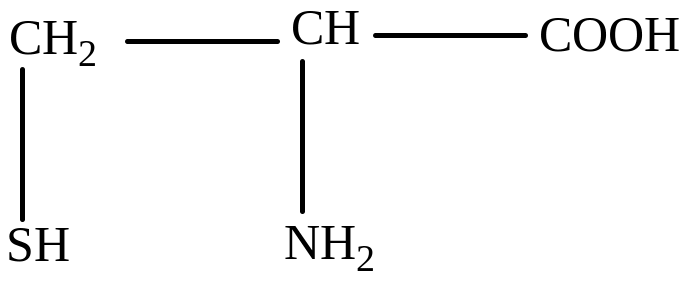
Метионин (γ-метилтио-α-аминомасляная кислота)

Ароматические аминокислоты
Фенилаланин

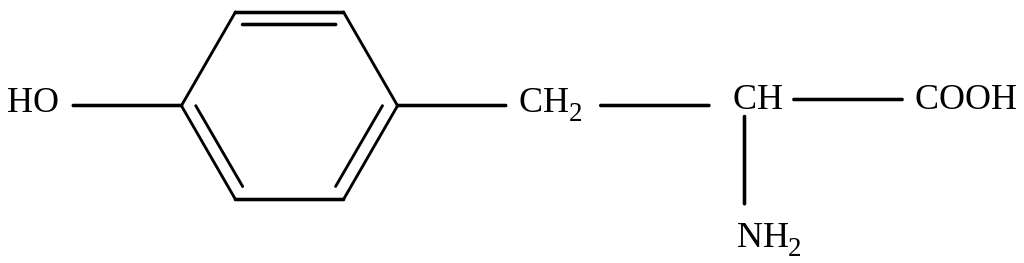
Тирозин
Гетероциклические аминокислоты
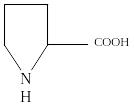
Пролин
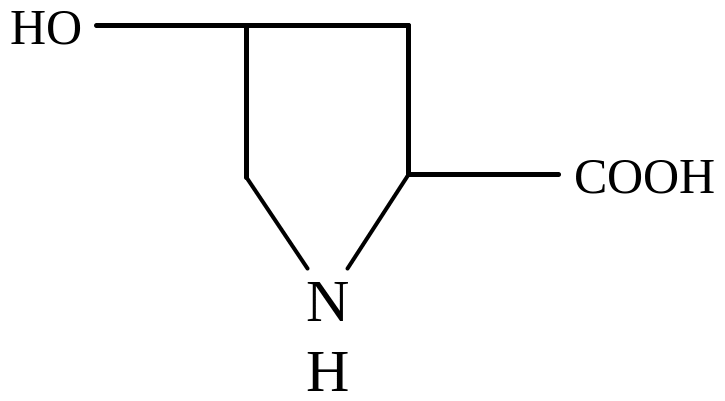
Оксипролин
Триптофан

Гистидин

Классификация белков
В зависимости от состава белки можно разделить на две группы:
1) протеины (простые белки) – белки, состоящие только из аминокислотных остатков;
2) протеиды (сложные белки) – белки, в состав которых помимо аминокислот входят остатки соединений, принадлежащих к иным классам органических и неорганических веществ (простетические группы).

Физические свойства
При обычных условиях различные белки находятся либо в твердом, либо в жидком агрегатном состоянии.
Существуют растворимые и нерастворимые в воде белки. Как правило, белки образуют коллоидные растворы.
Для белков характерны следующие физико-химические свойства:
обратимое осаждение (высаливание)
Белки способны осаждаться из растворов под действием таких веществ, как этиловый спирт, ацетон, соли натрия, калия, аммония и др. Свойства белков при таком осаждении не меняются, поэтому при добавлении воды белки снова могут переходить в раствор.
необратимое осаждение (денатурация, свертывание)
При действии таких реагентов, как соли тяжелых металлов, концентрированные кислоты и щелочи, а также в результате нагревания, облучения УФ- и γ-лучами происходит разрушение (полное или частичное) вторичной и третичной структуры белка и изменение его природных (нативных) свойств.
Пептиды и пептидная связь. Номенклатура
В результате взаимодействия некоторого числа аминокислот образуются соединения, которые называются пептидами. Амидные связи, находящиеся в составе пептидов, называются пептидными.
Та часть молекулы, в которой сохранилась не включенная в пептидную связь аминогруппа, называется N-концевой, а несущая ее аминокислота - N-концевым аминокислотным остатком, или N-концом пептида. Часть пептида, в которой осталась свободная карбоксильная группа, называется С-концевой, а аминокислота, включающая такую группу, представляет собой С-концевой аминокислотный остаток, или С-конец. При изображении формулы пептида N-конец располагают слева, а С-конец – справа:
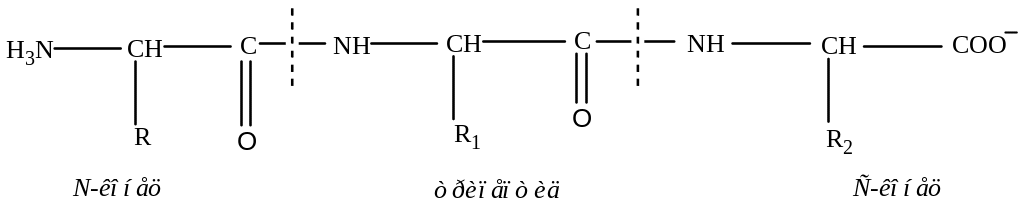
Название пептида формируется путем последовательного перечисления входящих в его состав аминокислот, начиная с N-конца. При этом суффикс –ин заменяется на суффикс –ил для всех аминокислот, кроме С-концевой. Например:

В зависимости от молекулярной массы пептиды делятся на:
1) олигопептиды (молекулярная масса не более 10000);
2) полипептиды, или белки (молекулярная масса более 10000).
Пептиды можно классифицировать и в зависимости от числа аминокислотных остатков, входящих в молекулу, на дипептиды, трипептиды, тетрапептиды и т.д.
Синтез пептидов. Активация и защита функциональных групп аминокислот
Сегодня существует много методов синтеза пептидов из α-аминокислот. Рассмотрим некоторые из них.
