Дефицит железа есть у трети населения
Железо в организме находится в составе:
примерно 25% всего железа в запасной форме (в комплексе с белком ферритином) в селезенке, костном мозге, печени,
в составе гемоглобина – около 2/3 всего количества,
в миоглобине и других внутриклеточных гемопротеинах (каталаза, цитохромы и др.),
только 0,1% железа находится в плазме крови.
Железосодержащие белки
К железосодержащим белкам относятся:
Гемопротеины – гемоглобин, миоглобин, цитохромы, цитохромоксидаза, гомогентизатоксидаза, пероксидаза, миелопероксидаза, каталаза, тиреопероксидаза.
Железофлавопротеины – цитохром-с-редуктаза, сукцинатдегидрогеназа, НАДФ-оксидаза (в гранулоцитах), ацил-S-КоА-дегидрогеназа, ксантиноксидаза, пролил-гидроксилаза и др.
Железосвязывающие белки – трансферрин, ферритин, гемосидерин, мобилферрин, лактоферрин и др.
Суточная потребность
С пищей в сутки должно поступать для мужчин 10 мг, для женщин детородного возраста в связи с регулярной кровопотерей – 20 мг, у женщин при беременности – 40-50 мг и при лактации – 30-40 мг.
Пищевые источники
Растительная пища (в 100 г) |
Животная пища (в 100 г) |
||
Морская капуста |
16 мг |
Печень |
11-15 мг |
Какао |
12,5 мг |
Мясо |
2-4 мг |
Шиповник |
12 мг |
Яйца |
3 мг |
Отрубной хлеб |
11 мг |
|
|
Гречка |
8 мг |
|
|
Свежие белые грибы |
5 мг |
|
|
Всасывание
При попадании в желудок под действием HCl желудочного сока железо высвобождается из элементов пищи.
Всасывание происходит в проксимальном отделе тонкого кишечника в количестве около 1,0-2,0 мг/день (10-15% пищевого железа). При этом железо должно быть в виде двухвалентного иона, в то же время с пищей поступает преимущественно трехвалентное железо. Для восстановления Fe3+ в Fe2+используется аскорбиновая кислота и соляная кислота. Только железо мясных продуктов находится в двухвалентной гемовой форме, и поэтому хорошо всасывается.
Железо мясных продуктов усваивается на 20-30%, из яиц и рыбы – на 10-15%, из растительных продуктов – на 1-5%.
Наличие в пище фитиновой кислоты (сухие завтраки, растительные продукты), кофеина и танина (чай, кофе, напитки), фосфатов, оксалатов(растительные продукты) ухудшает всасывание железа, т.к. образуются нерастворимые комплексы.
Метаболизм железа
После всасывания железо либо откладывается в клетках кишечника в составе ферритина (Fe3+), либо сразу попадает в кровоток и в комплексе с трансферрином (Fe3+) переносится в клетки печени, костного мозга или других тканей, где также связывается с ферритином. Вне связи с белками железо очень токсично, так как запускает свободно-радикальные реакции с образованием активных форм кислорода.
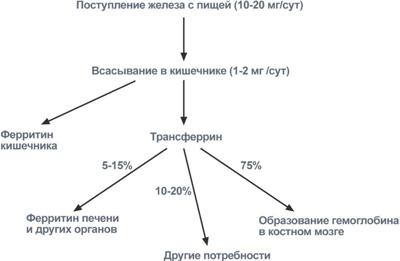
Пути поступления и использования ионов железа
Выведение
В сутки обычные потери железа составляют 1-2 мг и происходят несколькими путями:
с желчью
вместе со слущивающимся эпителием ЖКТ,
десквамация кожи,
у женщин детородного возраста – с месячными кровотечениями от 14 до 140 мг/месяц,
выпадение волос, срезание ногтей.
Нарушение обмена железа
Избыток
Существует аутосомно-рецессивное заболевание гемохроматоз, связанное с избыточностью всасывания железа в кишечнике. Для него характерны цирроз печени, поражение сердца и поджелудочной железы, паращитовидных желез.
Приобретенный избыток железа возникает при гемолитических анемиях, нарушении использования железа в метаболизме, при избыточной парентеральной терапии железодефицитных состояний. Накапливающийся ферритин преобразуется в гемосидерин, в результате резко снижается использование железа. Такое состояние называется гемосидероз. Потребление препаратов железа per os не приводит к интоксикации, так как возможности транспорта металла из кишечника ограничены свойствами трансферрина. Избыток железа в этом случае задерживается в эпителии кишечника и выводится со слущивающимися клетками.
Дефицит
При недостаточности железа в организме (железодефицит) мобилизация резервов происходит в следующем порядке:
сначала используется железо из депо (ферритин),
затем в клетках (кроме эритроидных) снижается количество гемопротеинов до жизнеспособного минимума,
далее истощаются запасы сывороточного железа (трансферрин),
в последнюю очередь страдает синтез гемоглобина.
Таким образом, железодефицитная анемия является проявлением крайнего дефицита железа и нормальная концентрация гемоглобина крови не должна быть критерием обеспеченности организма железом! По данным ВОЗ железодефицитная анемия имеется у трети населения планеты.
Причины дефицита железа
Причинами железодефицита являются
недостаток его в пище,
заболевания ЖКТ со снижением всасывания (гастриты),
потери железа с кровью при менструальных, кишечных или иных кровотечениях,
у новорожденных и грудных детей недостаток железа связан в первую очередь с недополучением его при внутриутробном развитии, и также в связи с ускоренным ростом в первый год жизни (физиологическая анемия).
Симптомы
Недостаточный синтез цитохромов, железосодержащих белков и нарушение доставки кислорода к тканям (при снижении содержания гемоглобина) вызывает ряд специфических и неспецифических симптомов:
ухудшение внимания и памяти у детей и взрослых,
иногда детская гиперактивность,
уплощение, волнистость и ломкость ногтей, появление исчерченности, белых пятен и полосок на ногтях,
выпадающий и секущийся волос,
поражение эпителия, проявляющееся в сухости и трещинах кожи рук и ног,
неинфекционный ларингофаринготрахеит (гиперемия, покраснение и охриплость), что дезориентирует врача,
Мышечная слабость:
– общая утомляемость, – недостаточное сокращение сфинктеров мочевого пузыря, при этом характерным признаком является выделение нескольких капель мочи при резком кашле, смехе, чихании, – недостаточное сокращение сфинктеров пищевода, что позволяет забрасываться соляной кислоте в пищевод и вызывать изжогу.
атрофический гастрит – может быть как причиной, так и следствием железодефицита, половина больных гастритом имеет недостаток железа,
обострение ишемической болезни сердца и других сердечно-сосудистых заболеваний, так как усиливает гипоэнергетическое состояние клеток (снижение содержания цитохромов в миокардиоцитах),
извращение обонятельных предпочтений – нравится запах краски, бензина, выхлопных газов, резины, мочи,
извращение вкусовых предпочтений – больные едят мел, штукатурку, уголь, песок, мясной фарш, лед.
Гемоглобин - основной белок крови
Гемоглобин входит в состав группы белков гемопротеины, которые сами являются подвидом хромопротеинов и подразделяются нанеферментативные белки (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Строение гемоглобина
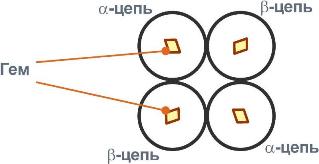
Строение гемоглобина А |
Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. - альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по две цепи двух разных типов.
Гем соединяется с белковой субъединицей, во-первых, через остаток гистидинакоординационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы "в кармане" своей цепи и формируется гемсодержащий протомер.
Нормальные формы гемоглобина
Существует несколько нормальных вариантов гемоглобина:
HbР – примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
HbF – фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
HbA – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Патологические формы гемоглобина
HbS – гемоглобин серповидно-клеточной анемии.
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма обычно образуется спонтанно, в этом случае ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления ионов железа в клинике используют аскорбиновую кислоту и метиленовую синь.
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни.
Угарный газ является активным ингибитором гем-содержащих ферментов, в частности, цитохромоксидазы 4-го комплекса дыхательной цепи.
HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени.
Миоглобин тоже способен связывать кислород
Миоглобин является одиночной полипептидной цепью, состоит из 153 аминокислот с молекулярной массой 17 кДа и по структуре сходен с β-цепью гемоглобина. Белок локализован в мышечной ткани. Миоглобин обладает более высоким сродством к кислороду по сравнению с гемоглобином. Это свойство обуславливает функцию миоглобина – депонирование кислорода в мышечной клетке и использование его только при значительном уменьшении парциального давления О2 в мышце (до 1-2 мм рт.ст).
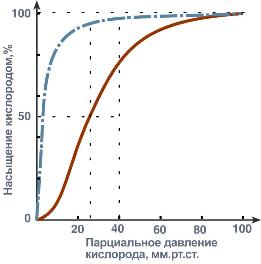
Кривые насыщения кислородом показывают отличия миоглобина и гемоглобина:
одно и то же 50%-е насыщение достигается при совершенно разных концентрациях кислорода – около 26 мм рт.ст. для гемоглобина и 5 мм рт.ст. для миоглобина,
при физиологическом парциальном давлении кислорода от 26 до 40 мм рт.ст. гемоглобин насыщен на 50-80%, тогда как миоглобин – почти на 100%.
Таким образом, миоглобин остается оксигенированным до того момента, пока количество кислорода в клетке не снизится до предельных величин. Только после этого начинается отдача кислорода для реакций метаболизма.