
- •1) По заряду комплекса
- •2) По числу мест занимаемых лигандами в координационной сфере
- •3) По природе лиганда
- •4.1. Изомерия лигандов
- •4.2. Геометрическая изомерия
- •4.3. Оптическая изомерия
- •4.4. Сольватная (гидратная) изомерия
- •4.5. Ионная изомерия
- •1.1. Комплексообразователь
- •1.3. Дентатность лиганда
- •1.4. Координационное число
- •1.5. Внутренняя и внешняя сфера комплексного соединения
- •Сравнение устойчивости комплексов:
- •Общая характеристика комплексных соединений хрома (III)
1.3. Дентатность лиганда
Чаще всего лиганд бывает связан с комплексообразователем через один из своих атомов однойдвухцентровой химической связью. Такого рода лиганды получили название монодентатных. К числу монодентатных лигандов относятся все галогенид-ионы, цианид-ион, аммиак, вода и другие.
Некоторые распространенные лиганды типа молекул воды H2O, гидроксид-иона OH-, тиоцианат-иона NCS-, амид-иона NH2-, монооксида углерода CO в комплексах преимущественно монодентатны, хотя в отдельных случаях (в мостиковых структурах) становятся бидентатными.
Существует
целый ряд лигандов, которые в комплексах
являются практически всегда бидентатными.
Это этилендиамин, карбонат-ион, оксалат-ион
и т.п. Каждая молекула или ион бидентатного
лиганда образует с комплексообразователем
две химические связи в соответствии с
особенностями своего строения: 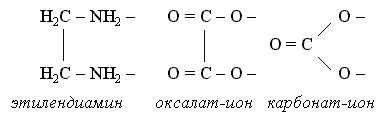
Например,
в комплексном соединении
[Co(NH3)4CO3]NO3 бидентатный
лиганд – ион CO32-- образует
две связи с комплексообразователем –
условным ионом Co(III), а каждая молекула
лиганда NH3 –
только одну связь: 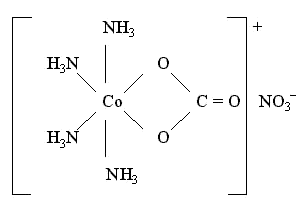
Примером
гексадентатного лиганда может служить
анион этилендиаминтетрауксусной
кислоты: 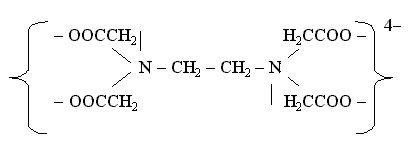
Полидентатные лиганды могут выступать в роли мостиковых лигандов, объединяющих два и более центральных атома.
1.4. Координационное число
Важнейшей характеристикой комплексообразователя является количество химических связей, которые он образует с лигандами, или координационное число (КЧ). Эта характеристика комплексообразователя определяется главным образом строением его электронной оболочки и обусловливается валентными возможностями центрального атома или условного иона-комплексообразователя (подробнее см. >>>).
Когда комплексообразователь координирует монодентатные лиганды, то координационное число равно числу присоединяемых лигандов. А число присоединяемых к комплексообразователю полидентатныхлигандов всегда меньше значения координационного числа.
Значение координационного числа комплексообразователя зависит от его природы, степени окисления, природы лигандов и условий (температуры, природы растворителя, концентрации комплексообразователя и лигандов и др.), при которых протекает реакция комплексообразования. Значение КЧ может меняться в различных комплексных соединениях от 2 до 8 и даже выше. Наиболее распространенными координационными числами являются 4 и 6.
Между значениями координационного числа и степенью окисления элемента-комплексообразователя существует определенная зависимость. Так, для элементов-комплексообразователей, имеющих степень окисления +I (AgI, CuI, AuI, II и др.) наиболее характерно координационное число 2 – например, в комплексах типа [Ag(NH3)2]+, [Cu(CN)2]-, [IBr2]-.
Элементы-комплексообразователи со степенью окисления +II (ZnII, PtII, PdII, CuII и др.) часто образуют комплексы, в которых проявляют координационное число 4, такие как [Zn(NH3)4]2+, [PtCl4]2-, [Pd(NH3)2Cl2]0,[ZnI4]2-, [Cu(NH3)4]2+.
В аквакомплексах координационное число комплексообразователя в степени окисления +II чаще всего равно 6: [Fe(H2O)6]2+, [Mg(H2O)6]2+, [Ni(H2O)6]2+.
Элементы-комплексообразователи, обладающие степенью окисления +III и +IV (PtIV, AlIII, CoIII, CrIII, FeIII), имеют в комплексах, как правило, КЧ 6. Например, [Co(NH3)6]3+, [Cr(OH)6]3-, [PtCl6]2- , [AlF6]3-, [Fe(CN)6]3-.
Известны комплексообразователи, которые обладают практически постоянным координационным числомв комплексах разных типов. Таковы кобальт(III), хром(III) или платина(IV) с КЧ 6 и бор(III), платина(II), палладий(II), золото(III) с КЧ 4. Тем не менее большинство комплексообразователей имеет переменное координационное число. Например, для алюминия(III) возможны КЧ 4 и КЧ 6 в комплексах [Al(OH)4]- и[Al(H2O)2(OH)4]-.
Координационные числа 3, 5, 7, 8 и 9 встречаются сравнительно редко. Есть всего несколько соединений, в которых КЧ равно 12 – например, таких как K9[Bi(NCS)12].
