
- •1.Предмет изучения и основное содержание биофизики.
- •2. Общие принципы описания кинетического поведения биологических систем, принцип узкого места, понятие фазовой траектории.
- •3. Качественное исследование простейших моделей биопроцессов. Поведение переменных на фазовой плоскости вблизи состояния равновесия.
- •4. Биологические триггеры. Фазовый портрет тригерной системы. Способы переключения стационарных состояний тригерной системы.
- •5. Колебательные процессы в биологии. Фазовый портрет автоколебательной системы.
- •6. Термодинамика систем вблизи равновесия. Первый и второй закон термодинамики. Живые системы.
- •Термодинамика живых систем
- •7. Второй закон термодинамики в открытых системах. Поддержание неравновесных состояний в бисистемах.
- •8. Теорема Пригожина
- •9. Термодинамика систем вдали от равновесия.
- •10. Энтропия, информация и биологическая упорядоченность.
- •11.Пространственная организация макромолекул.
- •Слабые невалентные взаимодействия в биологических системах.
- •13. Электронно-конформационные взаимодействия в макромолекулах
- •14. Спин электрона.
- •18. Механизмы переноса электрона и миграции энергии в биоструктурах.
- •19. Механизмы ферментативного катализа. Конформационные перестройки и высота барьера активации реакции
- •20. Молекулярная организация биологических мембран. Жидкомазаичная модель мембраны. Межмолекулярные взаимодействия в мембранах.
- •21. Механические и конформационные свойства мембран. Фазовые переходы биомембран.
8. Теорема Пригожина
При неизменных внешних условиях в частично равновесной открытой системе в стационарном состоянии, близком к термодинамическому равновесию, значение прироста энтропии за счет внутренних необратимых процессов достигает отличного от нуля постоянного минимального положительного значения.
Если система находится в стационарном состоянии, то она не может самопроизвольно выйти из него за счет внутренних необратимых изменений. Если же в результате флуктуаций система незначительно удаляется от стационарного состояния, то в ней происходят внутренние изменения, возвращающие ее в исходное стационарное состояние. Это означает, что стационарное состояние является устойчивым.
В соответствии с теорией Пригожина рост и развитие организмов происходят самопроизвольно и непрерывно в направлении достижения конечного стационарного состояния, что должно сопровождаться уменьшением скорости продуцирования энтропии, отнесенной к единице массы объекта, до минимальных значений в конечном стационарном состоянии. Изменения скорости теплопродукции, отнесенной к единице сухой массы, непрерывно уменьшается, начиная с первых стадий развития организма, что обнаружено при эмбриональном развитии рыб, животных, человека.
Однако детальное кинетическое описание процессов роста в настоящее время не представляется возможным.
Метаболический цикл можно представить:
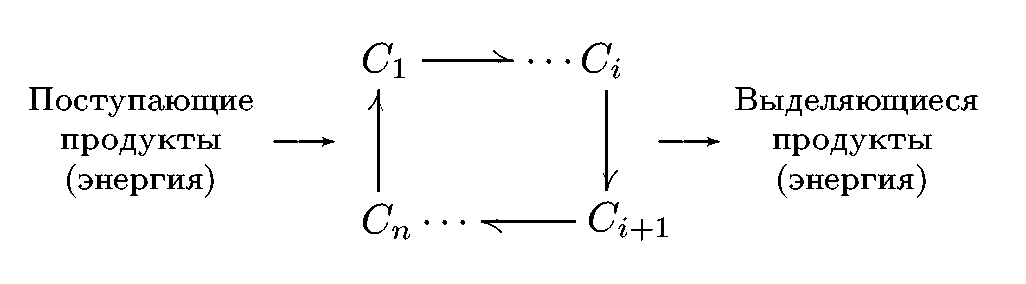
Увеличение энтропии, сопровождающее процессы, определяется изменением суммарного потенциала системы и внешней среды. После завершения цикла термодинамический потенциал системы возвращается в первоначальное состояние.
За малый отрезок времени скорость продуцирования энтропии обратно пропорциональна изменению термодинамического потенциала внешней среды:
![]()
Уравнение позволяет сравнивать разные циклы по их эффективности: при равных изменениях термодинамического потенциала среды, при t1 < t2, β1 > β2. Скорость диссипации энергии в первом цикле больше, чем при втором, при том же самом значении совершенной работы.
Большее значение диссипации энергии не означает несовершенство процесса, т.к. в живых системах идут сопряженные энергетические процессы.
9. Термодинамика систем вдали от равновесия.
Биосистемы находятся вдали от термодинамического равновесия, поэтому однозначных выводов о значениях величины β (изменение скорости энтропии) сделать нельзя. Поскольку многие метаболические процессы подчиняются законам химической кинетики понятие энтропии в отличие от равновесных систем не имеет решающего значения для предсказания поведения во времени.
Нелинейная термодинамика ищет ответы на вопрос, можно ли зная кинетические параметры системы реакций предсказать устойчивость системы, или возможность самопроизвольного перехода в другой стационарный режим при небольших возмущениях.
В неком устойчивом стационарном состоянии скорость химической реакции ν и химическое сродство А. При небольшом возмущении они станут равными:
ν* = v + δv, A* = A + δA, δv и δA – величины отклонений от стационарной точки по величинам v и А.
Произведение δv и δA должно быть положительным и обозначается как
β[δS] = δv . δA > 0
β[δS] – называется величиной избыточной продукции энтропии в возмущенном состоянии. Ее положительный характер соответствует тому, что система самопроизвольно возвращается из возмущенного состояния к первоначальному устойчивому стационарному состоянию.
Если величина β[δS] = δv . δA < 0, то исходное состояние не было устойчивым и поэтому, покинув его, система не вернется назад.
