
- •1.Предмет изучения и основное содержание биофизики.
- •2. Общие принципы описания кинетического поведения биологических систем, принцип узкого места, понятие фазовой траектории.
- •3. Качественное исследование простейших моделей биопроцессов. Поведение переменных на фазовой плоскости вблизи состояния равновесия.
- •4. Биологические триггеры. Фазовый портрет тригерной системы. Способы переключения стационарных состояний тригерной системы.
- •5. Колебательные процессы в биологии. Фазовый портрет автоколебательной системы.
- •6. Термодинамика систем вблизи равновесия. Первый и второй закон термодинамики. Живые системы.
- •Термодинамика живых систем
- •7. Второй закон термодинамики в открытых системах. Поддержание неравновесных состояний в бисистемах.
- •8. Теорема Пригожина
- •9. Термодинамика систем вдали от равновесия.
- •10. Энтропия, информация и биологическая упорядоченность.
- •11.Пространственная организация макромолекул.
- •Слабые невалентные взаимодействия в биологических системах.
- •13. Электронно-конформационные взаимодействия в макромолекулах
- •14. Спин электрона.
- •18. Механизмы переноса электрона и миграции энергии в биоструктурах.
- •19. Механизмы ферментативного катализа. Конформационные перестройки и высота барьера активации реакции
- •20. Молекулярная организация биологических мембран. Жидкомазаичная модель мембраны. Межмолекулярные взаимодействия в мембранах.
- •21. Механические и конформационные свойства мембран. Фазовые переходы биомембран.
19. Механизмы ферментативного катализа. Конформационные перестройки и высота барьера активации реакции
Ферменты обеспечивают высокую скорость реакций при оптимальных условиях, существующих в клетке, путём понижения уровня высоты энергетического барьера, в результате возрастает количество реакционно-способных молекул, следовательно, увеличивается скорость реакции.
В механизме ферментативного катализа образуются нестойкие промежуточные соединения - фермент-субстратные комплексы ES, подвергающийся превращению в нестабильный переходный комплекс ЕР, который почти мгновенно распадается на свободный фермент и продукт реакции.
В процессе взаимодействия фермента и субстрата образуется каталитически активная конформация активного центра. Предполагают, что при этом уменьшается высота барьера активации последующей реакции (рис. 3.23).
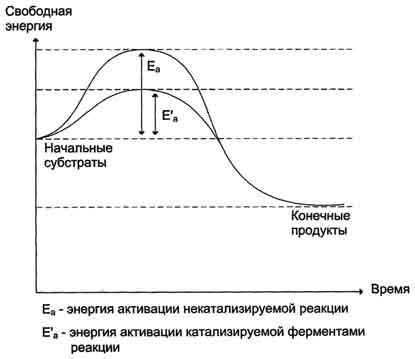
Рис. 3.23. Изменение свободной энергии в ходе химической реакции, некатализируемой и катализируемой ферментами
Появление продукта реакции рассматривается как результат электронно-конформационных взаимодействий в комплексе фермент – субстрат.
Изменение
электронного состояния и геометрии
активного центра происходит за времена
колебательной релаксации (10-12
– 10-13
с),
затем затрагивает большую часть белковой
глобулы. Химическое изменение субстрата,
включающее перегруппировку атомов
вслед за разрывом химических связей
реализуется, как часть конформационных
изменений макромолекулы. Комплекс
фермент – продукт распадается, активный
центр фермента восстанавливается, затем
медленно восстанавливается равновесное
конформационное состояние (рис. 3.24).
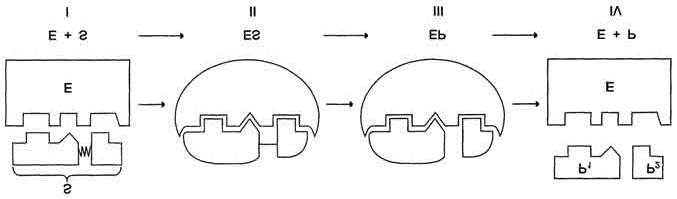
Рис. 3.24. Этапы ферментативного катализа:
I - этап сближения и ориентации субстрата относительно активного центра фермента; II - образование фермент-субстратного комплекса (ES) в результате индуцированного соответствия; III - деформация субстрата и образование нестабильного комплекса фермент-продукт (ЕР); IV- распад комплекса (ЕР) с высвобождением продуктов реакции из активного центра фермента и освобождением фермента.
Разность химических потенциалов субстрата и продукта определяет лишь число встреч молекул. Природа ферментативного катализа есть следствие электронно-конформационных взаимодействий в молекуле белка – фермента:
Сорбция субстрата приводит к переводу его молекулы из водной среды в окружение аминокислотных остатков в активном центре.
Диэлектрическая проницаемость в микросреде центра ниже, чем в воде, в результате усиливаются электростатические взаимодействия.
Малая подвижность диполей белка определяет снижение энергии реорганизации среды, и уменьшение энергии активации.
На величину энергии активации влияет также высокая локальная концентрация диполей пептидных связей, электростатический потенциал достигает нескольких десятков милливольт. При размерах центра 0,5-1,0 нм напряженность поля достигает порядка тысяч и сотен тысяч В/см.
Т.о. ориентированные полярные группы создают внутриглобулярное электрическое поле, в котором происходит перенос заряда, образуются нестабильные комплексы, перераспределяется электронная плотность, разрываются связи между атомами. Изменения зарядов приводят к определенным конформационным перестройкам, квыходу продуктов и регенерации фермента.
При многостадийном характере превращения субстрата происходят многоточечные взаимодействия между компонентами при снижении энергии активации.
Пример. Механизм кислотно-основного катализа на примере алкогольдегидрогеназы печени (рис. 3.25).
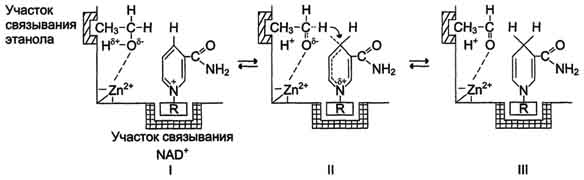
Рис. 3.25. Механизм кислотно-основного катализа на примере алкогольдегидрогеназы печени:
I - молекула этилового спирта имеет центр связывания, обеспечивающий гидрофобное взаимодействие активного центра и метильной группы спирта; II - положительно заряженный атом цинка способствует отщеплению протона от спиртовой группы этанола с образованием отрицательно заряженного атома кислорода. Отрицательный заряд перераспределяется между атомом кислорода и соседним атомом водорода, который затем в виде гидритиона переносится на четвёртый углеродный атом никотинамида кофермента NAD+; III - в результате формируется восстановленная форма NADH и уксусный альдегид.
