
- •1.Предмет физическая химия. Общеприкладное значение физической и коллоидной химии.
- •2.Газообразное состояние. Газ как рабочее тело, его параметры состояния. Идеальный газ.
- •3.Газовые законы, их математическое и графическое выражение. Закон
- •4.Уравнение состояния идеального газа (уравнение Клапейрона - Менделеева). Универсальная газовая постоянная, её физический смысл, численное значение и размерность
- •5. Отклонения реальных газов от идеальных. Причины этих отклонений. Уравнение состояния реальных газов.
- •6. Критическое состояние. Коэффициент сжимаемости. Сжижение газов.
- •7. Газовые смеси, способы выражения состава смесей. Закон Дальтона. Правило аддитивности.
- •8. Общая характеристика жидкого состояния. Современные взгляды на структуру жидкостей. Ассоциация.
- •9.Вязкость. Ее физическая сущность, зависимость от различных факторов. Формула Ньютона. Роль вязкости в химической технологии .
- •10. Измерение вязкости жидкостей с помощью вискозиметра.
- •11. Поверхностное натяжение жидкостей. Поверхностно-активные и поверхностно-неактивные вещества, их практическое значение.
- •12. Измерение поверхностного натяжения жидкостей с помощью сталагмометра.
- •12. Процессы парообразования и испарения. Мольная теплота испарения
- •13. Твердое состояние. Тела кристаллические и аморфные. Общая характеристика кристаллического состояния.
- •15. Плазма: общая характеристика.
- •16. Предмет термодинамики, ее основные понятия и определения. Значение термодинамики в химико-технологических процессах.
- •Частные случаи первого закона термодинамики для изопроцессов
- •18 Аналитическое выражение первого закона термодинамики, в том числе для изобарных и изохорных процессов.
- •20. Теплоемкость: ее общая характеристика. Виды теплоемкости, их взаимосвязь, зависимость от различных факторов.
- •21. Работа расширения в термодинамических процессах. Связь работы расширения и первого закона термодинамики.
- •22. Термохимия. Тепловой эффект химической реакции. Изохорный и изобарный тепловой эффект. Взаимосвязь между ними.
- •23. Термохимические уравнения. Теплоты образования (разложения), сгорания. Закон Гесса и следствия из него. Значение закона Гесса
- •24. Определение теплоты растворения соли.
- •25. Недостаточность первого закона термодинамики. Качественная неэквивалентность теплоты и работы.
- •26. Содержание и формулировки второго закона термодинамики, его физическая сущность.
- •27. Основной термодинамический цикл - цикл Карно, его кпд
- •28. Энтропия: физический смысл, значение, характеристика.
- •29. Свободная энергия системы. Изобарно-изотермический и изохорно-изотермический потенциалы (энергии Гиббса и Гельмгольца). Пределы протекания самопроизвольных процессов в изолированных системах.
- •30. Характеристика влажного, сухого насыщенного и перегретого паров
- •31. Скорость химической реакции. Графическая зависимость скорости реакции от времени. Основной закон химической кинетики - закон действия масс.
- •Факторы, влияющие на скорость химических реакций.
- •1. Природа реагирующих веществ
- •32. Константа скорости реакции, ее физический смысл.
- •33. Факторы, влияющие на скорость реакции. Правило Вант-Гоффа.
- •34. Классификация реакций по молекулярности и порядку реакции. Период полураспада.
- •35. Вывести кинетическое уравнение реакции 1 порядка.
- •36. Энергия активации и её физический смысл (привести рисунок и пояснить).
- •37. Что такое активация? Методы активации молекул.
- •38. Уравнение Аррениуса и его практическое применение.
- •39. Цепные реакции, их особенности, характеристика.
- •40. Механизм цепной неразветвленной реакции.
- •41. Поверхностные явления и адсорбция. Количественная характеристика адсорбции, её виды.
- •42. Адсорбция на поверхности твердого тела. Изотерма адсорбции.
- •43. Уравнение Фрейндлиха и Ленгмюра.
- •44. Построение изотермы адсорбции по экспериментальным данным
- •45 Катализ и автокатализ. Положительный и отрицательный катализ.
- •46.Гомогенный и гетерогенный катализ. Специфичность каталитических реакций.
- •47. Химическое равновесие. Обратимые и необратимые реакции. Закон действующих масс.
- •48. Вывести константу равновесия Кс и Кр для гомогенной реакции. Константа равновесия реакций в гетерогенных системах
- •49. Сформулировать принцип Ле Шателье и пояснить его на конкретных примерах.
- •50. Химическое сродство. Уравнение изотермы химической реакции и его практическое применение для определения направления процесса.
- •51. Уравнение изохоры, изобары и его практическое применение для определения смещения равновесия при изменении внешних условий.
- •52. Фаза, компонент, число степеней свободы. Правило фаз Гиббса.
- •53. Термический анализ, построение диаграммы плавкости по кривым охлаждения
- •54. Привести диаграмму состояния воды и разобрать её с точки зрения правила фаз.
- •56. Гидратная теория растворов Менделеева
- •57. Осмос. Закон Вант-Гоффа для неэлектролитов и электролитов.
- •58. Равновесие в системе "раствор-пар". Первый закон Рауля.
- •59. Условия кипения и замерзания растворов. Второй закон Рауля.
- •60. Определение молекулярной массы вещества криоскопичечским методом
- •61. Взаимная растворимость жидкостей. Идеальные смеси. Закон Рауля-Дальтона. Диаграмма «Давление насыщенного пара – состав жидкости»
- •62. Первый закон Коновалова, его графическое изображение .Перегонка жидких смесей, подчиняющихся этому закону.
- •63. Второй закон Коновалова, его графическое изображение. Перегонка жидких смесей, подчиняющихся этому закону.
- •64. Что такое азеотроп и как его разделить.
- •65. Закон распределения. Экстракция из растворов /привести формулу и пояснить/.
- •66. Взаимные превращения электрической и химической энергий. Электрохимия, её прикладное значение.
- •67 Электрическая проводимость растворов. Измерение электропроводности растворов.
- •68. Удельная и эквивалентная электропроводности. Их взаимосвязь.
- •69. Электродные процессы. Скачок потенциала на границе металл - раствор. Электродный потенциал. Формула Нернста.
- •70. Электрохимический ряд напряжений. Эдс и принцип работы гальванического элемента
- •71. Водородный электрод.
- •72. Определение эдс элемента компенсационным методом
- •74. Методы получения коллоидных растворов
- •75. Строение коллоидных мицелл.
- •76. Устойчивость коллоидных растворов. Коагуляция.
- •77. Оптические свойства коллоидных растворов.
- •78. Кинетические и электрокинетические свойства коллоидных растворов.
- •79. Эмульсии. Получение эмульсий, их типы. Обращение фаз эмульсий. Деэмульгирование.
- •80 Пены, аэрозоли.
- •81 Общая характеристика растворов вмс. Определение молекулярной массы вмс.
69. Электродные процессы. Скачок потенциала на границе металл - раствор. Электродный потенциал. Формула Нернста.
Электродные процессы – процессы, связанные с переносом зарядов через границу между электродом и раствором. Катодные процессы связаны с восстановлением молекул или ионов реагирующего вещества, анодные – с окислением реагирующего вещества и с растворением металла электрода.
Электродным потенциалом
![]() называется
величина, равная ЭДС гальванического
элемента, составленногоиз данного
электрода и стандартного водородного
электрода.
называется
величина, равная ЭДС гальванического
элемента, составленногоиз данного
электрода и стандартного водородного
электрода.
ЭДС электрохимического элемента равна разности электродных потенциалов:
Е = 1 - 2
Электродный потенциал электрода считается положительным, если в гальваническом элементе со стандартным водородным электродом данный электрод является катодом, и отрицательным - если анодом.
Формула Нернста
![]() ,
,
где
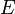 —
электродный потенциал,
—
электродный потенциал,
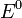 —
стандартный электродный потенциал,
измеряется в вольтах;
—
стандартный электродный потенциал,
измеряется в вольтах;— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— абсолютная температура;
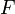 —
постоянная
Фарадея,
равная 96485,35 Кл·моль−1;
—
постоянная
Фарадея,
равная 96485,35 Кл·моль−1;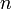 —
число моль
электронов,
участвующих в процессе;
—
число моль
электронов,
участвующих в процессе;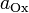 и
и
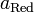 —
активности
соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.
—
активности
соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.
Если в формулу Нернста
подставить числовые значения констант
и
и
перейти от натуральных
логарифмов
к десятичным,
то при
![]() получим
получим
![]()
70. Электрохимический ряд напряжений. Эдс и принцип работы гальванического элемента
Электрохимический ряд напряжений, последовательность расположения электродов в порядке возрастания их стандартных электродных потенциалов. Электрохимический ряд напряжений позволяет судить о термодинамической возможности протекания тех или иных электродных процессов.
Гальвани́ческий элеме́нт — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. ЭДС гальванического элемента зависит от материала электродов и состава электролита.
71. Водородный электрод.
Водородный электрод, платиновая пластинка, электролитически покрытая платиновой чернью, погружённая в раствор кислоты с определённой концентрацией ионов водорода Н+ и омываемая током газообразного водорода. Потенциал водородного электрода возникает за счёт обратимо протекающей реакции
Между водородом, адсорбированным платиновой чернью, и ионами водорода в растворе устанавливается равновесие. Потенциал электрода Е определяется уравнением Нернста:
![]()
где Т — абсолютная температура (К), аН+ — активная концентрация ионов водорода (г-ион/л), р — давление водорода [кгс/см2 (атм)], Е° — нормальный (или стандартный) потенциал водородного электрода при р = 1 кгс/см2 (1 атм) и aH+ = 1. При любой заданной температуре Е° условно принято считать равным нулю.
72. Определение эдс элемента компенсационным методом
Компенсационными называют методы измерения электрических величин, в которых с помощью индикаторного прибора устанавливается равенство потенциалов, создаваемых двумя независимыми источниками ЭДС. Компенсационные методы измерений применяют не только для измерения электрических величин (ЭДС, напряжений, токов, сопротивлений), но и для измерения других физических величин (механических, световых, температуры и т. д.), которые обычно предварительно преобразуется в электрические.
73. Дисперсные системы. Основные признаки дисперсных систем, их классификация.
Диспе́рсная систе́ма — это образования из двух или более фаз (тел), которые совершенно или практически не смешиваются и не реагируют друг с другом химически. Первое из веществ (дисперсная фаза) мелко распределено во втором (дисперсионная среда). Если фаз несколько, их можно отделить друг от друга физическим способом (центрифугировать, сепарировать и т. д.).
Классификация по степени дисперсности
- грубодисперсные системы, d≥10^(-3) см.
- микрогетерогенные системы, 10^(-5 )≤ d ≤ 10^(-3) см.
- коллоидно-дисперсные системы или коллоидные растворы, 10^(-7)≤ d ≤ 10^(-5) см.
Классификация по степени взаимодействия частиц дисперсной фазы.
Согласно этой классификации, дисперсные системы разделяются по кинетическим свойствам на два класса:
- Свободнодисперсные, в которых частицы дисперсной фазы не связаны между собой и могут свободно перемещаться.
- Связнодисперсные, в которых одна из фаз структурно закреплена и не может перемещаться свободно..
4) Классификация по взаимодействию дисперсной фазы и дисперсионной среды
Эта классификация пригодна только для систем с жидкой дисперсионной средой:
- лиофобные. сильно взаимодействовуют
- лиофильные. слабо взаимодействует
