
- •1.Предмет физическая химия. Общеприкладное значение физической и коллоидной химии.
- •2.Газообразное состояние. Газ как рабочее тело, его параметры состояния. Идеальный газ.
- •3.Газовые законы, их математическое и графическое выражение. Закон
- •4.Уравнение состояния идеального газа (уравнение Клапейрона - Менделеева). Универсальная газовая постоянная, её физический смысл, численное значение и размерность
- •5. Отклонения реальных газов от идеальных. Причины этих отклонений. Уравнение состояния реальных газов.
- •6. Критическое состояние. Коэффициент сжимаемости. Сжижение газов.
- •7. Газовые смеси, способы выражения состава смесей. Закон Дальтона. Правило аддитивности.
- •8. Общая характеристика жидкого состояния. Современные взгляды на структуру жидкостей. Ассоциация.
- •9.Вязкость. Ее физическая сущность, зависимость от различных факторов. Формула Ньютона. Роль вязкости в химической технологии .
- •10. Измерение вязкости жидкостей с помощью вискозиметра.
- •11. Поверхностное натяжение жидкостей. Поверхностно-активные и поверхностно-неактивные вещества, их практическое значение.
- •12. Измерение поверхностного натяжения жидкостей с помощью сталагмометра.
- •12. Процессы парообразования и испарения. Мольная теплота испарения
- •13. Твердое состояние. Тела кристаллические и аморфные. Общая характеристика кристаллического состояния.
- •15. Плазма: общая характеристика.
- •16. Предмет термодинамики, ее основные понятия и определения. Значение термодинамики в химико-технологических процессах.
- •Частные случаи первого закона термодинамики для изопроцессов
- •18 Аналитическое выражение первого закона термодинамики, в том числе для изобарных и изохорных процессов.
- •20. Теплоемкость: ее общая характеристика. Виды теплоемкости, их взаимосвязь, зависимость от различных факторов.
- •21. Работа расширения в термодинамических процессах. Связь работы расширения и первого закона термодинамики.
- •22. Термохимия. Тепловой эффект химической реакции. Изохорный и изобарный тепловой эффект. Взаимосвязь между ними.
- •23. Термохимические уравнения. Теплоты образования (разложения), сгорания. Закон Гесса и следствия из него. Значение закона Гесса
- •24. Определение теплоты растворения соли.
- •25. Недостаточность первого закона термодинамики. Качественная неэквивалентность теплоты и работы.
- •26. Содержание и формулировки второго закона термодинамики, его физическая сущность.
- •27. Основной термодинамический цикл - цикл Карно, его кпд
- •28. Энтропия: физический смысл, значение, характеристика.
- •29. Свободная энергия системы. Изобарно-изотермический и изохорно-изотермический потенциалы (энергии Гиббса и Гельмгольца). Пределы протекания самопроизвольных процессов в изолированных системах.
- •30. Характеристика влажного, сухого насыщенного и перегретого паров
- •31. Скорость химической реакции. Графическая зависимость скорости реакции от времени. Основной закон химической кинетики - закон действия масс.
- •Факторы, влияющие на скорость химических реакций.
- •1. Природа реагирующих веществ
- •32. Константа скорости реакции, ее физический смысл.
- •33. Факторы, влияющие на скорость реакции. Правило Вант-Гоффа.
- •34. Классификация реакций по молекулярности и порядку реакции. Период полураспада.
- •35. Вывести кинетическое уравнение реакции 1 порядка.
- •36. Энергия активации и её физический смысл (привести рисунок и пояснить).
- •37. Что такое активация? Методы активации молекул.
- •38. Уравнение Аррениуса и его практическое применение.
- •39. Цепные реакции, их особенности, характеристика.
- •40. Механизм цепной неразветвленной реакции.
- •41. Поверхностные явления и адсорбция. Количественная характеристика адсорбции, её виды.
- •42. Адсорбция на поверхности твердого тела. Изотерма адсорбции.
- •43. Уравнение Фрейндлиха и Ленгмюра.
- •44. Построение изотермы адсорбции по экспериментальным данным
- •45 Катализ и автокатализ. Положительный и отрицательный катализ.
- •46.Гомогенный и гетерогенный катализ. Специфичность каталитических реакций.
- •47. Химическое равновесие. Обратимые и необратимые реакции. Закон действующих масс.
- •48. Вывести константу равновесия Кс и Кр для гомогенной реакции. Константа равновесия реакций в гетерогенных системах
- •49. Сформулировать принцип Ле Шателье и пояснить его на конкретных примерах.
- •50. Химическое сродство. Уравнение изотермы химической реакции и его практическое применение для определения направления процесса.
- •51. Уравнение изохоры, изобары и его практическое применение для определения смещения равновесия при изменении внешних условий.
- •52. Фаза, компонент, число степеней свободы. Правило фаз Гиббса.
- •53. Термический анализ, построение диаграммы плавкости по кривым охлаждения
- •54. Привести диаграмму состояния воды и разобрать её с точки зрения правила фаз.
- •56. Гидратная теория растворов Менделеева
- •57. Осмос. Закон Вант-Гоффа для неэлектролитов и электролитов.
- •58. Равновесие в системе "раствор-пар". Первый закон Рауля.
- •59. Условия кипения и замерзания растворов. Второй закон Рауля.
- •60. Определение молекулярной массы вещества криоскопичечским методом
- •61. Взаимная растворимость жидкостей. Идеальные смеси. Закон Рауля-Дальтона. Диаграмма «Давление насыщенного пара – состав жидкости»
- •62. Первый закон Коновалова, его графическое изображение .Перегонка жидких смесей, подчиняющихся этому закону.
- •63. Второй закон Коновалова, его графическое изображение. Перегонка жидких смесей, подчиняющихся этому закону.
- •64. Что такое азеотроп и как его разделить.
- •65. Закон распределения. Экстракция из растворов /привести формулу и пояснить/.
- •66. Взаимные превращения электрической и химической энергий. Электрохимия, её прикладное значение.
- •67 Электрическая проводимость растворов. Измерение электропроводности растворов.
- •68. Удельная и эквивалентная электропроводности. Их взаимосвязь.
- •69. Электродные процессы. Скачок потенциала на границе металл - раствор. Электродный потенциал. Формула Нернста.
- •70. Электрохимический ряд напряжений. Эдс и принцип работы гальванического элемента
- •71. Водородный электрод.
- •72. Определение эдс элемента компенсационным методом
- •74. Методы получения коллоидных растворов
- •75. Строение коллоидных мицелл.
- •76. Устойчивость коллоидных растворов. Коагуляция.
- •77. Оптические свойства коллоидных растворов.
- •78. Кинетические и электрокинетические свойства коллоидных растворов.
- •79. Эмульсии. Получение эмульсий, их типы. Обращение фаз эмульсий. Деэмульгирование.
- •80 Пены, аэрозоли.
- •81 Общая характеристика растворов вмс. Определение молекулярной массы вмс.
66. Взаимные превращения электрической и химической энергий. Электрохимия, её прикладное значение.
Электрохимия- изучает процессы взамного превращения электрич. и химичес. энергии. Превращения хим. энергии в электрич. происходит в гальванических элементах (батареи), а электрической энергии в химическую в электролизах.
Электрическая проводимость в растворах электролитов. К проводникам второго рода относятся растворы и расплавы электролитов.
При наложении электр. поля катионы перемещается к катоду, анионы к аноду. При этом скорость движения ионов зависит от факторов: велечина зарядов иона, радиус иона, температура, напряженность электр. поля.
67 Электрическая проводимость растворов. Измерение электропроводности растворов.
Электри́ческая проводи́мость (электропроводность, проводимость) — это способность тела проводить электрический ток, а также физическая величина, характеризующая эту способность и обратная электрическому сопротивлению. В СИ единицей измерения электрической проводимости является сименс. Для измерения электрической проводимости раствора прибегают к измерению его сопротивления. Раствор помещают в специальный сосуд, имеющий два металлических электрода. Измерение может быть проведено как с помощью постоянного, так и с помощью переменного тока.
Электропроводность электролитов обычно определяется при помощи мостовой схемы, используемой для измерения сопротивления проводника первого рода. В случае растворов электролитов применяются мосты, работающие на переменном токе, так как прохождение постоянного тока через растворы приводит к значительным ошибкам, связанным с явлениями электролиза и поляризации.
Основой установки для определения электропроводности раствора электролита служит мост Уитстона, образованный контуром из четырех сопротивлений. На одну из диагональ моста подается питание от генератора синусоидального напряжения, а на другой диагонали регистрируется сигнал так называемым индикатором нуля, в качестве которого обычно применят осциллограф.
68. Удельная и эквивалентная электропроводности. Их взаимосвязь.
У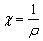 дельной
электропроводностью
называется электропроводность раствора,
заключенного между электродами с
поперечным сечением в 1см2
и находящимися на расстоянии 1 см друг
от друга. Удельная электропроводность
χ
(каппа) равна величине, обратной удельному
сопротивлению
дельной
электропроводностью
называется электропроводность раствора,
заключенного между электродами с
поперечным сечением в 1см2
и находящимися на расстоянии 1 см друг
от друга. Удельная электропроводность
χ
(каппа) равна величине, обратной удельному
сопротивлению
![]() ,
т.е. сопротивлению 1см3
проводника:
,
т.е. сопротивлению 1см3
проводника:
[ом-1 см-1 ]
Удельную электропроводность исследуемого раствора вычисляют по уравнению:
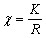
Поскольку в растворах электролитов электричество переносится ионами, то удельная электропроводность зависит от концентрации и заряда ионов, скоростей их движения в электрическом поле и температуры.
Эквивалентной электропроводностью называется электропро-водность раствора, заключенного между электродами, находящимися на расстоянии 1 см друг от друга и с такой большой поверхностью, что между электродами помещается раствор, содержащий 1 г-экв растворенного вещества.
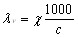 [ом-1•см2/2
–
экв]
[ом-1•см2/2
–
экв]
где С – концентрация раствора в г-экв/л.
Для сильных электролитов увеличение эквивалентной электропроводности с разбавлением связано с уменьшением межионного взаимодействия, для слабых электролитов оно связано в основном с увеличением степени диссоциации.
По измеренным сопротивлениям для каждой из концентраций вычисляют удельную электропроводность, эквивалентную электропроводность, а затем вычисляют степень диссоциации по уравнению:
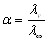
 -
вычисляют по закону Кольрауша
-
вычисляют по закону Кольрауша
