
- •1.Предмет физическая химия. Общеприкладное значение физической и коллоидной химии.
- •2.Газообразное состояние. Газ как рабочее тело, его параметры состояния. Идеальный газ.
- •3.Газовые законы, их математическое и графическое выражение. Закон
- •4.Уравнение состояния идеального газа (уравнение Клапейрона - Менделеева). Универсальная газовая постоянная, её физический смысл, численное значение и размерность
- •5. Отклонения реальных газов от идеальных. Причины этих отклонений. Уравнение состояния реальных газов.
- •6. Критическое состояние. Коэффициент сжимаемости. Сжижение газов.
- •7. Газовые смеси, способы выражения состава смесей. Закон Дальтона. Правило аддитивности.
- •8. Общая характеристика жидкого состояния. Современные взгляды на структуру жидкостей. Ассоциация.
- •9.Вязкость. Ее физическая сущность, зависимость от различных факторов. Формула Ньютона. Роль вязкости в химической технологии .
- •10. Измерение вязкости жидкостей с помощью вискозиметра.
- •11. Поверхностное натяжение жидкостей. Поверхностно-активные и поверхностно-неактивные вещества, их практическое значение.
- •12. Измерение поверхностного натяжения жидкостей с помощью сталагмометра.
- •12. Процессы парообразования и испарения. Мольная теплота испарения
- •13. Твердое состояние. Тела кристаллические и аморфные. Общая характеристика кристаллического состояния.
- •15. Плазма: общая характеристика.
- •16. Предмет термодинамики, ее основные понятия и определения. Значение термодинамики в химико-технологических процессах.
- •Частные случаи первого закона термодинамики для изопроцессов
- •18 Аналитическое выражение первого закона термодинамики, в том числе для изобарных и изохорных процессов.
- •20. Теплоемкость: ее общая характеристика. Виды теплоемкости, их взаимосвязь, зависимость от различных факторов.
- •21. Работа расширения в термодинамических процессах. Связь работы расширения и первого закона термодинамики.
- •22. Термохимия. Тепловой эффект химической реакции. Изохорный и изобарный тепловой эффект. Взаимосвязь между ними.
- •23. Термохимические уравнения. Теплоты образования (разложения), сгорания. Закон Гесса и следствия из него. Значение закона Гесса
- •24. Определение теплоты растворения соли.
- •25. Недостаточность первого закона термодинамики. Качественная неэквивалентность теплоты и работы.
- •26. Содержание и формулировки второго закона термодинамики, его физическая сущность.
- •27. Основной термодинамический цикл - цикл Карно, его кпд
- •28. Энтропия: физический смысл, значение, характеристика.
- •29. Свободная энергия системы. Изобарно-изотермический и изохорно-изотермический потенциалы (энергии Гиббса и Гельмгольца). Пределы протекания самопроизвольных процессов в изолированных системах.
- •30. Характеристика влажного, сухого насыщенного и перегретого паров
- •31. Скорость химической реакции. Графическая зависимость скорости реакции от времени. Основной закон химической кинетики - закон действия масс.
- •Факторы, влияющие на скорость химических реакций.
- •1. Природа реагирующих веществ
- •32. Константа скорости реакции, ее физический смысл.
- •33. Факторы, влияющие на скорость реакции. Правило Вант-Гоффа.
- •34. Классификация реакций по молекулярности и порядку реакции. Период полураспада.
- •35. Вывести кинетическое уравнение реакции 1 порядка.
- •36. Энергия активации и её физический смысл (привести рисунок и пояснить).
- •37. Что такое активация? Методы активации молекул.
- •38. Уравнение Аррениуса и его практическое применение.
- •39. Цепные реакции, их особенности, характеристика.
- •40. Механизм цепной неразветвленной реакции.
- •41. Поверхностные явления и адсорбция. Количественная характеристика адсорбции, её виды.
- •42. Адсорбция на поверхности твердого тела. Изотерма адсорбции.
- •43. Уравнение Фрейндлиха и Ленгмюра.
- •44. Построение изотермы адсорбции по экспериментальным данным
- •45 Катализ и автокатализ. Положительный и отрицательный катализ.
- •46.Гомогенный и гетерогенный катализ. Специфичность каталитических реакций.
- •47. Химическое равновесие. Обратимые и необратимые реакции. Закон действующих масс.
- •48. Вывести константу равновесия Кс и Кр для гомогенной реакции. Константа равновесия реакций в гетерогенных системах
- •49. Сформулировать принцип Ле Шателье и пояснить его на конкретных примерах.
- •50. Химическое сродство. Уравнение изотермы химической реакции и его практическое применение для определения направления процесса.
- •51. Уравнение изохоры, изобары и его практическое применение для определения смещения равновесия при изменении внешних условий.
- •52. Фаза, компонент, число степеней свободы. Правило фаз Гиббса.
- •53. Термический анализ, построение диаграммы плавкости по кривым охлаждения
- •54. Привести диаграмму состояния воды и разобрать её с точки зрения правила фаз.
- •56. Гидратная теория растворов Менделеева
- •57. Осмос. Закон Вант-Гоффа для неэлектролитов и электролитов.
- •58. Равновесие в системе "раствор-пар". Первый закон Рауля.
- •59. Условия кипения и замерзания растворов. Второй закон Рауля.
- •60. Определение молекулярной массы вещества криоскопичечским методом
- •61. Взаимная растворимость жидкостей. Идеальные смеси. Закон Рауля-Дальтона. Диаграмма «Давление насыщенного пара – состав жидкости»
- •62. Первый закон Коновалова, его графическое изображение .Перегонка жидких смесей, подчиняющихся этому закону.
- •63. Второй закон Коновалова, его графическое изображение. Перегонка жидких смесей, подчиняющихся этому закону.
- •64. Что такое азеотроп и как его разделить.
- •65. Закон распределения. Экстракция из растворов /привести формулу и пояснить/.
- •66. Взаимные превращения электрической и химической энергий. Электрохимия, её прикладное значение.
- •67 Электрическая проводимость растворов. Измерение электропроводности растворов.
- •68. Удельная и эквивалентная электропроводности. Их взаимосвязь.
- •69. Электродные процессы. Скачок потенциала на границе металл - раствор. Электродный потенциал. Формула Нернста.
- •70. Электрохимический ряд напряжений. Эдс и принцип работы гальванического элемента
- •71. Водородный электрод.
- •72. Определение эдс элемента компенсационным методом
- •74. Методы получения коллоидных растворов
- •75. Строение коллоидных мицелл.
- •76. Устойчивость коллоидных растворов. Коагуляция.
- •77. Оптические свойства коллоидных растворов.
- •78. Кинетические и электрокинетические свойства коллоидных растворов.
- •79. Эмульсии. Получение эмульсий, их типы. Обращение фаз эмульсий. Деэмульгирование.
- •80 Пены, аэрозоли.
- •81 Общая характеристика растворов вмс. Определение молекулярной массы вмс.
61. Взаимная растворимость жидкостей. Идеальные смеси. Закон Рауля-Дальтона. Диаграмма «Давление насыщенного пара – состав жидкости»
РАСТВОРИМОСТЬ ЖИДКОСТЕЙ — степень взаимной растворимости жидкостей. Некоторые жидкости могут неограниченно растворяться в других жидкостях, т. е. смешиваются друг с другом в любых пропорциях, напр., спирт и вода. Др. взаимно растворяются лишь до определенного предела (напр., при взбалтывании эфира с водой образуется 2 слоя: верхний — насыщенный раствор воды в эфире, а нижний — насыщенный раствор эфира в воде).
Закон Дальтона. Общее давление над жидкой смесью равно сумме парциальных давлений компонентов.
Робщ=РA +РВ. В случае образования систем состоящих из растворимых жидкостей, при этом без протекания каких либо побочных процессов, получают идеальные растворы для которых применим Закон Рауля. Таким образом получим уравнение Рауля-Дальтона. Робщ=РA 0 NA +РВ0 NВ
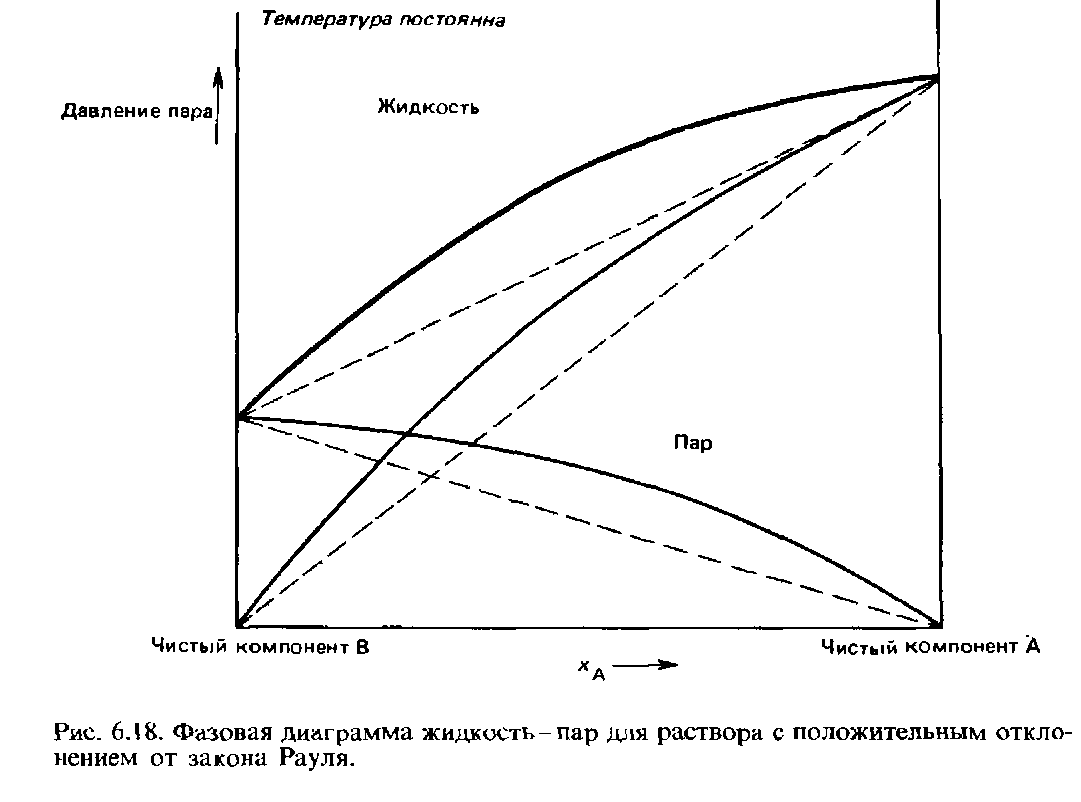
62. Первый закон Коновалова, его графическое изображение .Перегонка жидких смесей, подчиняющихся этому закону.
П ервый
закон Коновалова описывает процесс
фракционной перегонки:
ервый
закон Коновалова описывает процесс
фракционной перегонки:
насыщенный пар по сравнению с равновесным раствором обогащён компонентом, добавление которого к системе повышает общее давление пара
Рассмотрим фазовую диаграмму при постоянном давлении для бинарной системы в координатах состав — температура:
При нагревании исходной смеси состава Х1 кипение начнётся в точке а1. При этом состав первых порций пара соответствует точке b1. При конденсации этого пара образуется смесь состава Х2, в которой доля компонента А выше, по сравнению с исходной смесью. Нагрев этой смеси приведёт к получению конденсата состава Х3 и так далее, вплоть до выделения чистого компонента А. Отметим, что при кипении смеси состава Х1 состав жидкости будет обогащаться компонентом В, соответственно температура кипящей жидкости будет повышаться до тех пор, пока в жидкости не останется только компонент В. Последовательные перегонки в промышленных условиях объединены в один автоматизированный процесс в дефлегмационных и ректификационных колоннах.
63. Второй закон Коновалова, его графическое изображение. Перегонка жидких смесей, подчиняющихся этому закону.
Второй закон Коновалова (1881 г.) описывает растворы с отклонениями от свойств идеальных растворов и объясняет существование азеотропных растворов, состав которых при перегонке не изменяется:
Э
 кстремумы
на кривых полного давления пара отвечают
такому равновесию раствора и насыщенного
пара, при котором состав обеих фаз
одинаков
кстремумы
на кривых полного давления пара отвечают
такому равновесию раствора и насыщенного
пара, при котором состав обеих фаз
одинаков
64. Что такое азеотроп и как его разделить.
Азеотропная смесь — смесь двух или более жидкостей, состав которой не меняется при кипении, то есть смесь с равенством составов равновесных жидкой и паровой фаз. Для разделения азеотропных смесей используют различные технологии: Удаление одного из компонентов за счёт адсорбции на твёрдом пористом материале. Разделение на пористых мембранах Первапорация на непористых мембранах
65. Закон распределения. Экстракция из растворов /привести формулу и пояснить/.
Закон распределения.
Если какое-либо вещество растворимо в двух несмешивающихся жидкостях, то при его растворении в смеси двух таких жидкостей оно распределяется между ними в отношении, определяемом законом Нернста-Шилова:
Растворяемое вещество распределяется между двумя несмешивающимися жидкостями в постоянном отношении концентраций, не зависящем от количества добавляемого растворимого вещества.
K = C1/C2 (1), где С1 и С2 – концентрации вещества в 1-м и 2-м растворителях.
Закон выполняется при постоянной температуре, достаточном разбавлении растворов, при отсутствии взаимодействия растворенного вещества с растворителем.
В реальных условиях при растворении веществ происходят процессы ассоциации и диссоциации молекул растворяемого вещества.
Экстракцией называют метод извлечения растворителями из смеси каких-либо веществ того или другого компонента. В основе этого метода лежат закон распределения вещества, между двумя несмешивающимися жидкостями (если экстрагируют вещество из раствора в какой-нибудь жидкости) и различная растворимость отдельных веществ в данном растворителе (если вещество извлекают из смеси с другими веществами) .
