
- •1.Предмет физическая химия. Общеприкладное значение физической и коллоидной химии.
- •2.Газообразное состояние. Газ как рабочее тело, его параметры состояния. Идеальный газ.
- •3.Газовые законы, их математическое и графическое выражение. Закон
- •4.Уравнение состояния идеального газа (уравнение Клапейрона - Менделеева). Универсальная газовая постоянная, её физический смысл, численное значение и размерность
- •5. Отклонения реальных газов от идеальных. Причины этих отклонений. Уравнение состояния реальных газов.
- •6. Критическое состояние. Коэффициент сжимаемости. Сжижение газов.
- •7. Газовые смеси, способы выражения состава смесей. Закон Дальтона. Правило аддитивности.
- •8. Общая характеристика жидкого состояния. Современные взгляды на структуру жидкостей. Ассоциация.
- •9.Вязкость. Ее физическая сущность, зависимость от различных факторов. Формула Ньютона. Роль вязкости в химической технологии .
- •10. Измерение вязкости жидкостей с помощью вискозиметра.
- •11. Поверхностное натяжение жидкостей. Поверхностно-активные и поверхностно-неактивные вещества, их практическое значение.
- •12. Измерение поверхностного натяжения жидкостей с помощью сталагмометра.
- •12. Процессы парообразования и испарения. Мольная теплота испарения
- •13. Твердое состояние. Тела кристаллические и аморфные. Общая характеристика кристаллического состояния.
- •15. Плазма: общая характеристика.
- •16. Предмет термодинамики, ее основные понятия и определения. Значение термодинамики в химико-технологических процессах.
- •Частные случаи первого закона термодинамики для изопроцессов
- •18 Аналитическое выражение первого закона термодинамики, в том числе для изобарных и изохорных процессов.
- •20. Теплоемкость: ее общая характеристика. Виды теплоемкости, их взаимосвязь, зависимость от различных факторов.
- •21. Работа расширения в термодинамических процессах. Связь работы расширения и первого закона термодинамики.
- •22. Термохимия. Тепловой эффект химической реакции. Изохорный и изобарный тепловой эффект. Взаимосвязь между ними.
- •23. Термохимические уравнения. Теплоты образования (разложения), сгорания. Закон Гесса и следствия из него. Значение закона Гесса
- •24. Определение теплоты растворения соли.
- •25. Недостаточность первого закона термодинамики. Качественная неэквивалентность теплоты и работы.
- •26. Содержание и формулировки второго закона термодинамики, его физическая сущность.
- •27. Основной термодинамический цикл - цикл Карно, его кпд
- •28. Энтропия: физический смысл, значение, характеристика.
- •29. Свободная энергия системы. Изобарно-изотермический и изохорно-изотермический потенциалы (энергии Гиббса и Гельмгольца). Пределы протекания самопроизвольных процессов в изолированных системах.
- •30. Характеристика влажного, сухого насыщенного и перегретого паров
- •31. Скорость химической реакции. Графическая зависимость скорости реакции от времени. Основной закон химической кинетики - закон действия масс.
- •Факторы, влияющие на скорость химических реакций.
- •1. Природа реагирующих веществ
- •32. Константа скорости реакции, ее физический смысл.
- •33. Факторы, влияющие на скорость реакции. Правило Вант-Гоффа.
- •34. Классификация реакций по молекулярности и порядку реакции. Период полураспада.
- •35. Вывести кинетическое уравнение реакции 1 порядка.
- •36. Энергия активации и её физический смысл (привести рисунок и пояснить).
- •37. Что такое активация? Методы активации молекул.
- •38. Уравнение Аррениуса и его практическое применение.
- •39. Цепные реакции, их особенности, характеристика.
- •40. Механизм цепной неразветвленной реакции.
- •41. Поверхностные явления и адсорбция. Количественная характеристика адсорбции, её виды.
- •42. Адсорбция на поверхности твердого тела. Изотерма адсорбции.
- •43. Уравнение Фрейндлиха и Ленгмюра.
- •44. Построение изотермы адсорбции по экспериментальным данным
- •45 Катализ и автокатализ. Положительный и отрицательный катализ.
- •46.Гомогенный и гетерогенный катализ. Специфичность каталитических реакций.
- •47. Химическое равновесие. Обратимые и необратимые реакции. Закон действующих масс.
- •48. Вывести константу равновесия Кс и Кр для гомогенной реакции. Константа равновесия реакций в гетерогенных системах
- •49. Сформулировать принцип Ле Шателье и пояснить его на конкретных примерах.
- •50. Химическое сродство. Уравнение изотермы химической реакции и его практическое применение для определения направления процесса.
- •51. Уравнение изохоры, изобары и его практическое применение для определения смещения равновесия при изменении внешних условий.
- •52. Фаза, компонент, число степеней свободы. Правило фаз Гиббса.
- •53. Термический анализ, построение диаграммы плавкости по кривым охлаждения
- •54. Привести диаграмму состояния воды и разобрать её с точки зрения правила фаз.
- •56. Гидратная теория растворов Менделеева
- •57. Осмос. Закон Вант-Гоффа для неэлектролитов и электролитов.
- •58. Равновесие в системе "раствор-пар". Первый закон Рауля.
- •59. Условия кипения и замерзания растворов. Второй закон Рауля.
- •60. Определение молекулярной массы вещества криоскопичечским методом
- •61. Взаимная растворимость жидкостей. Идеальные смеси. Закон Рауля-Дальтона. Диаграмма «Давление насыщенного пара – состав жидкости»
- •62. Первый закон Коновалова, его графическое изображение .Перегонка жидких смесей, подчиняющихся этому закону.
- •63. Второй закон Коновалова, его графическое изображение. Перегонка жидких смесей, подчиняющихся этому закону.
- •64. Что такое азеотроп и как его разделить.
- •65. Закон распределения. Экстракция из растворов /привести формулу и пояснить/.
- •66. Взаимные превращения электрической и химической энергий. Электрохимия, её прикладное значение.
- •67 Электрическая проводимость растворов. Измерение электропроводности растворов.
- •68. Удельная и эквивалентная электропроводности. Их взаимосвязь.
- •69. Электродные процессы. Скачок потенциала на границе металл - раствор. Электродный потенциал. Формула Нернста.
- •70. Электрохимический ряд напряжений. Эдс и принцип работы гальванического элемента
- •71. Водородный электрод.
- •72. Определение эдс элемента компенсационным методом
- •74. Методы получения коллоидных растворов
- •75. Строение коллоидных мицелл.
- •76. Устойчивость коллоидных растворов. Коагуляция.
- •77. Оптические свойства коллоидных растворов.
- •78. Кинетические и электрокинетические свойства коллоидных растворов.
- •79. Эмульсии. Получение эмульсий, их типы. Обращение фаз эмульсий. Деэмульгирование.
- •80 Пены, аэрозоли.
- •81 Общая характеристика растворов вмс. Определение молекулярной массы вмс.
48. Вывести константу равновесия Кс и Кр для гомогенной реакции. Константа равновесия реакций в гетерогенных системах
Для гетерогенной химической реакции, например, между компонентами реального газа и реального раствора, константа равновесия в общем случае может быть выражена уравнением:
![]()
где fi — фугитивность компонентов газовой фазы, а ak — активность компонентов конденсированной фазы.
Если конденсированные фазы (твёрдые или жидкие) представляют собой практически чистые вещества, их активности постоянны и могут быть включены в константу равновесия (то есть в левую часть выражения выше). Условно можно принять их равными единице и, таким образом, исключить из выражения.
Например, для реакции твёрдофазного восстановления оксида железа:
FeOт + COг = Feт + CO2г
константа равновесия (при условии, что газовая фаза идеальна) имеет вид:
![]()
49. Сформулировать принцип Ле Шателье и пояснить его на конкретных примерах.
В 1884 г. французский физикохимик и металловед Анри Луи Ле Шателье сформулировал общий принцип смещения химического равновесия:
Если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие (изменять температуру, давление, концентрации веществ), то положение равновесия смещается в такую сторону, чтобы ослабить внешнее воздействие. Система как бы стремится противостоять изменению внешних условий. Когда, например, температуру равновесной смеси повышают, сама система, конечно, не может ослабить внешний нагрев. Однако равновесие в системе смещается таким образом, что для нагревания её до определённой температуры требуется уже большее количество теплоты. А именно: сдвиг равновесия идёт в сторону эндотермической реакции (протекающей с поглощением теплоты).
50. Химическое сродство. Уравнение изотермы химической реакции и его практическое применение для определения направления процесса.
В смеси один вещества активно реагируют между собой (например, олефины и О2), а другие при обычных условиях не взаимодействуют друг с другом — N2 и О2, N2 и Н2. Из этого следует, что способность молекул различных веществ химически взаимодействовать друг с другом связана с какими-то особыми силами, которые химики назвали химическим сродством. Следовательно, химическое сродство определяется, как способность веществ подвергаться химическим превращениям или химическому взаимодействию с образованием продуктов реакции.
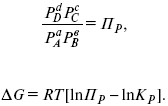
С помощью уравнения изотермы химической реакции можно судить о направлении протекания реакции.
1) Пp< Кp, ΔG < 0, слева направо; 2) Пp> Кp, ΔG > 0, справа налево;
3) Пp= Кp, ΔG = 0, химическое равновесие.
51. Уравнение изохоры, изобары и его практическое применение для определения смещения равновесия при изменении внешних условий.
Зависимость К от температуры
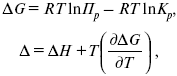
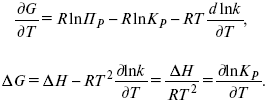
Уравнение изобары:
![]()
Уравнение изохоры:
![]()
По ним судят о направлении протекания реакции:
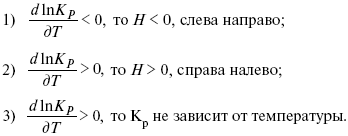
52. Фаза, компонент, число степеней свободы. Правило фаз Гиббса.
Фазой называется однородная часть системы, отделенная от других частей системы (фаз) поверхностью раздела, при переводе через которую химический состав или структура вещества изменяется скачком.
Компонентами называются вещества, образующие систему.
Под числом степеней свободы (вариантностью) системы понимают число внешних и внутренних факторов (температура, давление и концентрация), которое можно изменять без изменения числа фаз в системе.
Пра́вило фаз (или правило фаз Гиббса) — соотношение, связывающее число веществ (компонентов), фаз и степеней свободы в гетерогенной системе.
Правило фаз записывается следующим образом:
![]()
где j — число фаз (например, агрегатных состояний вещества);
v — число степеней свободы, то есть независимых параметров (температура, давление, концентрация компонентов), которые полностью определяют состояние системы при равновесии и которые можно менять без изменения числа и природы фаз;
k — число компонентов системы — число входящих в систему индивидуальных веществ за вычетом числа химических уравнений, связывающих эти вещества. Иначе говоря, это минимальное количество веществ, из которых можно приготовить каждую фазу системы.
n — число переменных, характеризующих влияние внешних условий на равновесие системы.
П![]()
![]() ри
переменных давлении и температуре
правило фаз сводится к выражению:
ри
переменных давлении и температуре
правило фаз сводится к выражению:
В случае однокомпонентной системы оно упрощается до:
