
- •Получение
- •Химические свойства
- •Токсичные свойства
- •Физические свойства
- •Метиламин
- •Олеиновая кислота(c17h33cooh)
- •Свойства
- •Нахождение в природе
- •Применение
- •Химические свойства.
- •Яблочная кислота
- •В природе
- •Роль в метаболизме
- •Применение
- •Отримання
- •[Ред.]Властивості
- •Використання
- •Пировиноградная кислота
- •Получение
- •Биологическая роль
- •Щавелевая кислота
- •Применение
- •Другие реакции
- •Применение и получение
- •Источники
- •Получение
- •Химические свойства
- •Соединения включения
- •Применение метана
- •Физиологическое действие
- •Хроническое действие метана
- •Метан и экология
- •Получение
- •В промышленности
- •Химические свойства
- •Применение
- •Лабораторное применение
- •Безопасность Пожароопасность
- •Токсичность
- •Экология
- •Ацетальдегид
- •Физические свойства
- •Получение
- •Реакционная способность
- •Реакция конденсации
- •Производные ацеталя
- •Применение
- •Биохимия
- •Безопасность
- •Врожденная непереносимость алкоголя
- •Ацетилен
- •Получение
- •Брожение
- •Промышленное производство спирта из биологического сырья
- •Гидролизное производство
- •Гидратация этилена
- •Очистка этанола
- •Абсолютный спирт
- •Химические свойства
- •Применение Топливо
- •Химическая промышленность
- •Медицина
- •Парфюмерия и косметика
- •Пищевая промышленность
- •Формальдегид
- •Применение
- •Пропилен
- •Физические свойства
- •Химические свойства
- •Горение на воздухе
- •Полимеризация
- •Окисление кислородом воздуха в пропиленоксид
- •Получение
- •В промышленности
- •Применение
- •Янтарная кислота(Бурштиновая кислота)
- •Биохимическая роль
- •Применение
Применение
Водный раствор формальдегида — формалин — вызывает денатурацию белков, поэтому он применяется в качестве дубителя в кожевенном производстве и дубления желатина при производствекинофотоплёнки. Из-за сильного дубящего эффекта формальдегид также является и сильным антисептиком, это свойство формалина используется в медицине, как антисептик (формидрон, Формагель и подобные препараты) и для консервации биологических материалов (создание анатомических и других препаратов).
Основная часть формальдегида идёт на изготовление полимеров-реактопластов (фенолформальдегидные, карбамидформальденидные и меламинформальдегидные смолы), он также широко используется в промышленном органическом синтезе (пентаэритрит, триметилолпропан и т.д.).
Химические свойства.
Формальдегид хорошо раств. в воде, спиртах и др. полярных р-рителях. При низких т-рах смешивается в любых соотношениях с неполярными р-рителями:толуолом, диэтиловым эфиром, этилацетатом, CHCl3 (с увеличением т-ры р-римость падает), не раств. в петролейном эфире. Водные р-ры формальдегида содержат равновесную смесь моногидрата CH2(OH)2 (99,9%), неустойчивого в своб. состоянии, и полимергидратов HO(CH2O)nH (п = 2-8), устойчивых кристаллич. соединений. При продолжит. хранении водных р-ров (особенно при низких т-рах) и при их концентрировании степень полимеризацииувеличивается. Для хранения водных р-ров формальдегида их стабилизируют метанолом (см. Формалин). При упаривании водных р-ров в вакууме образуетсяпараформ, или параформальде-гид (CH2O)n (п = 8-12), при действии щелочи на конц. водные р-ры - т. наз. a-полиоксиметилен (n > 100). Полимеризация в неполярном р-рителе приводит к полиформальдегиду (n > 1000).
Параформ - бесцв. кристаллы с запахом формальдегида, т. пл. 120-170 0C, в холодной воде р-ряется медленно, в горячей -быстро, образуя р-ры формальдегида, плохо раств. в ацетоне; горюч, т. всп. 720C.
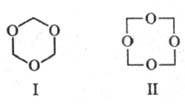
Известны циклич. полимеры формальдегида: триоксан (ф-ла I, т. пл. 64 0C), получаемый перегонкой 60%-ного водного р-ра формальдегида с разб. H2SO4, и тетраоксиметилен (ф-ла II, т. пл. 112 0C), образующийся при нагр. диацетата высокомол. полиоксиметилена.
Формальдегид обладает высокой реакционной способностью. Восстанавливается H2 в присут. многих металлов или их оксидов (напр., Ni, Pt, Cu) до метанола; окисляется HNO3, KMnO4 до муравьиной к-ты или CO2 и H2O; осаждает мн. металлы (Ag, Pt, Au, Bi и др.) из р-ров их солей, окисляясь при этом в муравьиную к-ту.
С альдегидами в
присут. сильных щелочей формальдегид
вступает в т. наз. перекрестную р-цию
Канниццаро (C6H5CHO +
HCHO![]() C6H5CH2OH
+ HCOONa); с ацетальдегидом в
присут. Ca(OH)2 образует пентаэритрит,
в паровой фазе при 285 0C
- акролеин;
под действием алкоголятов Al
или Mg формальдегид
подвергается диспропорционированию с
образованием ме-тилфомиата (см. Тищенко
реакция).
C6H5CH2OH
+ HCOONa); с ацетальдегидом в
присут. Ca(OH)2 образует пентаэритрит,
в паровой фазе при 285 0C
- акролеин;
под действием алкоголятов Al
или Mg формальдегид
подвергается диспропорционированию с
образованием ме-тилфомиата (см. Тищенко
реакция).
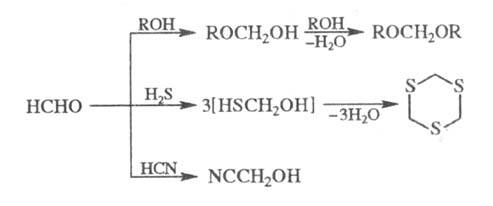
Р-ция формальдегида со спиртами в присут. сильных к-т приводит к ацеталям (формалям), с H2S - к циклич. тритиану, с HCN в присут. щелочей - кциангидрину:
Формальдегид присоединяется к олефинам в присут. кислых катализаторов с образованием 1,3-дигликолей и 1,3-диоксанов (см. Принса реакция), р-ция формальдегида с изобутиленом дает изопрен, жидкофазная конденсация с пропиленом в присут. BF3 или H2SO4 - бутадиен. Из формальдегида и кетена в пром-сти получают -пропиолактон.
Р-ция формальдегида с ацетиленом - пром. способ получения бутадиена (см. Рeппe реакции), при взаимод. двух молекул формальдегида с ацетиленомобразуется 2-бутин-1,4-диол.
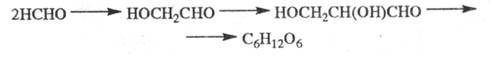
В присут. извести формальдегид превращается в углеводы:
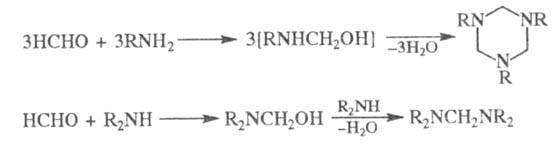
При взаимод. формальдегида с NH3 образуется гексаметилентетрамин, с первичными аминами - тримеры, с вторичными - бис-(ди-алкиламино)метаны:
Соед.
с подвижным атомом водорода реагируют
с формальдегидом и NH3 (или аминами)
по Манниха
реакции.
Р-ция формальдегида с NH4Cl
пром. способ получения метиламина:
2НСНО + NH4Cl ![]() CH3NH2 ·
HCl + HCOOH (р-ция может идти дальше с
образованием ди- и триметиламинов).
С мочевиной в
щелочной среде формальдегид дает моно-
и диметилольные производные, поликонденсацией к-рых
получают мочевино-формальдегид-ные
смолы, а измеламина и
формальдегида- меламино-формальдегидные
смолы.
CH3NH2 ·
HCl + HCOOH (р-ция может идти дальше с
образованием ди- и триметиламинов).
С мочевиной в
щелочной среде формальдегид дает моно-
и диметилольные производные, поликонденсацией к-рых
получают мочевино-формальдегид-ные
смолы, а измеламина и
формальдегида- меламино-формальдегидные
смолы.
