
- •Получение
- •Химические свойства
- •Токсичные свойства
- •Физические свойства
- •Метиламин
- •Олеиновая кислота(c17h33cooh)
- •Свойства
- •Нахождение в природе
- •Применение
- •Химические свойства.
- •Яблочная кислота
- •В природе
- •Роль в метаболизме
- •Применение
- •Отримання
- •[Ред.]Властивості
- •Використання
- •Пировиноградная кислота
- •Получение
- •Биологическая роль
- •Щавелевая кислота
- •Применение
- •Другие реакции
- •Применение и получение
- •Источники
- •Получение
- •Химические свойства
- •Соединения включения
- •Применение метана
- •Физиологическое действие
- •Хроническое действие метана
- •Метан и экология
- •Получение
- •В промышленности
- •Химические свойства
- •Применение
- •Лабораторное применение
- •Безопасность Пожароопасность
- •Токсичность
- •Экология
- •Ацетальдегид
- •Физические свойства
- •Получение
- •Реакционная способность
- •Реакция конденсации
- •Производные ацеталя
- •Применение
- •Биохимия
- •Безопасность
- •Врожденная непереносимость алкоголя
- •Ацетилен
- •Получение
- •Брожение
- •Промышленное производство спирта из биологического сырья
- •Гидролизное производство
- •Гидратация этилена
- •Очистка этанола
- •Абсолютный спирт
- •Химические свойства
- •Применение Топливо
- •Химическая промышленность
- •Медицина
- •Парфюмерия и косметика
- •Пищевая промышленность
- •Формальдегид
- •Применение
- •Пропилен
- •Физические свойства
- •Химические свойства
- •Горение на воздухе
- •Полимеризация
- •Окисление кислородом воздуха в пропиленоксид
- •Получение
- •В промышленности
- •Применение
- •Янтарная кислота(Бурштиновая кислота)
- •Биохимическая роль
- •Применение
Безопасность
Ацетальдегид токсичен при действии на кожу, ирритант и, возможно, канцероген. Он также является загрязнителем воздуха при горении, курении, в автомобильных выхлопах. Он также образуется при термической обработке полимеров и пластиков.[20]
Врожденная непереносимость алкоголя
Одним из механизмов врожденной непереносимости алкоголя является накопление ацетальдегида.
Ацетилен
Ацетиле́н (по ИЮПАК — этин) — ненасыщенный углеводород C2H2. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов.
Физические свойства
При нормальных условиях — бесцветный газ, малорастворим в воде, легче воздуха. Температура кипения −83,8 °C. При сжатии разлагается со взрывом, хранят в баллонах, заполненных кизельгуром или активированным углем, пропитанным ацетоном, в котором ацетилен растворяется под давлением в больших количествах. Взрывоопасный. Нельзя выпускать на открытый воздух. C2H2 обнаружен на Уране и Нептуне.
Химические свойства
Для ацетилена (этина) характерны реакции присоединения:
HC≡CH + Cl2 -> СlСН=СНСl
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи,молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³. При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняетметан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солямисеребра и одновалентной меди.
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Основные
химические реакции ацетилена (реакции
присоединения, сводная таблица 1.):
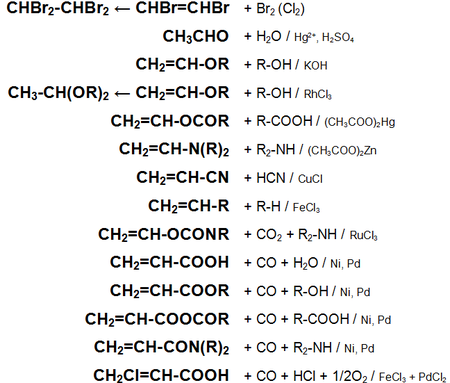
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.):
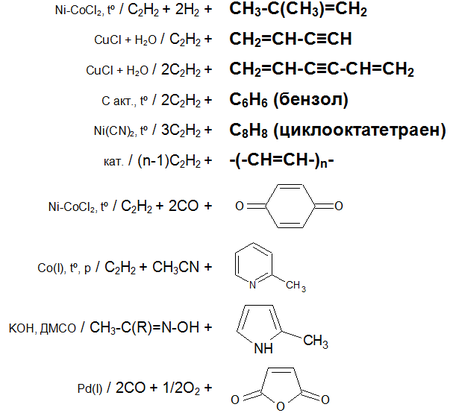
История
Открыт в 1836 г. Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 г.).
Способ производства
В лаборатории ацетилен получают действием воды на карбид кальция см. видео данного процесса (Ф. Вёлер, 1862 г.),
CaC2+ 2 Н2О = С2Н2↑ + Са(ОН)2
а также при дегидрировании двух молекул метана при температуре свыше 1400° Цельсия:
2СН4 = С2Н2↑ + Н2↑
Применение:
Ацетилен используют:
для сварки и резки металлов,
как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа),
в производстве взрывчатых веществ (см. ацетилениды),
для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
для получения технического углерода
в атомно-абсорбционной спектрофотометрии при пламенной атомизации
Безопасность
Поскольку ацетилен растворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры.
Этанол
[Этано́л (эти́ловый спирт, метилкарбино́л, ви́нный спирт, часто в просторечии просто «спирт» или алкого́ль) — одноатомный спирт с формулой C2H5OH(эмпирическая формула C2H6O), другой вариант: CH3-CH2-OH, второй представитель гомологического ряда одноатомных спиртов, при стандартных условиях летучая, горючая, бесцветная прозрачная жидкость.
Действующий компонент алкогольных напитков, являющийся психоактивным веществом и воздействующий как депрессант на центральную нервную систему человека[1].
Этиловый спирт также используется как топливо, в качестве растворителя и как наполнитель в спиртовых термометрах.
