
- •Механизмы и пути передачи инфекции
- •2 Патогенность- генетическая детерминированность, потенциальная способность данного вида микроба вызывать инфекционную болезнь.
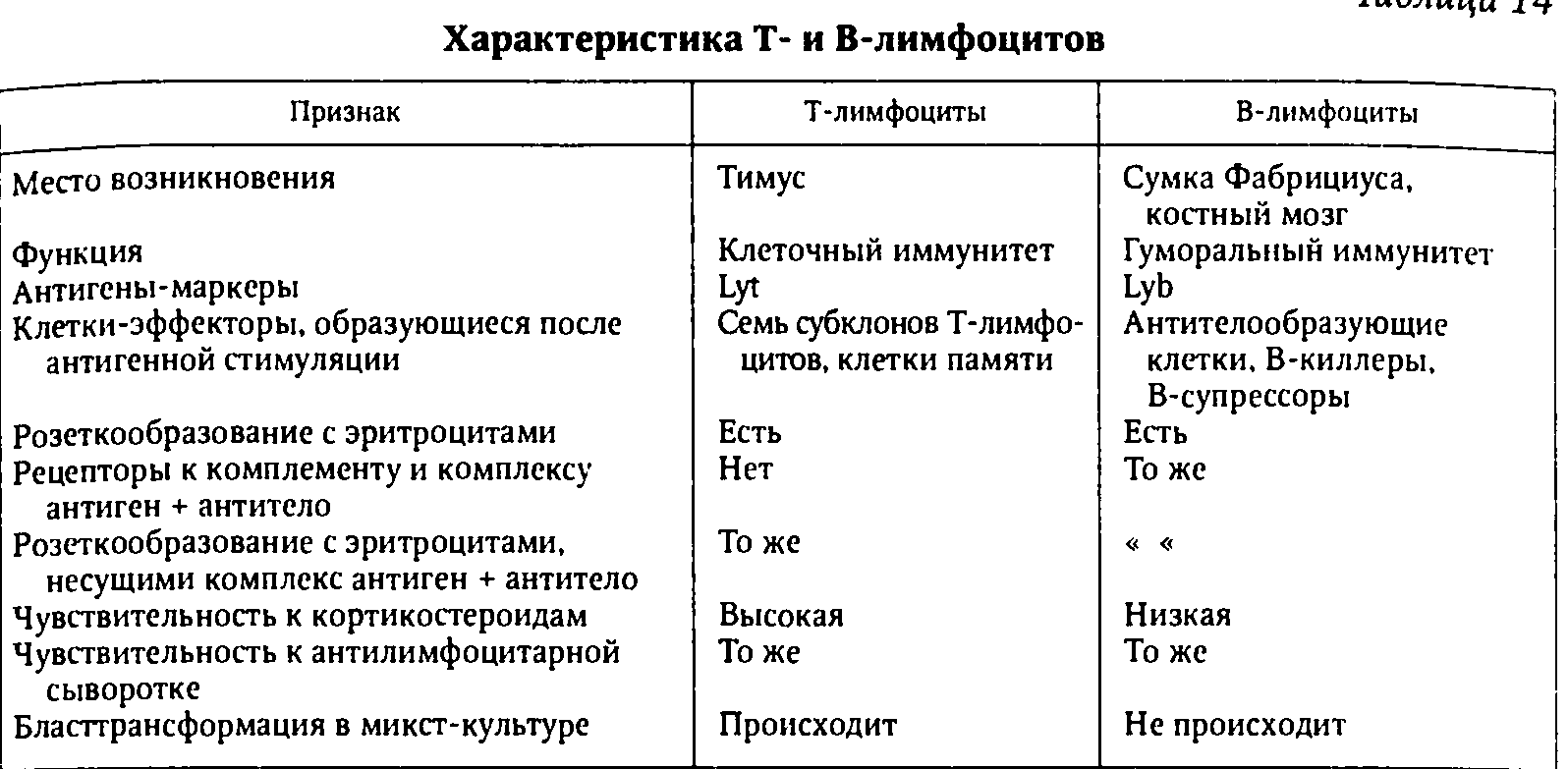
- •4Виды иммунитета
- •142 Комплекса, но без участия компонентов с1, с2, с4. Весь
- •9.7.3. Интерферон
- •7 Большое значение в неспецифической резистентности имеют
- •11 Приобретенный иммунитет специфичен и не
- •15 Сут, стационарная — 15—30 сут и фаза снижения — 1—6 мес
- •13 Иммунологической памятью называют способность организма при
- •9.12.1.2. Атопии
- •17 Иммунный процесс протекает по единой схеме и состоит из
- •9.13.1. Противовирусный иммунитет
- •166 Дукцию вируса, а только препятствуют генерализации вирусной
7 Большое значение в неспецифической резистентности имеют
клетки, способные к фагоцитозу, а также клетки с цитотокси-
ческой активностью, называемые естественными киллерами, или
NK-клетками. NK-клетки представляют собой особую популяцию
лимфоцитоподобных клеток (большие фанулосодержащие
лимфоциты), обладающих цитотоксическим действием против
чужеродных клеток (раковых, клеток простейших и клеток,
пораженных вирусом). Видимо, NK-клетки осуществляют в организме
противоопухолевый надзор.
В поддержании резистентности организма имеет большое
значение и нормальная микрофлора организма.
NK-клетки Среди лимфоцитов периферии имеется популяция, получившая название натуральных киллерных клеток (NK). Характерной особенностью этих лимфоцитоподобных клеток является отсутствие у них структур, способных к специфическому распознаванию антигена, подобных тем, которыми обладают Т- и В-клетки. В то же время они, как и Т-киллеры, разрушают определенную категорию чужеродных клеток, но в отличие от последних неспецифическим образом. Способность к такому лизису объединяет их с активированными макрофагами. В организме NK-клетки составляют около 15 % от всех лимфоцитов. Наиболее характерными, функционально значимыми молекулами клеточной поверхности NK, обеспечивающими их контакт с чужеродными клетками и последующий лизис этих клеток-мишеней, являются CD56 (NKH1) — изоформа адгезивного белка N-CAM, CD 161 (NKR.P-1), и KAR (от англ. - killer activation receptor). Кроме этих рецепторов как специфических молекулярных структур NK имеются и такие, которые являются общими с другими клетками. Не обладая эффектом киллинга, они способствуют взаимодействию NK с клеткой-мишенью. К ним относится CD 16 (FcyRIII) — низко аффинный рецептор К-клеток (субпопуляции NK), связывающий агрегированный IgGl и IgG3. В реализации цитолиза в качестве вспомогательных структур участвуют также молекулы адгезии: CD11/CD18 (LFA-1, Мас-1, CR4), CD44, CD2 (LFA-2) и др. Уникальным свойством NK является их способность быть инертными к собственным (аутологичным) клеточным антигенам гистосовместимости при сохранении агрессивности по отношению к клеткам, несущим гомологичные аллоантигены. В иммунологии это явление получило название «метка своего». Значение подобной дискриминационной функции состоит в контроле за возможными мутационными изменениями собственных антигенов. В таком контроле за неизменностью собственных антигенов, по крайней мере тех, которые относятся к молекулам I класса МНС, принимают участие структуры, относящиеся к суперсемейству иммуноглобулинов (см. гл. 5). Среди них: NKB. 1 (распознавание молекулы I класса HLA-B у человека), группа белков KIR (от англ. — killer inhibitory receptor), которые распознают молекулы HLA-C. Белки группы KIR представлены несколькими изоформами, т. е. гены, контролирующие их, образуют целые полигенные семейства. В каждой конкретной клетке экспрессируется только одна из возможных изоформ, что позволяет говорить об определенной клональной организации NK. Гистогенез NK связан с развитием лимфоцитов вообще и Т-клток в частности. Предполагается, что NK являются ответвлением от самых ранних этапов Т-клеточного пути дифференцировки вкостном мозге. О близости между NK- и Т-клетками говорит ряд фактов: наличие общих маркеров и ростстимулирующих факторов, присутствие предшественников NK в тимусе, функциональная идентичность по конечному результату — разрушение чужеродных клеток, наличие (3-цепи Т-клеточного антигенраспознающего рецептора (TCR) у NK. Незрелые, еще не начавшие экспрессию основных дифференцировочных маркеров-корецепторов CD4- и СБ8-тимоциты (CD4-CD8-) эмбрионального тимуса, попадая в микроокружение селезенки, развиваются в NK-клетки. Из 24 маркеров CD у NK-клеток 5 являются общими только с Т-клетками. В категорию общих маркеров входят, с одной стороны, такой мажорный антиген NK, как CD56, а с другой — специфический антиген Т-киллеров CD8, представленный у NK в формеции этих эволюциоино наиболее древних клеток крайне разнообразны: участие в неспецифическом иммунном ответе, удаление отживших и разрушенных клеток собственного организма (функция мусорщика), специфический иммунный ответ в качестве презентирующей антиген клетки, выполнение функции цитотоксической клетки, продукция большого арсенала цитокинов и иных эндогенных соединений, регулирующих иммунный процесс. Морфологически макрофаги детально охарактеризованы. Они представляют собой крупные полиморфные клетки диаметром 15 — 25 мкм, с ядром неправильной формы, имеющим тонко структурированный хроматин. Зрелые макрофаги подразделяются на подвижные, мигрирующие в очаги воспаления, места тканевой деструкции, и резидентные, локализованные в отдельных органах и тканях. К резидентным макрофагам относятся гистиоциты соединительной ткани, звездчатые ретикулоэндотелиоциты печени (купферовские клетки), альвеолярные макрофаги легких, макрофаги костного мозга, макрофаги селезенки и лимфатических узлов, клетки микроглии нервной системы. Гистогенез макрофагов, как и других клеток лимфомиелоидного комплекса, начинается от стволовой кроветворной клетки костного мозга. Весь путь развития макрофагов проходит под влиянием клеточных и гуморальных факторов микроокружения. Первый этап дифференцировки приводит к образованию клетки-предшественницы для всех ростков миелоидного пути развития. На этом этапе действуют в первую очередь интерлей-кин-3 (ИЛ-3) и гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ). Эти же факторы оказывают влияние и на последующие этапы дифференцировки, приводящие к образованию общего предшественника макрофагов и гранулоцитов, монобластов, промоноцитов. При образовании моноцитов определенная роль принадлежит ИЛ-6. Костномозговой путь развития завершается образованием промоноцита, который, мигрируя в кровь, трансформируется в моноцит. В крови моноцит в качестве самостоятельной клетки существует около 2 —6 ч, после чего мигрирует в периферические органы, где через стадию незрелого макрофага завершает свой путь развития, превращаясь в зрелую, не способную к пролиферации форму. Среди мембранных белков макрофаги в отличие от других клеток имеют рецепторы ко всем классам иммуноглобулинов (CD 16, CD23, CD32, CD64). Важными для макрофагов как антигенпрезентирующих клеток являются корецепторы CD80 и CD86, хотя их полноценная экспрессия начинается только после стимуляции клеток. Два рецептора — CD1 lb/CD18 и CDllc/CD18 — существенны не только для связи с компонентами комплемента, но и для распознавания опсонизированных микробных и иных клеток, что приводит к эффективному их поглощению макрофагами. Для полноценной реализации своей основной функции — поглощения микробных тел, важен также рецептор CD 14, взаимодействующий с липополисахаридами бактерий. При взаимодействии с межклеточным матриксом и другими клетками макрофаги используют рецепторы, относящиеся к группе интегринов, например CD1 la/CD18, CD1 lb/ CD18, CD49 и др. Являясь активными эффекторными и регуляторными клетками в проявлении как неспецифического, так и специфического иммунного ответа, макрофаги обладают также набором рецепторов к цитокинам и другим биологически активным соединениям. Механизм действия
NK являются цитотоксичными; в их цитоплазме находятся маленькие гранулы, содержащие перфорин и протеазы. Перфорин выделяется непосредственно возле инфицированной клетки и образует поры в её клеточной мембране, через которые заходят протеазы и другие молекулы, приводя к апоптозу или осмотическому лизису клетки. Выбор между апоптозом и лизисом имеет большое значение, поскольку при лизисе зараженной вирусом клетки произойдет освобождение вирионов, а апоптоз приведет к разрушению вирусов вместе с клеткой.
8- Антигены — это любые генетически чужеродные для
данного организма вещества (обычно биополимеры), которые, попав
во внутреннюю среду организма или образуясь в организме, вы-
144
зывают ответную специфическую иммунологическую реакцию:
синтез антител, появление сенсибилизированных лимфоцитов или
возникновение толерантности к этому веществу,
гиперчувствительности немедленного и замедленного типов
иммунологической памяти. Антитела, вырабатываемые в ответ на введение
антигена, специфически взаимодействуют с этим антигеном in vitro
и in vivo, образуя комплекс антиген — антитело.
Антигены, вызывающие полноценный иммунный ответ,
называются полными антигенами. Это органические вещества
микробного, растительного и животного происхождения.
Химические элементы, простые и сложные неорганические
соединения антигенностью не обладают. Антигенами могут быть как
вредные, так и безвредные для организма вещества.
Антигенами являются также бактерии, грибы, простейшие,
вирусы, клетки и ткани животных, попавшие во внутреннюю
среду макроорганизма, а также клеточные стенки, цитоплазма-
тические мембраны, рибосомы, митохондрии, микробные
токсины, экстракты гельминтов, яды многих змей и пчел,
природные белковые вещества, некоторые полисахаридные вещества
микробного происхождения, растительные токсины и т. д. Ан-
тигенность определяется структурными особенностями
биополимеров, являющихся генетически чужеродными для организма.
Большинство из них содержат несколько видов антигенов.
Количество антигенов в природе увеличивается в результате
появления антигенных свойств у многих неантигенных субстанций при
соединении их с другими веществами.
Некоторые вещества самостоятельно не вызывают
иммунного ответа, но приобретают эту способнодть при конъюгации с
высокомолекулярными белковыми носителями или в смеси с
ними. Такие вещества называют неполными антигенами, или
гаптенами. Гаптенами могут быть химические вещества с
малой молекулярной массой или более сложные химические
вещества, не обладающие свойствами полного антигена:
некоторые бактериальные полисахариды, полипептид туберкулезной
палочки (РРД), ДНК, РНК, липиды, пептиды. Гаптен является
частью полного или конъюгированного антигена. Образующиеся
к конъюгату белка с гаптеном антитела могут также
реагировать и со свободным гаптеном. Гаптены иммунного ответа не
вызывают, но они вступают в реакцию с сыворотками,
содержащими специфические к ним антитела.
Антигены обладают специфичностью, которая связана с
какой-либо определенной химической группой в составе
молекулы, называемой детерминантой, или эпитопом.
Детерминанты антигена — это те его части, которые распознаются
антителами и иммунокомпетентными клетками.
Полные антигены могут иметь в своем составе две и более
145
однозначные детерминантные группировки, поэтому они
являются двухвалентными или поливалентными. Неполные антигены
(гаптены) имеют лишь одну детерминантную группировку, т.е.
являются одновалентными.
Наиболее выраженными антигенными свойствами обладают
белки как биополимеры с выраженной генетической чужерод-
ностью. Чем дальше друг от друга в филогенетическом развитии
отстоят животные, тем большей антигенностью будут обладать
их белки по отношению друг к другу. Это свойство белков
используется для выявления филогенетического родства животных
различных видов, а также в судебно-медицинской экспертизе
(для определения видовой принадлежности пятен крови) и
пищевой промышленности (для выявления фальсификации мясных
продуктов).
Большое значение имеет молекулярная масса антигена.
Антигенностью обладают биополимеры с молекулярной массой не
менее 5—10 кД. Из этого правила существуют исключения:
нуклеиновые кислоты обладают большой молекулярной массой, но
по сравнению с белком их антигенные свойства гораздо менее
выражены. Сывороточный альбумин и гемоглобин обладают
одинаковой молекулярной массой (~ 70 000), но альбумин является
более сильным антигеном, чем гемоглобин. Это обусловлено
различием в валентности указанных белков, т.е. числе
содержащихся в них детерминантных групп.
Антигенность связывают с жесткой поверхностной структурой
детерминант, расположением аминокислот, составляющих
полипептидные цепи, особенно их концевые части. Например,
желатин многие годы не считался антигеном из-за отсутствия
жестких структур на поверхности молекулы, хотя представляет
собой белок с большой молекулярной массой. Молекула
желатина может приобрести свойства антигена, если ввести в ее
структуру тирозин или другое химическое вещество, придающее
жесткость поверхностным структурам. Антигенная детерминанта
полисахаридов состоит из нескольких гексозных остатков.
Антигенные свойства желатина, гемоглобина и других слабых
антигенов можно усилить, адсорбируя их на различных
носителях (каолин, активированный уголь, химические полимеры,
гидроокись алюминия и др.). Эти вещества повышают иммуноген-
ность антигена. Они называются адъю ванта ми (см. главу 9).
На иммунный ответ влияет количество поступающего
антигена: чем его больше, тем более выражен иммунный ответ.
Однако при слишком большой дозе антигена может наступить
иммунологическая толерантность, т.е. отсутствие ответа
организма на антигенное раздражение. Это явление можно объяснить
стимуляцией антигеном субпопуляции супрессорных Т-лимфо-
цитов.
146
Важным условием антигенности является растворимость
антигена. Кератин — высокомолекулярный белок, но он не может
быть представлен в виде коллоидного раствора и не является
антигеном.
Гаптены из-за небольшой молекулярной массы не
фиксируются иммунокомпетентными клетками макроорганизма и не
могут вызвать ответную иммунологическую реакцию. Если
молекулу гаптена искусственно укрупнить, конъюгировав ее с
крупной белковой молекулой, получится полноценный антиген,
специфичность которого будет определять гаптен. Белок-носитель при
этом может терять свою видовую специфичность, так как
детерминанты гаптена расположены на его поверхности и
перекрывают его собственные детерминанты.
Полугаптены — неорганические радикалы (йод, бром, нит-
рогруппа, азот и т. д.), присоединившиеся к белковой
молекуле, могут менять иммунологическую специфичность белка.
Такие йодированные или бромированные белки вызывают
образование антител, специфичных к йоду и брому соответственно, т. е.
к тем детерминантам, которые располагаются на поверхности
полного антигена.
Проантигены — гаптены, которые могут соединяться с
собственными белками организма и сенсибилизировать его как
аутоантигены. Например, продукты расщепления пенициллина в
соединении с белками организма могут быть антигенами.
Гетероантигены — общие антигены, встречающиеся у
разных видов животных. Впервые этот феномен был отмечен в
опытах Дж. Форсмана A911), который иммунизировал кролика
суспензией органов морской свинки. Полученная от кролика
сыворотка содержала антитела, вступавшие во взаимодействие не
только с белками морской свинки, но и с эритроцитами
барана. Оказалось, что полисахариды морской свинки в антигенном
отношении одинаковы с полисахаридами эритроцитов барана.
Гетероантигены обнаружены у человека и некоторых видов
бактерий. Например, возбудитель чумы и эритроциты человека
с 0 группой крови имеют общие антигены. В результате имму-
нокомпетентные клетки этих людей не реагируют на
возбудителя чумы как на чужеродный антиген и не развивают
полноценной иммунологической реакции, что нередко приводит к
летальному исходу.
Аллоантигены (изоантигены) — различные антигены
внутри одного вида. В настоящее время в эритроцитах человека
обнаружено более 70 антигенов, которые дают около 200 000
сочетаний. Для практического здравоохранения решающее
значение имеют группы крови в системе AB0 и резус-антиген. Кроме
эритроцитарных антигенов, у человека существуют и другие
аллоантигены, например антигены главного комплекса гистосов-
147
местимости — МНС (Major Histocompatibility Complex). В 6-й паре
хромосом человека располагаются трансплантационные
антигены HLA (Human Leucocyte Antigens), детерминирующие
тканевую совместимость при пересадке тканей и органов. Тканям
человека присуща абсолютная индивидуальность, и подобрать донора
и реципиента с одинаковым набором тканевых антигенов
практически невозможно (исключение — однояйцевые близнецы).
Клетки злокачественных опухолей также содержат антигены,
отличающиеся от антигенов нормальных клеток, что
используется для иммунодиагностики опухолей (см. главу 9).
Антигены бактерий, вирусов, грибов, простейших являются
полными антигенами. В соответствии с химическим составом,
содержанием и качеством белков, липидов, их комплексов анти-
генность у разных видов микроорганизмов различна. Поэтому
каждый вид представляет собой антигенную мозаику (см. главу 2).
Антигены микроорганизмов используют для получения вакцин
и диагностических препаратов, а также идентификации и
индикации микроорганизмов.
В процессе эволюции антигенная структура некоторых
микроорганизмов может меняться. Особенно большой
изменчивостью антигенной структуры обладают вирусы (гриппа, ВИЧ).
Таким образом, антигены, как генетически чужеродные
вещества, осуществляют запуск иммунной системы, приведение ее
в функционально активное состояние, выражающееся в
проявлении тех или иных иммунологических реакций, направленных
на устранение неблагоприятного воздействия антигена.
9
 Иммунокомпетентные
клетки. К иммунокомпетентным клеткам,
непосредственно обеспечивающим
выполнение функций иммунной системы,
относятся антигенпредставляющие клетки
(АПК), Т- и В-лимфоциты и NK-клетки. Цитокины.
Многие иммунокомпетентные клетки, а
также разные типы клеток, не включённых
в состав иммунной системы, принимают
участие в синтезе и секреции во внутреннюю
среду организма многочисленных
биологически активных веществ (в общем
виде их именуют цитокинами), регулирующих
разные стороны многообразных
взаимоотношений, складывающихся между
разными иммунокомпетентными клетками
и другими клетками, прямо или опосредованно
принимающими участие в защите организма.
В настоящее время эти классические
представления, не подвергаясь ревизии
in toto, существенно расширяются и
углубляются, особенно в связи с
лавинообразным нарастанием суммы
фактов, характеризующих молекулярные
механизмы функционирования и идентификации
типов и подтипов, популяций и субпопуляций
иммунокомпетентных клеток. Ниже в самом
общем виде суммированы классические
представления об иммунокомпетентных
клетках, что поможет читателю в усвоении
изложенного в книге материала.
•
Антигенпредставляющие клетки. К АПК
относятся макрофаги, отростчатые
(дендритные) клетки лимфатических узлов,
селезёнки и других тканей, включая
клетки Лангерганса эпидермиса, М-клетки
лимфатических фолликулов пищеварительного
тракта и других слизистых оболочек,
дендритные эпителиальные клетки
вилочковой железы. Эти клетки захватывают,
обрабатывают (процессируют) и представляют
Аг на своей поверхности Т-лимфоцитам-хелперам.
•
Т-лимфоциты ответственны за так называемый
клеточный иммунный ответ, а также
помогают реагировать на Аг В-лимфоцитам
при гуморальном иммунном ответе. Каждый
Т-лимфоцит содержит Ig-подобный интегральный
мембранный гликопротеин — Рц Т-лимфоцитов
(TCR — Т Cell Receptor) строго одной специфичности,
т.е. взаимодействующий только с одним
Аг. Т-клетки по экспрессии маркерных Аг
CD подразделяют на CD4+ и CD8+.
♦
С04+-лимфоциты. Т-клетки, содержащие
мембранные маркеры CD4, подразделяют на
регуляторные (Т-хелперы, или ТЬ2-хелперы)
и эффекторные (Thl-хелперы, или Тгзт). о
Т-хелперы при взаимодействии с АПК
специфически распознают Аг; Th2 при
взаимодействии с В-клетками
индуцируютгуморальный иммунный ответ,
a Thl — при взаимодействии с цитотоксическими
Т-лимфоцитами (ЦТЛ) — клеточный иммунный
ответ, о Тгзт (Т-эффекторы реакций
гиперчувствительности замедленного
типа) опосредуют реакции гиперчувствительности
замедленного типа (ГЗТ).
♦
СБ8+-лимфоциты. Субпопуляции Т-клеток,
экспрессирующие мембранные молекулы
CD8, также подразделяют на регуляторные
и эффекторные (ЦТЛ).о Т-супрессоры
регулируют интенсивность иммунного
ответа, подавляя активность С04+-клеток.
о Цитотоксические Т-лимфоциты (ЦТЛ) или
Т-киллеры лизируют клетки-мишени, несущие
чужеродные Аг или видоизменённые
собственные Аг — аутоантигены (например,
клетки опухолей, трансплантатов,
инфицированные вирусами; клетки, несущие
поверхностные вирусные Аг). Цитотоксический
эффект Т-киллеров реализуется через
образование в клетках-мишенях пор (под
действием особых белков — перфоринов)
и секреции в поры специализированных
сериновых протеаз — гранзимов. Нарушение
осмотического баланса с внеклеточной
средой приводит к гибели клетки. Под
влиянием гранзимов индуцируются процессы
запрограммированной гибели клетки —
апоптоза.
♦
Т-клетки памяти — долгоживущие
рециркулирующие малые лимфоциты,
формируются при первичном иммунном
ответе, «запоминают» особенности
детерминант Аг и при повторнойстимуляции
лимфоцитов этого организма теми же
самыми Аг развивают быстрый и повышенный
ответ, направленный против индуцирующих
их образование Аг. Т-клетки памяти
отличаются от неиммунных Т-лимфоцитов
большей частотой, большей экспрессией
мембранных молекул, меньшей потребностью
в медиаторах доиммунного воспаления и
корецепторных сигналах для развития
эффекторной фазы иммунного ответа.
•
В-лимфоциты ответственны за так называемый
гуморальный иммунный ответ. В мембране
В-лимфоцитов присутствует рецептор Аг
— мономер IgM. Продолжительность жизни
большинства В-лимфоцитов (если они не
активируются Аг!) не превышает десяти
дней. Различают подгруппы В-клеток:
антигенпредставляющие, эффекторные и
клетки памяти.
♦
Эффекторные В-лимфоциты. Активированные
В-лимфоциты размножаются и дифференцируются
в плазматические клетки (см. рис. 5.9),
вырабатывающие AT — Ig всех известных
классов.
♦
В-лимфоциты иммунологической памяти —
долгоживущие ре-циркулирующие малые
лимфоциты. Они не превращаются в
плазматические клетки, но сохраняют
иммунную «память» об Аг. Клетки памяти
активируются при повторной их стимуляции
тем же самым Аг. В этом случае В-лимфоциты
памяти (при обязательном участии
Т-хелперов и ряда других факторов)
обеспечивают быстрый синтез большого
количества специфических AT, взаимодействующих
с чужеродным Аг, и развитие эффективного
иммунного ответа.
•
NK-клетки (от англ. Natural Killer, естественные
киллеры) — лимфоциты, лишённые характерных
для Т- и В-клеток поверхностных маркёрных
CD-детерминант, а также антигенраспознающих
Рц — TCR и BCR. Эти клетки играют важную
роль в механизмах доиммунной резистентности
организма (см. главу 3), уничтожают
трансформированные, инфицированные
вирусами и чужеродные клетки.
Иммунокомпетентные
клетки. К иммунокомпетентным клеткам,
непосредственно обеспечивающим
выполнение функций иммунной системы,
относятся антигенпредставляющие клетки
(АПК), Т- и В-лимфоциты и NK-клетки. Цитокины.
Многие иммунокомпетентные клетки, а
также разные типы клеток, не включённых
в состав иммунной системы, принимают
участие в синтезе и секреции во внутреннюю
среду организма многочисленных
биологически активных веществ (в общем
виде их именуют цитокинами), регулирующих
разные стороны многообразных
взаимоотношений, складывающихся между
разными иммунокомпетентными клетками
и другими клетками, прямо или опосредованно
принимающими участие в защите организма.
В настоящее время эти классические
представления, не подвергаясь ревизии
in toto, существенно расширяются и
углубляются, особенно в связи с
лавинообразным нарастанием суммы
фактов, характеризующих молекулярные
механизмы функционирования и идентификации
типов и подтипов, популяций и субпопуляций
иммунокомпетентных клеток. Ниже в самом
общем виде суммированы классические
представления об иммунокомпетентных
клетках, что поможет читателю в усвоении
изложенного в книге материала.
•
Антигенпредставляющие клетки. К АПК
относятся макрофаги, отростчатые
(дендритные) клетки лимфатических узлов,
селезёнки и других тканей, включая
клетки Лангерганса эпидермиса, М-клетки
лимфатических фолликулов пищеварительного
тракта и других слизистых оболочек,
дендритные эпителиальные клетки
вилочковой железы. Эти клетки захватывают,
обрабатывают (процессируют) и представляют
Аг на своей поверхности Т-лимфоцитам-хелперам.
•
Т-лимфоциты ответственны за так называемый
клеточный иммунный ответ, а также
помогают реагировать на Аг В-лимфоцитам
при гуморальном иммунном ответе. Каждый
Т-лимфоцит содержит Ig-подобный интегральный
мембранный гликопротеин — Рц Т-лимфоцитов
(TCR — Т Cell Receptor) строго одной специфичности,
т.е. взаимодействующий только с одним
Аг. Т-клетки по экспрессии маркерных Аг
CD подразделяют на CD4+ и CD8+.
♦
С04+-лимфоциты. Т-клетки, содержащие
мембранные маркеры CD4, подразделяют на
регуляторные (Т-хелперы, или ТЬ2-хелперы)
и эффекторные (Thl-хелперы, или Тгзт). о
Т-хелперы при взаимодействии с АПК
специфически распознают Аг; Th2 при
взаимодействии с В-клетками
индуцируютгуморальный иммунный ответ,
a Thl — при взаимодействии с цитотоксическими
Т-лимфоцитами (ЦТЛ) — клеточный иммунный
ответ, о Тгзт (Т-эффекторы реакций
гиперчувствительности замедленного
типа) опосредуют реакции гиперчувствительности
замедленного типа (ГЗТ).
♦
СБ8+-лимфоциты. Субпопуляции Т-клеток,
экспрессирующие мембранные молекулы
CD8, также подразделяют на регуляторные
и эффекторные (ЦТЛ).о Т-супрессоры
регулируют интенсивность иммунного
ответа, подавляя активность С04+-клеток.
о Цитотоксические Т-лимфоциты (ЦТЛ) или
Т-киллеры лизируют клетки-мишени, несущие
чужеродные Аг или видоизменённые
собственные Аг — аутоантигены (например,
клетки опухолей, трансплантатов,
инфицированные вирусами; клетки, несущие
поверхностные вирусные Аг). Цитотоксический
эффект Т-киллеров реализуется через
образование в клетках-мишенях пор (под
действием особых белков — перфоринов)
и секреции в поры специализированных
сериновых протеаз — гранзимов. Нарушение
осмотического баланса с внеклеточной
средой приводит к гибели клетки. Под
влиянием гранзимов индуцируются процессы
запрограммированной гибели клетки —
апоптоза.
♦
Т-клетки памяти — долгоживущие
рециркулирующие малые лимфоциты,
формируются при первичном иммунном
ответе, «запоминают» особенности
детерминант Аг и при повторнойстимуляции
лимфоцитов этого организма теми же
самыми Аг развивают быстрый и повышенный
ответ, направленный против индуцирующих
их образование Аг. Т-клетки памяти
отличаются от неиммунных Т-лимфоцитов
большей частотой, большей экспрессией
мембранных молекул, меньшей потребностью
в медиаторах доиммунного воспаления и
корецепторных сигналах для развития
эффекторной фазы иммунного ответа.
•
В-лимфоциты ответственны за так называемый
гуморальный иммунный ответ. В мембране
В-лимфоцитов присутствует рецептор Аг
— мономер IgM. Продолжительность жизни
большинства В-лимфоцитов (если они не
активируются Аг!) не превышает десяти
дней. Различают подгруппы В-клеток:
антигенпредставляющие, эффекторные и
клетки памяти.
♦
Эффекторные В-лимфоциты. Активированные
В-лимфоциты размножаются и дифференцируются
в плазматические клетки (см. рис. 5.9),
вырабатывающие AT — Ig всех известных
классов.
♦
В-лимфоциты иммунологической памяти —
долгоживущие ре-циркулирующие малые
лимфоциты. Они не превращаются в
плазматические клетки, но сохраняют
иммунную «память» об Аг. Клетки памяти
активируются при повторной их стимуляции
тем же самым Аг. В этом случае В-лимфоциты
памяти (при обязательном участии
Т-хелперов и ряда других факторов)
обеспечивают быстрый синтез большого
количества специфических AT, взаимодействующих
с чужеродным Аг, и развитие эффективного
иммунного ответа.
•
NK-клетки (от англ. Natural Killer, естественные
киллеры) — лимфоциты, лишённые характерных
для Т- и В-клеток поверхностных маркёрных
CD-детерминант, а также антигенраспознающих
Рц — TCR и BCR. Эти клетки играют важную
роль в механизмах доиммунной резистентности
организма (см. главу 3), уничтожают
трансформированные, инфицированные
вирусами и чужеродные клетки.
10 Виды иммунного ответа Как уже говорилось выше, иммунный ответ представляет собой реакцию организма на внедрение в него микробов или различных ядов. В целом, любое вещество, чья структура отличается от структуры тканей человека способно вызвать иммунный ответ. Исходя из механизмов, задействованных в его реализации, иммунный ответ может быть различным.
Во-первых, различаем специфический и неспецифический иммунный ответ. Неспецифический иммунный ответ - это первый этап борьбы с инфекцией он запускается сразу же после попадания микроба в наш организм. В его реализации задействованы система комплимента, лизоцим, тканевые макрофаги. Неспецифический иммунный ответ практически одинаков для всех типов микробов и подразумевает первичное разрушение микроба и формирование очага воспаления. Воспалительная реакция это универсальный защитный процесс, который направлен на предотвращение распространения микроба. Неспецифический иммунитет определяет общую сопротивляемость организма. Люди с ослабленным иммунитетом чаще болеют различными заболеваниями.
Специфический иммунитет это вторая фаза защитной реакции организма. Основной характеристикой специфического иммунного ответа является распознавание микроба и выработка факторов защиты направленных специально против него. Процессы неспецифического и специфического иммунного ответа пересекаются и во многом дополняют друг друга. Во время неспецифического иммунного ответа часть микробов разрушается, а их части выставляются на поверхности клеток (например, макрофагов). Во второй фазе иммунного ответа клетки иммунной системы (лимфоциты) распознают части микробов, выставленные на мембране других клеток, и запускают специфический иммунный ответ как таковой. Специфический иммунный ответ может быть двух типов: клеточный и гуморальный.
Клеточный иммунный ответ подразумевает формирование клона лимфоцитов (К-лимфоциты, цитотоксические лимфоциты), способных разрушать клетки мишени, мембраны которых содержат чужеродные материалы (например, вирусные белки).
Клеточный иммунитет задействован в ликвидации вирусной инфекции, а также таких типов бактериальных инфекций как туберкулез, проказа, риносклерома. Раковые клетки тоже разрушаются активированными лимфоцитами.
|
Гуморальный иммунный ответ опосредован В-лимфоцитами, которые после распознания микроба начинают активно синтезировать антитела по принципу один тип антигена – один тип антитела. На поверхности одного микроба может быть множество различных антигенов, поэтому обычно вырабатывается целая серия антител, каждое из которых при этом направлено на определенный антиген. Антитела (иммуноглобулины, Ig) – это молекулы белков, способные прилипать к определенной структуре микроорганизма, вызывая его разрушение или скорейшее выведение из организма. Теоретически возможно формирование антител против любого химического вещества, имеющего достаточно большую молекулярную массу. Существует несколько типов иммуноглобулинов, каждый из которых выполняет специфическую функцию. Иммуноглобулины типа А (IgA) синтезируются клетками иммунной системы и выводятся на поверхность кожи и слизистых оболочек. В больших количествах IgA содержатся во всех физиологических жидкостях (слюна, молоко, моча). Иммуноглобулины типа А обеспечивают местный иммунитет, препятствуя проникновению микробов через покровы тела и слизистые оболочки.
Иммуноглобулины типа M (IgM) выделяются в первое время после контакта с инфекцией. Эти антитела представляют собой большие комплексы способные связывать сразу несколько микробов одновременно. Определение IgM в крови является признаком развития в организме острого инфекционного процесса.
Антитела типа G (IgG) появляются вслед за IgM и представляют собой основной фактор гуморального иммунитета. Этот тип антител защищает организм на протяжении длительного времени от различных микроорганизмов.
Иммуноглобулины типа Е (IgE) участвуют в развитии аллергических реакций немедленного типа, тем самым защищая организм от проникновения микробов и ядов через кожу.
Антитела вырабатываются во время всех инфекционных болезней. Период развития гуморального иммунного ответа составляет примерно 2 недели. За это время в организме вырабатывается достаточное количество антител для нейтрализации инфекции.
Клоны цитотоксических лимфоцитов и В-лимфоцитов сохраняются в организме длительное время и при новом контакте с микроорганизмом запускают мощный иммунный ответ. Присутствие в организме активированных иммунных клеток и антител против определенных типов антигенов носит название сенсибилизация. Сенсибилизированный организм способен быстро ограничивать распространение инфекции, предупреждая развитие болезни.
Сила иммунного ответа Сила иммунного ответа зависит от реактивности организма, то есть от его способности реагировать на внедрение инфекции или ядов. Различаем несколько типов иммунного ответа в зависимости от его силы: нормоэргический, гипоэргический и гиперэргический (от греч. ergos – сила).
Нормоэргический ответ – соответствует силе агрессии со стороны микроорганизмов и приводит к их полному устранению. При нормоэргическом иммунном ответе повреждение тканей в ходе воспалительной реакции умеренно и не вызывает серьезных последствий для организма. Нормоэргический иммунный ответ характерен для людей с нормальной функцией иммунной системы.
Гипоэргический ответ – слабее агрессии со стороны микроорганизмов. Поэтому при таком типе ответа распространение инфекции ограничивается не полностью, а само инфекционное заболевание переходит в хроническую форму. Гипоэргический иммунный ответ характерен для детей и пожилых людей (у этой категории людей иммунная система работает недостаточно в силу возрастных особенностей), а также у лиц с первичными и вторичными иммунодефицитами.
Гиперэргический иммунный ответ развивается на фоне сенсибилизации организма по отношению к какому-либо антигену. Сила гиперэргического иммунного ответа во многом превышает силу агрессии микробов. В ходе гиперэргического иммунного ответа воспалительная реакция достигает значительных значений, что приводит к повреждению здоровых тканей организма. Возникновение гиперэргического иммунного ответа определяется особенностями микроорганизмов и конституциональными характеристиками самой иммунной системы организма. Гиперэргические иммунные реакции лежат в основе формирования аллергии.
