
- •Лидин р.А. Химия. Полный справочник для подготовки к егэ
- •Содержание
- •Предисловие
- •1. Распространенные элементы. Строение атомов. Электронные оболочки. Орбитали
- •Электроны заполняют орбитали, начиная с подуровня с меньшей энергией.
- •В каждой орбитали может разместиться не более двух электронов.
- •В пределах подуровня электроны сначала заполняют все орбитали наполовину, а затем – полностью.
- •Примеры заданий части а
- •4) Фосфор
- •2. Периодический закон. Периодическая система. Электроотрицательность. Степени окисления
- •Свойства элементов находятся в периодической зависимости от порядкового номера.
- •Примеры заданий частей а, в
- •3. Молекулы. Химическая связь. Строение веществ
- •Примеры заданий части а
- •4. Классификация и взаимосвязь неорганических веществ
- •Примеры заданий частей а, в, с
- •4) Хром
- •5. Металлы главных подгрупп I–III групп
- •5.1. Натрий
- •5.2. Калий
- •5.3. Кальций
- •5.4. Жёсткость воды
- •5.5. Алюминий
- •Примеры заданий части а
- •2) Кальций
- •6. Переходные металлы 4‑го периода. Свойства, способы получения. Общие свойства металлов
- •6.1. Хром
- •6.2. Марганец
- •6.3. Железо
- •Доменный процесс производства чугуна
- •Производство стали
- •6.4. Общие свойства металлов. Коррозия
- •Примеры заданий части a
- •4) Железо
- •7. Неметаллы главных подгрупп IV–VII групп
- •7.1. Водород
- •7.2. Галогены
- •7.2.1. Хлор. Хлороводород
- •7.2.2. Хлориды
- •7.2.3. Гипохлориты. Хлораты
- •7.2.4. Бромиды. Иодиды
- •7.3. Халькогены
- •7.3.1. Кислород
- •7.3.2. Сера. Сероводород. Сульфиды
- •7.3.3. Диоксид серы. Сульфиты
- •7.3.4. Серная кислота. Сульфаты
- •7.4. Неметаллы va‑группы
- •7.4.1. Азот. Аммиак
- •7.4.2. Оксиды азота. Азотная кислота
- •7.4.3. Нитриты. Нитраты
- •7.4.4. Фосфор
- •7.5. Неметаллы iva‑группы
- •7.5.1. Углерод в свободном виде
- •7.5.2. Оксиды углерода
- •7.5.3. Карбонаты
- •7.5.4. Кремний
- •Примеры заданий части а
- •1) Водород
- •8. Теория строения, многообразие, классификация и номенклатура органических соединений. Типы химических реакций
- •Примеры заданий частей а, в
- •9. Углеводороды. Гомология и изомерия. Химические свойства и способы получения
- •9.1. Алканы. Циклоалканы
- •3), Формула совпадает с таковой для алкенов. Важнейшие циклоалканы:
- •9.2. Алкены. Алкадиены
- •9.3. Алкины
- •9.4. Арены
- •Примеры заданий частей а, в
- •4. Алкины
- •6. Арены
- •10. Кислородсодержащие органические соединения
- •10.1. Спирты. Простые эфиры. Фенолы
- •10.2. Альдегиды и кетоны
- •10.3. Карбоновые кислоты. Сложные эфиры. Жиры
- •10.4. Углеводы
- •Примеры заданий частей а, в
- •1) Кислород
- •11. Азотсодержащие органические соединения
- •11.1. Нитросоединения. Амины
- •11.2. Аминокислоты. Белки
- •Примеры заданий частей а, в, с
- •12. Химические реакции. Скорость, энергетика и обратимость
- •12.1. Скорость реакций
- •Скорость химической реакции прямо пропорциональна произведению молярных концентраций реагентов
- •12.2. Энергетика реакций
- •12.3. Обратимость реакций
- •При воздействии на равновесную систему химическое равновесие смещается в сторону, противодействующую этому воздействию.
- •Примеры заданий части а
- •13. Водные растворы. Растворимость и диссоциация веществ. Ионный обмен. Гидролиз солей
- •13.1. Растворимость веществ в воде
- •13.2. Электролитическая диссоциация
- •13.3. Диссоциация воды. Среда растворов
- •13.4. Реакции ионного обмена
- •13.5. Гидролиз солей
- •Примеры заданий частей а, в
- •14. Окислительно‑восстановительные реакции. Электролиз
- •14.1. Окислители и восстановители
- •14.2. Подбор коэффициентов методом электронного баланса
- •14.3. Ряд напряжений металлов
- •14.4. Электролиз расплава и раствора
- •Примеры заданий частей а, в, с
- •15. Решение расчетных задач
- •15.1. Массовая доля растворенного вещества. Разбавление, концентрирование и смешивание растворов
- •Примеры решения задач
- •Задания для самостоятельного решения части в
- •15.2. Объемное отношение газов
- •Пример решения задачи
- •Задания для самостоятельного решения части а
- •15.3. Масса вещества (объем газа) по известному количеству другого реагента (продукта) Примеры решения задачи
- •Задания для самостоятельного решения части в
- •15.4. Тепловой эффект реакции Пример решения задачи части в
- •Задания для самостоятельного решения части а
- •15.5. Масса (объем, количество вещества) продукта по реагенту в избытке или с примесями
- •Пример решения задачи
- •Задания для самостоятельного решения частей в, с
- •15.6. Масса (объем, количество вещества) продукта по реагенту с известной массовой долей в растворе Пример решения задачи
- •Задания для самостоятельного решения частей в, с
- •15.7. Нахождение молекулярной формулы органического соединения
- •Примеры решения задач
- •Задания для самостоятельного решения части с
- •Раздел 15
Примеры заданий частей а, в, с
1. Простые вещества – это
1) фуллерен
2) этилен
3) ацетон
4) озон
2. В формульных единицах продуктов реакций
Si + CF12 →…, Si + O2 →…, Si + Mg →…
общая сумма числа атомов всех элементов равна
1) 8
2) 9
3) 10
4) 11
3. В металлсодержащих продуктах реакций
Na + Н2O →…, Са + Н2O →…, Al + НCl (р‑р) →…
общая сумма числа атомов всех элементов равна
1) 6
2) 8
3) 10
4) 12
4. Оксид кальция может реагировать (по отдельности) со всеми веществами набора
1) СO2, NaOH, NO
2) HBr, SO3, NH4Cl
3) BaO, SO3, KMgCl3
4) O2, Al2O3, NH3
5. Будет протекать реакция между оксидом серы (IV) и
1) SiO2
2) КCl
3) LiOH
4) NaNO3
6. Соль МAlO2 образуется при сплавлении
1) Al и ZnO
2) Al2O3 и КОН
3) Al и Са(ОН)2
4) Al2O3 и Fe2O3
7. В молекулярном уравнении реакции
ZnO + HNO3 → Zn(NO3)2 +…
сумма коэффициентов равна
1) 4
2) 5
3) 6
4) 7
8. Продукты реакции N2O5 + NaOH →… – это
1) Na2O, HNO3
2) NaOH, NH3
3) NaNO3, H2O
4) NaNO2, N2, H2O
9. Набор оснований – это
1) NaOH, LiOH, ClOH
2) NaOH, Ba(OH)2, Cu(OH)2
3) Ca(OH)2, KOH, BrOH
4) Mg(OH)2, Be(OH)2, NO(OH)
10. Гидроксид калия реагирует в растворе (по отдельности) с веществами набора
1) СО, CuSO4
2) SO2, Ag
3) Al, Ba(OH)2
4) SO3, FeCl3
11–12. Остаток, отвечающий кислоте с названием
11. Серная
12. Азотная
имеет формулу
1) NO2‑
2) SO42‑
3) NO3‑
4) SO32‑
13. Из соляной и разбавленной серной кислот не выделяет газ только металл
1) ртуть
2) цинк
3) магний
4) Хром
14. Амфотерный гидроксид – это
1) Ва(ОН)2
2) CsOH
3) Ni(OH)2
4) Cr(OH)3
15‑16. По заданным формулам гидроксидов
15. H3PO4, РЬ(ОН)2
16. Cr(OH)3, HNO3
выводится формула средней соли
1) РЬ3(РO4)2
2) РЬ3РO4
3) Cr2NO3
4) Cr(NO3)3
17. После пропускания избытка H2S через раствор гидроксида бария в конечном растворе будет содержаться соль
1) Ba(HS)2
2) (BaOH)2S
3) BaS
4) BaSO3
18. Возможно протекание реакций:
1) CaSO3 + H2SO4 →…
2) Ca(NO3)2 + HNO3 →…
3) NaHCOg + K2SO4 →…
4) Al(HSO4)3 + NaOH →…
19. В уравнении реакции (СаOН)2СO3(т) + Н3РO4 → СаНРO4↓ +…
сумма коэффициентов равна
1) 6
2) 5
3) 9
4) 8
20. Установите соответствие между формулой вещества и группой, к которой оно относится.

21. Установите соответствие между исходными веществами и продуктами реакций.

22. В схеме превращений
![]()
вещества А и Б указаны в наборе
1) NaNO3, Н2O
2) HNO3, КОН
3) N2O, NaOH
4) HNO3, Н2O
23. Составьте уравнения возможных реакций по схеме
FeS → H2S + PbS → PbSO4 → Pb(HSO4)2
24. Составьте уравнения четырех возможных реакций между веществами:
1) азотная кислота (конц.)
2) углерод (графит или кокс)
3) оксид кальция
4) оксид железа(II)
5. Металлы главных подгрупп I–III групп
5.1. Натрий
Натрий – элемент 3‑го периода и IA‑группы Периодической системы, порядковый номер 11. Электронная формула атома [10Ne]3s1, степени окисления +I и 0. Имеет малую электроотрицательность (0,93), проявляет только металлические (основные) свойства. Образует (как катион) многочисленные соли и бинарные соединения. Почти все соли натрия хорошо растворимы в воде.
В природе – пятый по химической распространенности элемент (второй среди металлов), встречается только в виде соединений. Жизненно важный элемент для всех организмов.
Натрий, катион натрия и его соединения окрашивают пламя газовой горелки в ярко‑желтый цвет (качественное обнаружение).
Натрий Na. Серебристо‑белый металл, легкий, мягкий (режется ножом), низкоплавкий. Хранят натрий в керосине. С ртутью образует жидкий сплав – амальгаму (до 0,2 % Na).
Весьма реакционноспособный, во влажном воздухе натрий медленно покрывается гидроксидной пленкой и теряет блеск (тускнеет):
![]()
Натрий химически активен, сильный восстановитель. Воспламеняется на воздухе при умеренном нагревании (>250 °C), реагирует с неметаллами:
2Na + O2 = Na2O2 2Na + H2 = 2NaH
2Na + Cl2 = 2NaCl 2Na + S = Na2S
6Na + N2 = 2Na3N 2Na + 2C = Na2C2
Очень бурно и с большим экзо‑эффектом натрий реагирует с водой:
2Na + 2H2O = 2NaOH + Н2↑ + 368 кДж
От теплоты реакции кусочки натрия расплавляются в шарики, которые начинают беспорядочно двигаться из‑за выделения Н2. Реакция сопровождается резкими щелчками вследствие взрывов гремучего газа (Н2 + O2). Раствор окрашивается фенолфталеином в малиновый цвет (щелочная среда).
В ряду напряжений натрий стоит значительно левее водорода, из разбавленных кислот HCl и H2SO4 вытесняет водород (за счет Н2O и Н+).
Получение натрия в промышленности:
![]()
(см. также ниже получение NaOH).
Натрий применяется для получения Na2O2, NaOH, NaH, а также в органическом синтезе. Расплавленный натрий служит теплоносителем в ядерных реакторах, а газообразный – используется как наполнитель желтосветных ламп наружного освещения.
Оксид натрия Na2O. Основный оксид. Белый, имеет ионное строение (Na+)2O2‑. Термически устойчивый, при прокаливании медленно разлагается, плавится под избыточным давлением пара Na. Чувствителен к влаге и углекислому газу в воздухе. Энергично реагирует с водой (образуется сильнощелочной раствор), кислотами, кислотными и амфотерными оксидами, кислородом (под давлением). Применяется для синтеза солей натрия. Не образуется при сжигании натрия на воздухе.
Уравнения важнейших реакций:
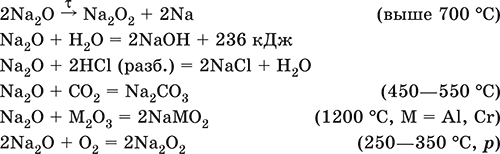
Получение: термическое разложение Na2O2 (см.), а также сплавление Na и NaOH, Na и Na2O2:
2Na + 2NaOH = 2NaaO + H2 (600 °C)
2Na + Na2O2 = 2NaaO (130–200 °C)
Пероксид натрия Na2O2. Бинарное соединение. Белый, гигроскопичный. Имеет ионное строение (Na+)2O22‑. При нагревании разлагается, плавится под избыточным давлением O2. Поглощает углекислый газ из воздуха. Полностью разлагается водой, кислотами (выделение O2 при кипячении – качественная реакция на пероксиды). Сильный окислитель, слабый восстановитель. Применяется для регенерации кислорода в изолирующих дыхательных приборах (реакция с СO2), как компонент отбеливателей ткани и бумаги. Уравнения важнейших реакций:
2Na2O2 = 2Na2O + O2 (400–675 °C, вакуум)
Na2O2 + 2Н2O = Н2O2 + 2NaOH (на холоду)
2Na2O2 + 2Н2O = O2↑ + 4NaOH (кипячение)
Na2O2 + 2НCl (разб.) = 2NaCl + Н2O2 (на холоду)
2Na2O2 + 4НCl (разб.) = 4НCl + 2Н2O + O2↑ (кипячение)
2Na2O2 + 2CO2 = Na2CO3 + O2
Na2O2 + CO = Na2CO3
Na2O2 + 4H+ + 2I‑ = I2↓ + 2H2O + 2Na+
5Na2O2 + 16H+ + 2MnO4‑ = 5O2↑ + 2Mn2+ + 8H2O + 10Na+
3Na2O2 + 2[Cr(OH)6]3‑ = 2CrO24‑ + 8OH‑ + 2H2O + 6Na+ (80 °C)
Получение: сжигание Na на воздухе.
Гидроксид натрия NaOH. Основный гидроксид, щелочь, техническое название едкий натр. Белые кристаллы с ионным строением (Na+)(OH‑). Расплывается на воздухе, поглощая влагу и углекислый газ (образуется NaHCO3). Плавится и кипит без разложения. Вызывает тяжелые ожоги кожи и глаз.
Хорошо растворим в воде (с экзо‑эффектом, +56 кДж). Реагирует с кислотными оксидами, нейтрализует кислоты, вызывает кислотную функцию у амфотерных оксидов и гидроксидов:
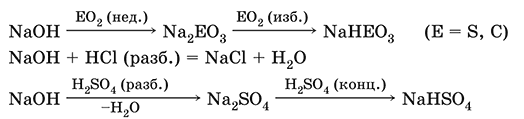
NaOH (разб.) + H3PO4 (конц.) = NaH2PO4 + H2O
2NaOH (разб.) + H3PO4 (разб.) = Na2HPO4 + 2H2O
3NaOH (конц.) + H3PO4 (разб.) = Na3PO4 + 3H2O
2NaOH(T) + M2O3 = 2NaMO2 + H2O (1000 °C, M = Al, Cr)
2NaOH (конц.) + 3H2O + AI2O3 = 2Na[Al(OH)4] (кипячение)
2NaOH(T) + M(OH)2 = Na2MO2 + 2H2O (500 °C, M = Be, Zn)
2NaOH (конц.) + Zn(OH)2 = Na2[Zn(OH)4]
Осаждает нерастворимые гидроксиды:
2NaOH + MCl2 = 2NaCl + M(OH)2↓ (M = Mg, Cu)
Подвергает дисмутации галогены и серу:
2NaOH (конц., хол.) + Е2 = NaE + NaEO + H2O (Е = Cl, Br)
6NaOH (разб., гор.) + 3S = 2Na2S + Na2SO3 + 3H2O
Подвергается электролизу в расплаве:
![]()
Раствор NaOH разъедает стекло (образуется NaSiO3), корродирует поверхность алюминия (образуются Na[Al(OH)4] и Н2).
Получение NaOH в промышленности:
а) электролиз раствора NaCl на инертном катоде:
![]()
б) электролиз раствора NaCl на ртутном катоде (амальгамный способ):

(освобождающуюся ртуть возвращают в электролизер).
Едкий натр – важнейшее сырье химической промышленности. Используется для получения солей натрия, целлюлозы, мыла, красителей и искусственного волокна; как осушитель газов; реагент в извлечении из вторичного сырья и очистке олова и цинка; при переработке руд алюминия (бокситов).
