
- •Лидин р.А. Химия. Полный справочник для подготовки к егэ
- •Содержание
- •Предисловие
- •1. Распространенные элементы. Строение атомов. Электронные оболочки. Орбитали
- •Электроны заполняют орбитали, начиная с подуровня с меньшей энергией.
- •В каждой орбитали может разместиться не более двух электронов.
- •В пределах подуровня электроны сначала заполняют все орбитали наполовину, а затем – полностью.
- •Примеры заданий части а
- •4) Фосфор
- •2. Периодический закон. Периодическая система. Электроотрицательность. Степени окисления
- •Свойства элементов находятся в периодической зависимости от порядкового номера.
- •Примеры заданий частей а, в
- •3. Молекулы. Химическая связь. Строение веществ
- •Примеры заданий части а
- •4. Классификация и взаимосвязь неорганических веществ
- •Примеры заданий частей а, в, с
- •4) Хром
- •5. Металлы главных подгрупп I–III групп
- •5.1. Натрий
- •5.2. Калий
- •5.3. Кальций
- •5.4. Жёсткость воды
- •5.5. Алюминий
- •Примеры заданий части а
- •2) Кальций
- •6. Переходные металлы 4‑го периода. Свойства, способы получения. Общие свойства металлов
- •6.1. Хром
- •6.2. Марганец
- •6.3. Железо
- •Доменный процесс производства чугуна
- •Производство стали
- •6.4. Общие свойства металлов. Коррозия
- •Примеры заданий части a
- •4) Железо
- •7. Неметаллы главных подгрупп IV–VII групп
- •7.1. Водород
- •7.2. Галогены
- •7.2.1. Хлор. Хлороводород
- •7.2.2. Хлориды
- •7.2.3. Гипохлориты. Хлораты
- •7.2.4. Бромиды. Иодиды
- •7.3. Халькогены
- •7.3.1. Кислород
- •7.3.2. Сера. Сероводород. Сульфиды
- •7.3.3. Диоксид серы. Сульфиты
- •7.3.4. Серная кислота. Сульфаты
- •7.4. Неметаллы va‑группы
- •7.4.1. Азот. Аммиак
- •7.4.2. Оксиды азота. Азотная кислота
- •7.4.3. Нитриты. Нитраты
- •7.4.4. Фосфор
- •7.5. Неметаллы iva‑группы
- •7.5.1. Углерод в свободном виде
- •7.5.2. Оксиды углерода
- •7.5.3. Карбонаты
- •7.5.4. Кремний
- •Примеры заданий части а
- •1) Водород
- •8. Теория строения, многообразие, классификация и номенклатура органических соединений. Типы химических реакций
- •Примеры заданий частей а, в
- •9. Углеводороды. Гомология и изомерия. Химические свойства и способы получения
- •9.1. Алканы. Циклоалканы
- •3), Формула совпадает с таковой для алкенов. Важнейшие циклоалканы:
- •9.2. Алкены. Алкадиены
- •9.3. Алкины
- •9.4. Арены
- •Примеры заданий частей а, в
- •4. Алкины
- •6. Арены
- •10. Кислородсодержащие органические соединения
- •10.1. Спирты. Простые эфиры. Фенолы
- •10.2. Альдегиды и кетоны
- •10.3. Карбоновые кислоты. Сложные эфиры. Жиры
- •10.4. Углеводы
- •Примеры заданий частей а, в
- •1) Кислород
- •11. Азотсодержащие органические соединения
- •11.1. Нитросоединения. Амины
- •11.2. Аминокислоты. Белки
- •Примеры заданий частей а, в, с
- •12. Химические реакции. Скорость, энергетика и обратимость
- •12.1. Скорость реакций
- •Скорость химической реакции прямо пропорциональна произведению молярных концентраций реагентов
- •12.2. Энергетика реакций
- •12.3. Обратимость реакций
- •При воздействии на равновесную систему химическое равновесие смещается в сторону, противодействующую этому воздействию.
- •Примеры заданий части а
- •13. Водные растворы. Растворимость и диссоциация веществ. Ионный обмен. Гидролиз солей
- •13.1. Растворимость веществ в воде
- •13.2. Электролитическая диссоциация
- •13.3. Диссоциация воды. Среда растворов
- •13.4. Реакции ионного обмена
- •13.5. Гидролиз солей
- •Примеры заданий частей а, в
- •14. Окислительно‑восстановительные реакции. Электролиз
- •14.1. Окислители и восстановители
- •14.2. Подбор коэффициентов методом электронного баланса
- •14.3. Ряд напряжений металлов
- •14.4. Электролиз расплава и раствора
- •Примеры заданий частей а, в, с
- •15. Решение расчетных задач
- •15.1. Массовая доля растворенного вещества. Разбавление, концентрирование и смешивание растворов
- •Примеры решения задач
- •Задания для самостоятельного решения части в
- •15.2. Объемное отношение газов
- •Пример решения задачи
- •Задания для самостоятельного решения части а
- •15.3. Масса вещества (объем газа) по известному количеству другого реагента (продукта) Примеры решения задачи
- •Задания для самостоятельного решения части в
- •15.4. Тепловой эффект реакции Пример решения задачи части в
- •Задания для самостоятельного решения части а
- •15.5. Масса (объем, количество вещества) продукта по реагенту в избытке или с примесями
- •Пример решения задачи
- •Задания для самостоятельного решения частей в, с
- •15.6. Масса (объем, количество вещества) продукта по реагенту с известной массовой долей в растворе Пример решения задачи
- •Задания для самостоятельного решения частей в, с
- •15.7. Нахождение молекулярной формулы органического соединения
- •Примеры решения задач
- •Задания для самостоятельного решения части с
- •Раздел 15
Примеры заданий части а
1. Хлор можно собрать
1) в пробирку отверстием вниз
2) в пробирку отверстием вверх
3) над раствором хлорида кальция
4) над водой
2. Пропускают хлор через горячий раствор едкого кали и получают набор продуктов
1) КCl, O2
2) КCl, КClO
3) КCl, Н2
4) КClO3, КCl
3. Возможно протекание реакции в растворе между веществами
1) КBr + I2 →…
2) КBr + Cl2 →…
3) КCl + I2 →…
4) КCl + Br2 →…
4. Окислительная способность в ряду O2 – O3 – О0
1) возрастает
2) убывает
3) не изменяется
4) не знаю
5. При действии концентрированным раствором щелочи на серу образуется набор солей
1) сульфат, сульфид
2) сульфат, сульфит
3) сероводород, серная кислота
4) сульфит, сульфид
6. Концентрированная серная кислота реагирует (по отдельности) с веществами набора
1) KHSO4, K2SO4
2) Fe, Cu(NO3)2
3) Ag, SO2
4) КНСO3, С (графит)
7. Азот образуется при прокаливании солей
1) NH4NO2
2) NH4HCO3
3) NH4NO3
4) (NH4)2Cr2O7
8. В уравнении реакции NH3 + O2 → NO +… коэффициент у формулы окислителя равен
1) 6
2) 5
3) 4
4) 3
9. Нельзя проводить осушку газа NH3 с помощью
1) СаО (тв.)
2) NaOH (тв.)
3) H2SO4 (конц.)
4) Р2O5 (тв.)
10. Две соли разных кислот образуются при взаимодействии между щелочью и
1) диоксидом углерода
2) триоксидом серы
3) оксидом хлора (VII)
4) оксидом азота (IV)
11. Один газ образуется при прокаливании
1) Cu(NO3)2
2) Pb(NO3)2
3) AgNO3
4) KNO3
12. Ортофосфорную кислоту в промышленности получают по реакции
1) Са3(РO4)2 + H2SO4 (конц.) →…
2) К3РO4 + H2SO4 (разб.) →…
3) Р2O5 + Н2O →…
4) Na3PO4 + СаCl2 →…
13. Углекислый газ, растворенный в воде, реагирует (по отдельности) с веществами набора
1) К2СO3, К3РO4
2) KNO2, NH4Cl
3) K2SiO3, К2СO3
4) K2SO4, КОН
14. Реагенты для получения чистого гидрокарбоната калия – это набор
1) KNO3, Н2O, СO2
2) K2SO4, Ва(НСO3)2
3) К2СO3, Н2O
4) КОН, СаСO3
15. Цинк из концентрированного раствора карбоната калия вытесняет
1) Водород
2) угарный газ
3) метан
4) углекислый газ
16. Влажную смесь газов SO2 + O2 + NH3 + С2Н2 пропустили через склянку с H2SO4 (конц.), затем – через склянку с гранулами NaOH. При этом на выходе собрали набор газов
1) NH3, С2Н2
2) SO2, O2
3) SO2, NH3
4) O2, С2Н2
17. Для обнаружения хлорид‑иона подходит реактив
1) раствор крахмала
2) раствора нитрата серебра(I)
3) разбавленная серная кислота
4) концентрированный раствор щелочи
18. Для распознавания Na2CO3 и Na2SiO3 можно использовать раствор
1) азотной кислоты
2) индикатора
3) хлорида бария
4) гидроксида натрия
19–22. Бесцветный раствор соли
19. иодид алюминия
20. гидросульфат калия
21. хлорид бария
22. фторид натрия окрасится метилоранжем в цвет
1) оранжевый
2) желтый
3) синий
4) розовый
8. Теория строения, многообразие, классификация и номенклатура органических соединений. Типы химических реакций
Многообразие органических соединений, их свойств и превращений объясняет теория химического строения (А. М. Бутлеров, 1861–1864).
Химическое строение – это определенная последовательность расположения атомов в молекуле. Строение молекулы органического соединения изображается структурной формулой (развернутой или сокращенной), в которой символы связанных атомов соединяются валентной чертой, например, для этанола С2Н5ОН:
развернутая структурная формула
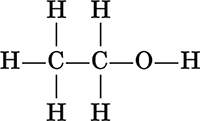
сокращенная структурная формула
СН3–СН2–ОН
Часто одинарные связи вообще не указывают: СН3СН2ОН
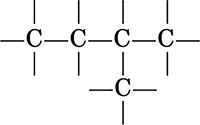
По строению различают ациклические и циклические органические соединения.
Ациклические соединения характеризуются открытой цепью атомов углерода:
а) насыщенные соединения (с одинарными связями С – С)
б) ненасыщенные соединения (с кратными связями C=C и C≡C)
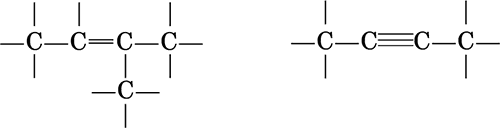
Ациклические соединения могут содержать как прямую цепь атомов углерода, так и разветвленную. Различают атомы углерода:
первичный, соединен с одним другим атомом углерода;
вторичный, соединен с двумя атомами углерода;
третичный, соединен с тремя атомами углерода;
четвертичный, соединен с четырьмя атомами углерода.
Прямая углеродная цепь состоит только из первичных и вторичных атомов углерода, разветвленная цепь содержит также третичные и четвертичные атомы.
Пример:
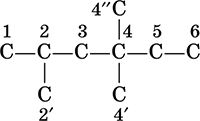
1, 2', 4', 4", 6 – первичные атомы
2 – третичный атом
3, 5 – вторичные атомы
4 – четвертичный атом
Циклические соединения имеют замкнутую в цикл цепь атомов углерода:
а) алициклические соединения (циклические соединения неароматического характера)
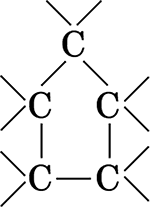
б) ароматические соединения (производные бензола)

Химические свойства органических соединений зависят не только от состава вещества (числа атомов элементов), но и от его химического строения. Один и тот же состав может соответствовать нескольким органическим соединениям с разным строением и, соответственно, разными свойствами; это явление называется изомерией:
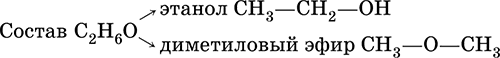
Такие вещества называют структурными изомерами или изомерами строения.
Органические соединения образованы главным образом ковалентными связями. Если ковалентная связь полярна, электронная плотность оказывается смещенной в сторону более электроотрицательного атома. Вследствие этого на атомах появляются частичные заряды – положительный (δ+) и отрицательный (‑δ):
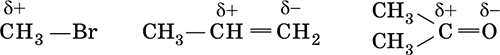
Химические реакции, типичные для органических соединений, можно классифицировать по различным признакам:
1) по типу химического превращения:
– реакции замещения, сопровождающиеся образованием новых ковалентных связей при замещении одного атома (или группы атомов) на другие атомы или группы атомов:
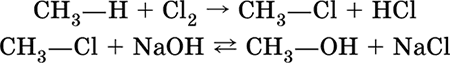
– реакции присоединения (синтез), сопровождающиеся образованием новых о‑связей за счет разрыва π‑связи:
![]()
– реакции разложения, сопровождающиеся образованием новых, более простых по составу молекул:
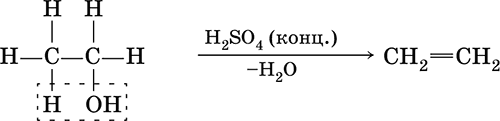
2) по способу разрыва связи:
– реакции с образованием радикалов, сопровождающиеся симметричным разрывом связи между атомами элементов с одинаковой электроотрицательностью (гемолитический разрыв):
![]()
– реакции с образованием ионов, сопровождающиеся несимметричным разрывом связи (гетеролитический разрыв):
![]()
Все органические соединения делятся на классы. Принадлежность соединения к тому или иному классу определяется наличием в его составе функциональных групп – групп атомов, обусловливающих характерные химические свойства данного класса соединений. К функциональным группам принадлежат:
![]()
Углеводороды не имеют функциональных групп.
Группа атомов органического соединения, которая во многих реакциях может переходить в молекулу продукта не изменяясь, называется радикалом и обозначается R, например метильный радикал – СН3.
Углеводороды (состоят только из атомов С и Н) и их производные образуют гомологические ряды, члены которых имеют сходные строение и свойства; они отличаются друг от друга на одну или несколько групп СН2 (гомологическая разность).
Классификация органических соединений представлена в табл. 8.
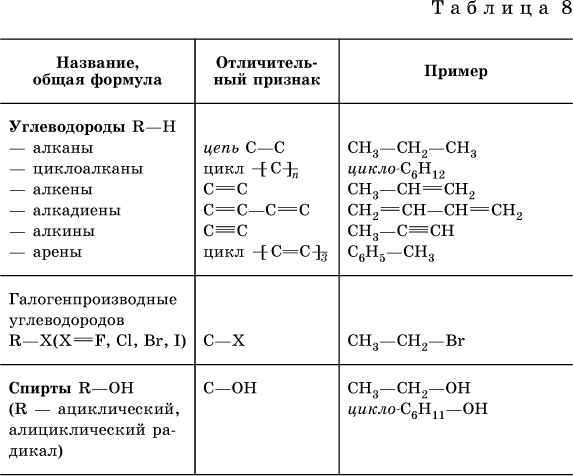

Подробные сведения о номенклатуре органических соединений см. в разд. 9–11.
