
- •Лидин р.А. Химия. Полный справочник для подготовки к егэ
- •Содержание
- •Предисловие
- •1. Распространенные элементы. Строение атомов. Электронные оболочки. Орбитали
- •Электроны заполняют орбитали, начиная с подуровня с меньшей энергией.
- •В каждой орбитали может разместиться не более двух электронов.
- •В пределах подуровня электроны сначала заполняют все орбитали наполовину, а затем – полностью.
- •Примеры заданий части а
- •4) Фосфор
- •2. Периодический закон. Периодическая система. Электроотрицательность. Степени окисления
- •Свойства элементов находятся в периодической зависимости от порядкового номера.
- •Примеры заданий частей а, в
- •3. Молекулы. Химическая связь. Строение веществ
- •Примеры заданий части а
- •4. Классификация и взаимосвязь неорганических веществ
- •Примеры заданий частей а, в, с
- •4) Хром
- •5. Металлы главных подгрупп I–III групп
- •5.1. Натрий
- •5.2. Калий
- •5.3. Кальций
- •5.4. Жёсткость воды
- •5.5. Алюминий
- •Примеры заданий части а
- •2) Кальций
- •6. Переходные металлы 4‑го периода. Свойства, способы получения. Общие свойства металлов
- •6.1. Хром
- •6.2. Марганец
- •6.3. Железо
- •Доменный процесс производства чугуна
- •Производство стали
- •6.4. Общие свойства металлов. Коррозия
- •Примеры заданий части a
- •4) Железо
- •7. Неметаллы главных подгрупп IV–VII групп
- •7.1. Водород
- •7.2. Галогены
- •7.2.1. Хлор. Хлороводород
- •7.2.2. Хлориды
- •7.2.3. Гипохлориты. Хлораты
- •7.2.4. Бромиды. Иодиды
- •7.3. Халькогены
- •7.3.1. Кислород
- •7.3.2. Сера. Сероводород. Сульфиды
- •7.3.3. Диоксид серы. Сульфиты
- •7.3.4. Серная кислота. Сульфаты
- •7.4. Неметаллы va‑группы
- •7.4.1. Азот. Аммиак
- •7.4.2. Оксиды азота. Азотная кислота
- •7.4.3. Нитриты. Нитраты
- •7.4.4. Фосфор
- •7.5. Неметаллы iva‑группы
- •7.5.1. Углерод в свободном виде
- •7.5.2. Оксиды углерода
- •7.5.3. Карбонаты
- •7.5.4. Кремний
- •Примеры заданий части а
- •1) Водород
- •8. Теория строения, многообразие, классификация и номенклатура органических соединений. Типы химических реакций
- •Примеры заданий частей а, в
- •9. Углеводороды. Гомология и изомерия. Химические свойства и способы получения
- •9.1. Алканы. Циклоалканы
- •3), Формула совпадает с таковой для алкенов. Важнейшие циклоалканы:
- •9.2. Алкены. Алкадиены
- •9.3. Алкины
- •9.4. Арены
- •Примеры заданий частей а, в
- •4. Алкины
- •6. Арены
- •10. Кислородсодержащие органические соединения
- •10.1. Спирты. Простые эфиры. Фенолы
- •10.2. Альдегиды и кетоны
- •10.3. Карбоновые кислоты. Сложные эфиры. Жиры
- •10.4. Углеводы
- •Примеры заданий частей а, в
- •1) Кислород
- •11. Азотсодержащие органические соединения
- •11.1. Нитросоединения. Амины
- •11.2. Аминокислоты. Белки
- •Примеры заданий частей а, в, с
- •12. Химические реакции. Скорость, энергетика и обратимость
- •12.1. Скорость реакций
- •Скорость химической реакции прямо пропорциональна произведению молярных концентраций реагентов
- •12.2. Энергетика реакций
- •12.3. Обратимость реакций
- •При воздействии на равновесную систему химическое равновесие смещается в сторону, противодействующую этому воздействию.
- •Примеры заданий части а
- •13. Водные растворы. Растворимость и диссоциация веществ. Ионный обмен. Гидролиз солей
- •13.1. Растворимость веществ в воде
- •13.2. Электролитическая диссоциация
- •13.3. Диссоциация воды. Среда растворов
- •13.4. Реакции ионного обмена
- •13.5. Гидролиз солей
- •Примеры заданий частей а, в
- •14. Окислительно‑восстановительные реакции. Электролиз
- •14.1. Окислители и восстановители
- •14.2. Подбор коэффициентов методом электронного баланса
- •14.3. Ряд напряжений металлов
- •14.4. Электролиз расплава и раствора
- •Примеры заданий частей а, в, с
- •15. Решение расчетных задач
- •15.1. Массовая доля растворенного вещества. Разбавление, концентрирование и смешивание растворов
- •Примеры решения задач
- •Задания для самостоятельного решения части в
- •15.2. Объемное отношение газов
- •Пример решения задачи
- •Задания для самостоятельного решения части а
- •15.3. Масса вещества (объем газа) по известному количеству другого реагента (продукта) Примеры решения задачи
- •Задания для самостоятельного решения части в
- •15.4. Тепловой эффект реакции Пример решения задачи части в
- •Задания для самостоятельного решения части а
- •15.5. Масса (объем, количество вещества) продукта по реагенту в избытке или с примесями
- •Пример решения задачи
- •Задания для самостоятельного решения частей в, с
- •15.6. Масса (объем, количество вещества) продукта по реагенту с известной массовой долей в растворе Пример решения задачи
- •Задания для самостоятельного решения частей в, с
- •15.7. Нахождение молекулярной формулы органического соединения
- •Примеры решения задач
- •Задания для самостоятельного решения части с
- •Раздел 15
Примеры заданий части а
1. Гетерогенные реакции – это
1) Н2 + I2(г) → HI
2) Fe2(SO4)3(т) → Fe2O3(T) + SO3
3) Zn + H2SO4 → ZnSO4 + H2↑
4) CO + H2 → CO + H2O (nap)
2. При взаимодействии H2 с Cl2, Br2 и I2 в сосудах равного объема через 27 с образуется по 0,04 моль продуктов. Скорость реакции
1) выше для I2
2) выше для Cl2
3) одинакова
4) выше для Br2
3. Для гомогенной реакции А + В →… при одновременном увеличении молярной концентрации исходных веществ в 3 раза скорость реакции возрастет
1) в 2 раза
2) в 3 раза
3) в 6 раз
4) в 9 раз
4–6. Скорость реакции
4. 2CuО(т) + СО →…
5. 2FeO(т) + С(т) →…
6. N2 + 2С(т) + Н2 →…
при V = const и увеличении количества веществ в 4 раза изменится так:
1) возрастет в 4 раза
2) возрастет в 8 раз
3) возрастет в 16 раз
4) не изменится
7–8. Равновесие смещается вправо (→) при
7. нагревании
8. охлаждении реакционных систем
1) 2СО + O2 ![]()
2СO2 + Q
2) 2HI +
Н2 + I2 – Q
3) N2 + O2
2NO – Q
4) 2Н2 + O2
2Н2O + Q
9. Равновесие реакции этерификации СН3СООН + С2Н5ОН
СН3СООС2Н5 + Н2O + Q
можно сдвинуть вправо (→)
1) добавлением серной кислоты
2) добавлением едкого натра
3) нагреванием
4) добавлением воды
10. Равновесие в гетерогенной реакции СаО(ст) + СО2
СаСO3(т) + Q сместится влево (←) при
1) добавлении СаО
2) добавлении СаСO3
3) сжатии
4) нагревании
11. Выход продукта в реакции CaS(т) + 2O2
CaSO4(т) + Q
можно увеличить
1) добавлением CaS
2) нагреванием
3) введением катализатора
4) повышением давления
12. Доменный процесс Fe2O3 + ЗСО
2Fe + ЗСO2 сопровождается экзо‑эффектом, следовательно, при охлаждении выход продуктов
1) увеличивается
2) уменьшается
3) не изменяется
4) не знаю
13. Водные растворы. Растворимость и диссоциация веществ. Ионный обмен. Гидролиз солей
13.1. Растворимость веществ в воде
Раствор – это гомогенная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах без нарушения однородности.
Водные растворы состоят из воды (растворителя) и растворенного вещества. Состояние веществ в водном растворе при необходимости обозначается нижним индексом (р), например, KNO3 в растворе – KNO3(p).
Растворы, которые содержат малое количество растворенного вещества, часто называют разбавленными, а растворы с высоким содержанием растворенного вещества – концентрированными. Раствор, в котором возможно дальнейшее растворение вещества, называется ненасыщенным, а раствор, в котором вещество перестает растворяться при данных условиях, – насыщенным. Последний раствор всегда находится в контакте (в гетерогенном равновесии) с нерастворившимся веществом (один кристалл или более).
В особых условиях, например при осторожном (без перемешивания) охлаждении горячего ненасыщенного раствора твердого вещества, может образоваться пересыщенный раствор. При введении кристалла вещества такой раствор разделяется на насыщенный раствор и осадок вещества.
В соответствии с химической теорией растворов Д. И. Менделеева растворение вещества в воде сопровождается, во‑первых, разрушением химических связей между молекулами (межмолекулярные связи в ковалентных веществах) или между ионами (в ионных веществах), и, таким образом, частицы вещества смешиваются с водой (в которой также разрушается часть водородных связей между молекулами). Разрыв химических связей совершается за счет тепловой энергии движения молекул воды, при этом происходит затрата энергии в форме теплоты.
Во‑вторых, попав в воду, частицы (молекулы или ионы) вещества подвергаются гидратации. В результате образуются гидраты – соединения неопределенного состава между частицами вещества и молекулами воды (внутренний состав самих частиц вещества при растворении не изменяется). Такой процесс сопровождается выделением энергии в форме теплоты за счет образования новых химических связей в гидратах.
В целом раствор либо охлаждается (если затрата теплоты превосходит ее выделение), либо нагревается (в противном случае); иногда – при равенстве затраты теплоты и ее выделения – температура раствора остается неизменной.
Многие гидраты оказываются настолько устойчивыми, что не разрушаются и при полном выпаривании раствора. Так, известны твердые кристаллогидраты солей CuSO4 5Н2O, Na2CO3 • 10Н2O, KAl(SO4)2 • 12Н2O и др.
Содержание вещества в насыщенном растворе при Т = const количественно характеризует растворимость этого вещества. Обычно растворимость выражается массой растворенного вещества, приходящейся на 100 г воды, например 65,2 г КBr/100 г Н2O при 20 °C. Следовательно, если 70 г твердого бромида калия ввести в 100 г воды при 20 °C, то 65,2 г соли перейдет в раствор (который будет насыщенным), а 4,8 г твердого КBr (избыток) останется на дне стакана.
Следует запомнить, что содержание растворенного вещества в насыщенном растворе равно, в ненасыщенном растворе меньше и в пересыщенном растворе больше его растворимости при данной температуре. Так, раствор, приготовленный при 20 °C из 100 г воды и сульфата натрия Na2SO4 (растворимость 19,2 г/100 г Н2O), при содержании
15,7 г соли – ненасыщенный;
19.2 г соли – насыщенный;
2O.3 г соли – пересыщенный.
Растворимость твердых веществ (табл. 14) обычно увеличивается с ростом температуры (КBr, NaCl), и лишь для некоторых веществ (CaSO4, Li2CO3) наблюдается обратное.
Растворимость газов при повышении температуры падает, а при повышении давления растет; например, при давлении 1 атм растворимость аммиака составляет 52,6 (20 °C) и 15,4 г/100 г Н2O (80 °C), а при 20 °C и 9 атм она равна 93,5 г/100 г Н2O.
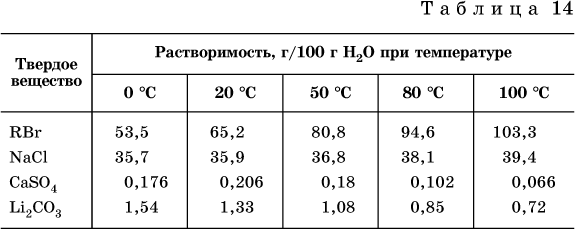
В соответствии со значениями растворимости различают вещества:
– хорошо растворимые, масса которых в насыщенном растворе соизмерима с массой воды (например, КBr – при 20 °C растворимость 65,2 г/100 г Н2O; 4,6М раствор), они образуют насыщенные растворы с молярностью более чем 0,1М;
– малорастворимые, масса которых в насыщенном растворе значительно меньше массы воды (например, CaSO4 – при 20 °C растворимость 0,206 г/100 г Н2O; 0,015М раствор), они образуют насыщенные растворы с молярностью 0,1–0,001М;
– практически нерастворимые, масса которых в насыщенном растворе пренебрежимо мала по сравнению с массой растворителя (например, AgCl – при 20 °C растворимость 0,00019 г на 100 г Н2O; 0,0000134М раствор), они образуют насыщенные растворы с молярностью менее чем 0,001М.
По справочным данным составлена таблица растворимости распространенных кислот, оснований и солей (табл. 15), в которой указан тип растворимости, отмечены вещества, не известные науке (не полученные) или полностью разлагающиеся водой.
Условные обозначения, используемые в таблице:
«р» – хорошо растворимое вещество
«м» – малорастворимое вещество
«н» – практически нерастворимое вещество
«–» – вещество не получено (не существует)
«![]()
» – вещество смешивается с водой неограниченно
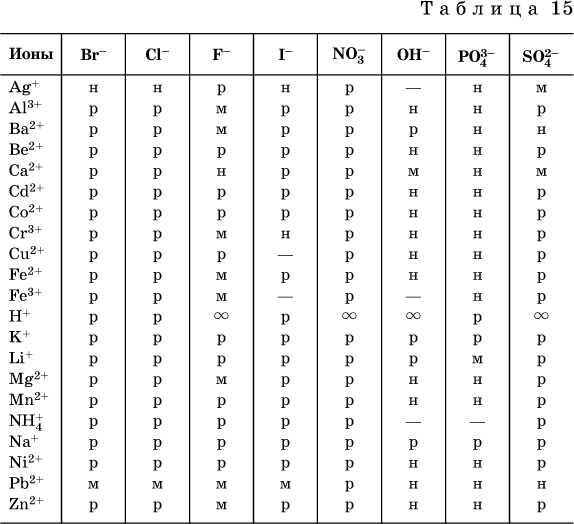
Примечание. Данная таблица отвечает приготовлению насыщенного раствора при комнатной температуре путем внесения вещества (в соответствующем агрегатном состоянии) в воду. Следует учесть, что получение осадков малорастворимых веществ с помощью реакций ионного обмена возможно не всегда (подробнее см. 13.4).
