
- •Лидин р.А. Химия. Полный справочник для подготовки к егэ
- •Содержание
- •Предисловие
- •1. Распространенные элементы. Строение атомов. Электронные оболочки. Орбитали
- •Электроны заполняют орбитали, начиная с подуровня с меньшей энергией.
- •В каждой орбитали может разместиться не более двух электронов.
- •В пределах подуровня электроны сначала заполняют все орбитали наполовину, а затем – полностью.
- •Примеры заданий части а
- •4) Фосфор
- •2. Периодический закон. Периодическая система. Электроотрицательность. Степени окисления
- •Свойства элементов находятся в периодической зависимости от порядкового номера.
- •Примеры заданий частей а, в
- •3. Молекулы. Химическая связь. Строение веществ
- •Примеры заданий части а
- •4. Классификация и взаимосвязь неорганических веществ
- •Примеры заданий частей а, в, с
- •4) Хром
- •5. Металлы главных подгрупп I–III групп
- •5.1. Натрий
- •5.2. Калий
- •5.3. Кальций
- •5.4. Жёсткость воды
- •5.5. Алюминий
- •Примеры заданий части а
- •2) Кальций
- •6. Переходные металлы 4‑го периода. Свойства, способы получения. Общие свойства металлов
- •6.1. Хром
- •6.2. Марганец
- •6.3. Железо
- •Доменный процесс производства чугуна
- •Производство стали
- •6.4. Общие свойства металлов. Коррозия
- •Примеры заданий части a
- •4) Железо
- •7. Неметаллы главных подгрупп IV–VII групп
- •7.1. Водород
- •7.2. Галогены
- •7.2.1. Хлор. Хлороводород
- •7.2.2. Хлориды
- •7.2.3. Гипохлориты. Хлораты
- •7.2.4. Бромиды. Иодиды
- •7.3. Халькогены
- •7.3.1. Кислород
- •7.3.2. Сера. Сероводород. Сульфиды
- •7.3.3. Диоксид серы. Сульфиты
- •7.3.4. Серная кислота. Сульфаты
- •7.4. Неметаллы va‑группы
- •7.4.1. Азот. Аммиак
- •7.4.2. Оксиды азота. Азотная кислота
- •7.4.3. Нитриты. Нитраты
- •7.4.4. Фосфор
- •7.5. Неметаллы iva‑группы
- •7.5.1. Углерод в свободном виде
- •7.5.2. Оксиды углерода
- •7.5.3. Карбонаты
- •7.5.4. Кремний
- •Примеры заданий части а
- •1) Водород
- •8. Теория строения, многообразие, классификация и номенклатура органических соединений. Типы химических реакций
- •Примеры заданий частей а, в
- •9. Углеводороды. Гомология и изомерия. Химические свойства и способы получения
- •9.1. Алканы. Циклоалканы
- •3), Формула совпадает с таковой для алкенов. Важнейшие циклоалканы:
- •9.2. Алкены. Алкадиены
- •9.3. Алкины
- •9.4. Арены
- •Примеры заданий частей а, в
- •4. Алкины
- •6. Арены
- •10. Кислородсодержащие органические соединения
- •10.1. Спирты. Простые эфиры. Фенолы
- •10.2. Альдегиды и кетоны
- •10.3. Карбоновые кислоты. Сложные эфиры. Жиры
- •10.4. Углеводы
- •Примеры заданий частей а, в
- •1) Кислород
- •11. Азотсодержащие органические соединения
- •11.1. Нитросоединения. Амины
- •11.2. Аминокислоты. Белки
- •Примеры заданий частей а, в, с
- •12. Химические реакции. Скорость, энергетика и обратимость
- •12.1. Скорость реакций
- •Скорость химической реакции прямо пропорциональна произведению молярных концентраций реагентов
- •12.2. Энергетика реакций
- •12.3. Обратимость реакций
- •При воздействии на равновесную систему химическое равновесие смещается в сторону, противодействующую этому воздействию.
- •Примеры заданий части а
- •13. Водные растворы. Растворимость и диссоциация веществ. Ионный обмен. Гидролиз солей
- •13.1. Растворимость веществ в воде
- •13.2. Электролитическая диссоциация
- •13.3. Диссоциация воды. Среда растворов
- •13.4. Реакции ионного обмена
- •13.5. Гидролиз солей
- •Примеры заданий частей а, в
- •14. Окислительно‑восстановительные реакции. Электролиз
- •14.1. Окислители и восстановители
- •14.2. Подбор коэффициентов методом электронного баланса
- •14.3. Ряд напряжений металлов
- •14.4. Электролиз расплава и раствора
- •Примеры заданий частей а, в, с
- •15. Решение расчетных задач
- •15.1. Массовая доля растворенного вещества. Разбавление, концентрирование и смешивание растворов
- •Примеры решения задач
- •Задания для самостоятельного решения части в
- •15.2. Объемное отношение газов
- •Пример решения задачи
- •Задания для самостоятельного решения части а
- •15.3. Масса вещества (объем газа) по известному количеству другого реагента (продукта) Примеры решения задачи
- •Задания для самостоятельного решения части в
- •15.4. Тепловой эффект реакции Пример решения задачи части в
- •Задания для самостоятельного решения части а
- •15.5. Масса (объем, количество вещества) продукта по реагенту в избытке или с примесями
- •Пример решения задачи
- •Задания для самостоятельного решения частей в, с
- •15.6. Масса (объем, количество вещества) продукта по реагенту с известной массовой долей в растворе Пример решения задачи
- •Задания для самостоятельного решения частей в, с
- •15.7. Нахождение молекулярной формулы органического соединения
- •Примеры решения задач
- •Задания для самостоятельного решения части с
- •Раздел 15
3. Молекулы. Химическая связь. Строение веществ
Химические частицы, образованные из двух или нескольких атомов, называются молекулами (реальными или условными формульными единицами многоатомных веществ). Атомы в молекулах химически связаны.
Под химической связью понимают электрические силы притяжения, удерживающие частицы друг около друга. Каждая химическая связь в структурных формулах представляется валентной чертой, например:
H – H (связь между двумя атомами водорода);
H3N – Н+ (связь между атомом азота молекулы аммиака и катионом водорода);
(К+) – (I‑) (связь между катионом калия и иодид‑ионом).
Химическая связь образуется парой электронов (•), которая в электронных формулах сложных частиц (молекул, сложных ионов) обычно заменяется валентной чертой, в отличие от собственных, неподеленных электронных пар атомов, например:
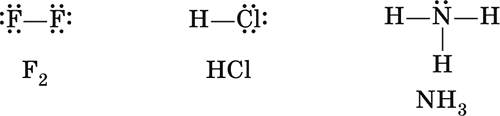
Химическая связь называется ковалентной, если она образована путем обобществления пары электронов обоими атомами.
В молекуле F2 оба атома фтора имеют одинаковую электроотрицательность, следовательно, обладание электронной парой для них одинаково. Такую химическую связь называют неполярной, так как у каждого атома фтора электронная плотность одинакова и в электронной формуле молекулы может быть условно разделена между ними поровну:
![]()
В молекуле хлороводорода НСl химическая связь уже полярная, так как электронная плотность на атоме хлора (элемента с большей электроотрицательностью) значительно выше, чем на атоме водорода:
![]()
Ковалентная связь, например Н – Н, может быть образована путем обобществления электронов двух нейтральных атомов:
H · + · H → H – H
или
H ∙ ∙ H
Такой механизм образования связи называется обменным или равноценным.
По другому механизму та же ковалентная связь H – H возникает при обобществлении электронной пары гидрид‑иона H катионом водорода Н+:
H+ + (:H)‑ → H – H
или
H ∙ ∙ H
Катион Н+ в этом случае называют акцептором, а анион Н – донором электронной пары. Механизм образования ковалентной связи при этом будет донорно‑акцепторным, или координационным.
Одинарные связи (Н – Н, F – F, Н – CI, Н – N) называются а‑связями, они определяют геометрическую форму молекул.
Двойные и тройные связи (![]()
![]()
) содержат одну σ‑составляющую и одну или две π‑составляющие; σ‑составляющая, являющаяся основной и условно образующаяся первой, всегда прочнее π‑составляющих.
Физическими (реально измеряемыми) характеристиками химической связи являются ее энергия, длина и полярность.
Энергия химической связи (Есв) – это теплота, которая выделяется при образовании данной связи и затрачивается на ее разрыв. Для одних и тех же атомов одинарная связь всегда слабее, чем кратная (двойная, тройная).
Длина химической связи (lсв) – межъядерное расстояние. Для одних и тех же атомов одинарная связь всегда длиннее, чем кратная.
Полярность связи измеряется электрическим дипольным моментом р – произведением реального электрического заряда (на атомах данной связи) на длину диполя (т. е. длину связи). Чем больше дипольный момент, тем выше полярность связи. Реальные электрические заряды на атомах в ковалентной связи всегда меньше по значению, чем степени окисления элементов, но совпадают по знаку; например, для связи H+I–Cl‑I реальные заряды равны Н+0'17–Сl‑0'17 (двухполюсная частица, или диполь).
Полярность молекул определяется их составом и геометрической формой.
Неполярными (р = O) будут:
а) молекулы простых веществ, так как они содержат только неполярные ковалентные связи;
б) многоатомные молекулы сложных веществ, если их геометрическая форма симметрична.
Например, молекулы СО2, BF3 и СН4 имеют следующие направления равных (по длине) векторов связей:
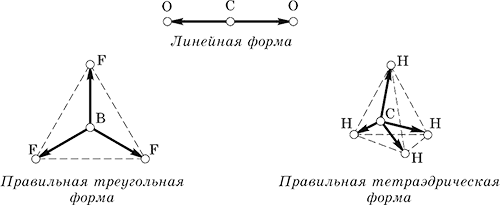
При сложении векторов связей их сумма всегда обращается в нуль, и молекулы в целом неполярны, хотя и содержат полярные связи.
Полярными (р > O) будут:
а) двухатомные молекулы сложных веществ, так как они содержат только полярные связи;
б) многоатомные молекулы сложных веществ, если их строение асимметрично, т. е. их геометрическая форма либо незавершенная, либо искаженная, что приводит к появлению суммарного электрического диполя, например у молекул NH3, Н2О, HNО3 и HCN.
Сложные ионы, например NH4+, SO42‑ и NO3‑, не могут быть диполями в принципе, они несут только один (положительный или отрицательный) заряд.
Ионная связь возникает при электростатическом притяжении катионов и анионов почти без обобществления пары электронов, например между К+ и I‑. У атома калия – недостаток электронной плотности, у атома иода – избыток. Такую связь считают предельным случаем ковалентной связи, поскольку пара электронов находится практически во владении у аниона. Такая связь наиболее характерна для соединений типичных металлов и неметаллов (CsF, NaBr, CaO, K2S, Li3N) и веществ класса солей (NaNО3, K2SО4, СаСО3). Все эти соединения при комнатных условиях представляют собой кристаллические вещества, которые объединяют общим названием ионные кристаллы (кристаллы, построенные из катионов и анионов).
Известен еще один вид связи, называемой металлической связью, в которой валентные электроны так непрочно удерживаются атомами металлов, что фактически не принадлежат конкретным атомам.
Атомы металлов, оставшиеся без четко принадлежащих им внешних электронов, становятся как бы положительными ионами. Они образуют металлическую кристаллическую решетку. Совокупность обобществленных валентных электронов (электронный газ) удерживает положительные ионы металла вместе и в определенных узлах решетки.
Помимо ионных и металлических кристаллов существуют еще атомные и молекулярные кристаллические вещества, в узлах решеток которых находятся атомы или молекулы соответственно. Примеры: алмаз и графит – кристаллы с атомной решеткой, иод I2 и диоксид углерода СO2 (сухой лед) – кристаллы с молекулярной решеткой.
Химические связи существуют не только внутри молекул веществ, но могут образовываться и между молекулами, например для жидкого HF, воды Н2O и смеси H2O + NH3:
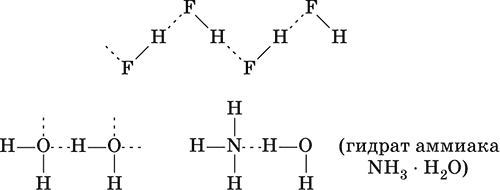
Водородная связь образуется за счет сил электростатического притяжения полярных молекул, содержащих атомы самых электроотрицательных элементов – F, О, N. Например, водородные связи имеются в HF, Н2O и NH3, но их нет в HCl, H2S и РН3.
Водородные связи малоустойчивы и разрываются довольно легко, например при плавлении льда и кипении воды. Однако на разрыв этих связей затрачивается некоторая дополнительная энергия, и поэтому температуры плавления (табл. 5) и кипения веществ с водородными связями

(например, HF и Н2O) оказываются значительно выше, чем у подобных веществ, но без водородных связей (например, HCl и H2S соответственно).
Многие органические соединения также образуют водородные связи; важную роль водородная связь играет в биологических процессах.
