
- •Лидин р.А. Химия. Полный справочник для подготовки к егэ
- •Содержание
- •Предисловие
- •1. Распространенные элементы. Строение атомов. Электронные оболочки. Орбитали
- •Электроны заполняют орбитали, начиная с подуровня с меньшей энергией.
- •В каждой орбитали может разместиться не более двух электронов.
- •В пределах подуровня электроны сначала заполняют все орбитали наполовину, а затем – полностью.
- •Примеры заданий части а
- •4) Фосфор
- •2. Периодический закон. Периодическая система. Электроотрицательность. Степени окисления
- •Свойства элементов находятся в периодической зависимости от порядкового номера.
- •Примеры заданий частей а, в
- •3. Молекулы. Химическая связь. Строение веществ
- •Примеры заданий части а
- •4. Классификация и взаимосвязь неорганических веществ
- •Примеры заданий частей а, в, с
- •4) Хром
- •5. Металлы главных подгрупп I–III групп
- •5.1. Натрий
- •5.2. Калий
- •5.3. Кальций
- •5.4. Жёсткость воды
- •5.5. Алюминий
- •Примеры заданий части а
- •2) Кальций
- •6. Переходные металлы 4‑го периода. Свойства, способы получения. Общие свойства металлов
- •6.1. Хром
- •6.2. Марганец
- •6.3. Железо
- •Доменный процесс производства чугуна
- •Производство стали
- •6.4. Общие свойства металлов. Коррозия
- •Примеры заданий части a
- •4) Железо
- •7. Неметаллы главных подгрупп IV–VII групп
- •7.1. Водород
- •7.2. Галогены
- •7.2.1. Хлор. Хлороводород
- •7.2.2. Хлориды
- •7.2.3. Гипохлориты. Хлораты
- •7.2.4. Бромиды. Иодиды
- •7.3. Халькогены
- •7.3.1. Кислород
- •7.3.2. Сера. Сероводород. Сульфиды
- •7.3.3. Диоксид серы. Сульфиты
- •7.3.4. Серная кислота. Сульфаты
- •7.4. Неметаллы va‑группы
- •7.4.1. Азот. Аммиак
- •7.4.2. Оксиды азота. Азотная кислота
- •7.4.3. Нитриты. Нитраты
- •7.4.4. Фосфор
- •7.5. Неметаллы iva‑группы
- •7.5.1. Углерод в свободном виде
- •7.5.2. Оксиды углерода
- •7.5.3. Карбонаты
- •7.5.4. Кремний
- •Примеры заданий части а
- •1) Водород
- •8. Теория строения, многообразие, классификация и номенклатура органических соединений. Типы химических реакций
- •Примеры заданий частей а, в
- •9. Углеводороды. Гомология и изомерия. Химические свойства и способы получения
- •9.1. Алканы. Циклоалканы
- •3), Формула совпадает с таковой для алкенов. Важнейшие циклоалканы:
- •9.2. Алкены. Алкадиены
- •9.3. Алкины
- •9.4. Арены
- •Примеры заданий частей а, в
- •4. Алкины
- •6. Арены
- •10. Кислородсодержащие органические соединения
- •10.1. Спирты. Простые эфиры. Фенолы
- •10.2. Альдегиды и кетоны
- •10.3. Карбоновые кислоты. Сложные эфиры. Жиры
- •10.4. Углеводы
- •Примеры заданий частей а, в
- •1) Кислород
- •11. Азотсодержащие органические соединения
- •11.1. Нитросоединения. Амины
- •11.2. Аминокислоты. Белки
- •Примеры заданий частей а, в, с
- •12. Химические реакции. Скорость, энергетика и обратимость
- •12.1. Скорость реакций
- •Скорость химической реакции прямо пропорциональна произведению молярных концентраций реагентов
- •12.2. Энергетика реакций
- •12.3. Обратимость реакций
- •При воздействии на равновесную систему химическое равновесие смещается в сторону, противодействующую этому воздействию.
- •Примеры заданий части а
- •13. Водные растворы. Растворимость и диссоциация веществ. Ионный обмен. Гидролиз солей
- •13.1. Растворимость веществ в воде
- •13.2. Электролитическая диссоциация
- •13.3. Диссоциация воды. Среда растворов
- •13.4. Реакции ионного обмена
- •13.5. Гидролиз солей
- •Примеры заданий частей а, в
- •14. Окислительно‑восстановительные реакции. Электролиз
- •14.1. Окислители и восстановители
- •14.2. Подбор коэффициентов методом электронного баланса
- •14.3. Ряд напряжений металлов
- •14.4. Электролиз расплава и раствора
- •Примеры заданий частей а, в, с
- •15. Решение расчетных задач
- •15.1. Массовая доля растворенного вещества. Разбавление, концентрирование и смешивание растворов
- •Примеры решения задач
- •Задания для самостоятельного решения части в
- •15.2. Объемное отношение газов
- •Пример решения задачи
- •Задания для самостоятельного решения части а
- •15.3. Масса вещества (объем газа) по известному количеству другого реагента (продукта) Примеры решения задачи
- •Задания для самостоятельного решения части в
- •15.4. Тепловой эффект реакции Пример решения задачи части в
- •Задания для самостоятельного решения части а
- •15.5. Масса (объем, количество вещества) продукта по реагенту в избытке или с примесями
- •Пример решения задачи
- •Задания для самостоятельного решения частей в, с
- •15.6. Масса (объем, количество вещества) продукта по реагенту с известной массовой долей в растворе Пример решения задачи
- •Задания для самостоятельного решения частей в, с
- •15.7. Нахождение молекулярной формулы органического соединения
- •Примеры решения задач
- •Задания для самостоятельного решения части с
- •Раздел 15
Примеры заданий части а
1. Название, не относящееся к изотопам водорода, – это
1) дейтерий
2) оксоний
3) протий
4) тритий
2. Формула валентных подуровней атома металла – это
1) 4s24p4
2) 3d54s2
3) 2s22p1
4) 3s23p6
3. Число неспаренных электронов в основном состоянии атома железа равно
1) 2
2) 3
3) 4
4) 8
4. В возбужденном состоянии атома алюминия число неспаренных электронов равно
1) 1
2) 2
3) 3
4) 4
5. Электронная формула [Ar]3d94s0 отвечает катиону
1) Ti2+
2) Cu2+
3) Cr2+
4) Zn2+
6. Электронная формула аниона Э2‑ [Ne] 3s23p6 отвечает элементу
1) аргон
2) хлор
3) сера
4) Фосфор
7. Суммарное число электронов в катионе Mg2+ и анионе F‑ равно
1) 9
2) 10
3) 20
4) 21
2. Периодический закон. Периодическая система. Электроотрицательность. Степени окисления
Современная формулировка Периодического закона, открытого Д. И. Менделеевым в 1869 г.:
Свойства элементов находятся в периодической зависимости от порядкового номера.
Периодически повторяющийся характер изменения состава электронной оболочки атомов элементов объясняет периодическое изменение свойств элементов при движении по периодам и группам Периодической системы.

Проследим, например, изменение высших и низших степеней окисления у элементов IA – VIIA‑групп во втором – четвертом периодах по табл. 3.
Положительные степени окисления проявляют все элементы, за исключением фтора. Их значения увеличиваются с ростом заряда ядер и совпадают с числом электронов на последнем энергетическом уровне (за исключением кислорода). Эти степени окисления называют высшими степенями окисления. Например, высшая степень окисления фосфора Р равна +V.

Отрицательные степени окисления проявляют элементы, начиная с углерода С, кремния Si и германия Ge. Значения их равны числу электронов, недостающих до восьми. Эти степени окисления называют низшими степенями окисления. Например, у атома фосфора Р на последнем энергетическом уровне недостает трех электронов до восьми, значит, низшая степень окисления фосфора Р равна – III.
Значения высших и низших степеней окисления повторяются периодически, совпадая по группам; например, в IVA‑группе углерод С, кремний Si и германий Ge имеют высшую степень окисления +IV, а низшую степень окисления – IV.
Эта периодичность изменения степеней окисления отражается на периодическом изменении состава и свойств химических соединений элементов.
Аналогично прослеживается периодическое изменение электроотрицательности элементов в 1–6‑м периодах IA– VIIA‑групп (табл. 4).
В каждом периоде Периодической системы электроотрицательность элементов увеличивается при возрастании порядкового номера (слева направо).
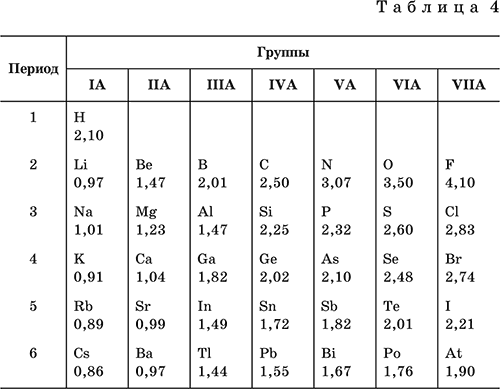
В каждой группе Периодической системы электроотрицательность уменьшается при возрастании порядкового номера (сверху вниз). Фтор F обладает наивысшей, а цезий Cs – наинизшей электроотрицательностью среди элементов 1–6‑го периодов.
У типичных неметаллов – высокая электроотрицательность, а у типичных металлов – низкая.
Примеры заданий частей а, в
1. В 4‑м периоде число элементов равно
1) 2
2) 8
3) 18
4) 32
2. Металлические свойства элементов 3‑го периода от Na до Сl
1) силиваются
2) ослабевают
3) не изменяются
4) не знаю
3. Неметаллические свойства галогенов с увеличением порядкового номера
1) возрастают
2) понижаются
3) остаются без изменений
4) не знаю
4. В ряду элементов Zn – Hg – Со – Cd один элемент, не входящий в группу, – это
1) Са
2) Cs
3) Cd
4) Со
5. Металлические свойства элементов повышаются по ряду
1) In – Ga – Al
2) К – Rb – Sr
3) Ge – Ga – Tl
4) Li – Be – Mg
6. Неметаллические свойства в ряду элементов Аl – Si – С – N
1) увеличиваются
2) уменьшаются
3) не изменяются
4) не знаю
7. В ряду элементов О – S – Se – Те размеры (радиусы) атома
1) уменьшаются
2) увеличиваются
3) не изменяются
4) не знаю
8. В ряду элементов Р – Si – Аl – Mg размеры (радиусы) атома
1) уменьшаются
2) увеличиваются
3) не изменяются
4) не знаю
9. Для фосфора элемент с меньшей электроотрицательностью – это
1) N
2) S
3) Сl
4) Mg
10. Молекула, в которой электронная плотность смещена к атому фосфора, – это
1) PF3
2) РН3
3) P2S3
4) Р2O3
11. Высшая степень окисления элементов проявляется в наборе оксидов и фторидов
1) СlO2, РСl5, SeCl4, SO3
2) PCl, Аl2O3, КСl, СО
3) SeO3, ВСl3, N2O5, СаСl2
4) AsCl5, SeO2, SCl2, Cl2O7
12. Низшая степень окисления элементов – в их водородных соединениях и фторидах набора
1) ClF3, NH3, NaH, OF2
2) H3S+, NH+, SiH4, H2Se
3) CH4, BF4, H3O+, PF3
4) PH3, NF+, HF2, CF4
13. Валентность для многовалентного атома одинакова в ряду соединений
1) SiH4 – AsH3 – CF4
2) РН3 – BF3 – ClF3
3) AsF3 – SiCl4 – IF7
4) H2O – BClg – NF3
14. Укажите соответствие между формулой вещества или иона и степенью окисления углерода в них

