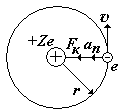- •Квантовая физика.
- •Распределение энергии в спектре ачт.
- •Гипотеза и формула Планка.
- •2) Для элементарных процессов взаимодействия частиц применимы законы сохранения импульса и энергии.
- •Ядерная модель атома.
- •Постулаты Бора:
- •Атом водорода и водородоподобные атомы (впа) по теории Бора.
- •Корпускулярно-волновой дуализм материи. Гипотеза и формула де Бройля.
- •Принцип неопределенности Гейзенберга.
- •1). Входит ли электрон в состав атомного ядра?
- •Уравнение Шрёдингера.
- •Гармонический осциллятор.
- •Частица в одномерной потенциальной яме (ящике)
- •Электрон в атоме водорода в основном состоянии.
- •Описывается с помощью 4-х квантовых чисел: n, l, m, ms.
- •Принцип Паули. Периодическая система элементов.
- •Элементы квантовой статистики и физики твердого тела.
- •Сверхтекучесть.
- •Сверхпроводимость.
- •Температурная зависимость сопротивления различных веществ.
- •Собственные полупроводники.
- •Контакт р - и n - полупроводников.
- •105 - 104 См, для металлов порядка 108 см.
2) Для элементарных процессов взаимодействия частиц применимы законы сохранения импульса и энергии.
ЭНЕРГЕТИЧЕСКИЕ СПЕКТРЫ АТОМОВ И МОДЕЛЬ АТОМА БОРА.
Ядерная модель атома.
Резерфорд на основании опытов по рассеянию альфа-частиц на металлической фольге (1909-10 гг.) предложил ядерную (планетарную) модель атома. Атом представляет собой очень маленькое ядро, в котором сосредоточена почти вся масса атома, а вокруг ядра вращаются электроны подобно планетам солнечной системы. Эта модель оказалась несостоятельной, она не могла объяснить, почему спектры излучения газов состоят из отдельных линий, а не являются сплошными. Электроны, обладающие ускорением, должны непрерывно излучать электромагнитные волны, терять энергию и, в конце концов, упасть на ядро. Однако атомы являются устойчивыми системами.
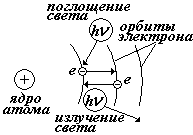
В 1913 г Бор дополнил модель Резерфорда, выдвинув принципиально новые предположения (постулаты).
Постулаты Бора:
1 |
В атомах существуют особые стационарные орбиты, на которых электрон может двигаться сколь угодно долго. |
Целые числа
При
n
= 1
|
Момент количества движения (момент импульса) электрона на таких орбитах равен:
|
||
2 |
При переходе электрона с одной стационарной орбиты на другую происходит излучение (или поглощение) кванта энергии.
Е – энергия электрона на орбите |
|
Теория Бора может быть названа полуклассической, полуквантовой. В этой теории движение электрона на орбите описывалось классическими законами (формулы – см. дальше). Вместе с тем, теория приводила к тому, что скорость, радиус орбиты, энергия электрона не могут иметь любые значения, а квантуются, т.е. могут принимать только дискретные (отдельные) значения.
Теория Бора хорошо описывала закономерности в спектре атома водорода и водородоподобных атомов.(Водородоподобными атомами называют атомы (или ионы) у которых на последней орбите имеется только один электрон). Однако, для атома гелия (Z = 2) и других элементов теория Бора не давала совпадения с опытом.
Атом водорода и водородоподобные атомы (впа) по теории Бора.
На рис. показан водородоподобный атом. Заряд ядра равен +Ze, где Z число протонов (и номер элемента в таблице Менделеева). Вокруг ядра вращается по круговой орбите электрон е со скоростью v. На электрон действует со стороны ядра кулоновская сила Fкул. Запишем II закон Ньютона для электрона: man=Fкул., где an = v2/ r - нормальное ускорение. (Взаимодействие электрона с другими электронами атома не учитываем).
|
II закон Ньютона и закон Кулона, к=1/4о – коэффициент в СИ |
|
Для атома водорода
Z = 1 |
|
постулат Бора |
Из этих формул получим выражения для скорости v и радиуса r орбиты электрона. Сократим в уравнении () на r, а оставшующуюся r перенесем в числитель левой части уравнения. Затем разделим уравнение () на () и получим v. Подставим v в () и найдем r.
Внимание! Легче запомнить вывод формул для v и r, чем сами формулы для них.
|
скорость электрона на орбите, квантуется как v 1/n; v1 = 2,2106 м/с |
|
радиус орбиты электрона, квантуется как r n2 r1 = 0,53 нм – первый боровский радиус |
Когда электрон в атоме Н находится на 1-ой орбите, говорят, что электрон (или атом) находится в основном (невозбужденном) состоянии, при этом электрон имеет минимальную энергию. Все остальные состояния называются возбужденными состояниями.
Полная энергия Е электрона складывается из кинетической W и потенциальной U энергий: Е = W + U. Выразим их в идентичной форме:
|
Потенциальная энергия взаимодействия электрона с ядром отрицательна, т.к. нулевой уровень принят на бесконечности (U = 0), чем ближе к ядру, тем меньше энергия электрона. |
|
|
Кинетическая энергия, получается из (), т.к. W=mv2/2 |
|
|
Полная энергия: Е = W + U
Подставив выражение для r, получим формулу: |
|
|
Полная энергия электрона на n-ой орбите, квантуется как Е 1/n2; вычисления дают: |
|
Е1 13,6 эВ Е1ВПА Z 2 13,6 эВ |
Энергия электрона на 1-ой орбите в атоме водорода и водородоподобных атомах (ВПА). |
|
Из формулы () можно получить также:
|
Внимание! Не забывайте, что электронвольты и вольты численно равны.
Если подставить
во 2-й постулат Бора
![]() выражение (),
получим:
выражение (),
получим:
|
все три формулы имеют одно и то же название – сериальные формулы, а константы называются постоянными Ридберга, хотя и имеют различные числовые значения |
|
|
|
|
Сериальная формула была известна из опыта до появления теории Бора.
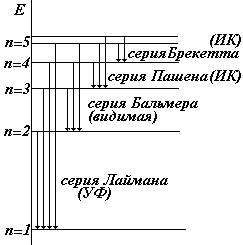
Закономерности в видимом спектре атома Н были обнаружены Бальмером еще в 1885 г. Затем были открыты другие серии. Они получили следующие названия:
|
серия Лаймана |
|
n = 2, 3, 4,…
|
серия Бальмера |
|
n = 3, 4, 5,… |
|
серия Пашена |
|
n = 4, 5, 6,… |
|
серия Брекетта |
|
n = 5, 6, 7,… |
Головными линиями серий называют: серия Лаймана переход 21, серия Бальмера переход 32, серия Пашена переход 43.
Ч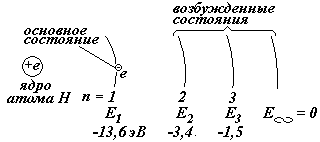 тобы
электрон перешел на более удаленную
орбиту, необходимо внешнее воздействие.
Например, можно газ нагревать, или
освещать светом, или к электродам в
баллоне с газом приложить разность
потенциалов. Среднее время жизни
электрона на этой орбите порядка 108
секунды.
тобы
электрон перешел на более удаленную
орбиту, необходимо внешнее воздействие.
Например, можно газ нагревать, или
освещать светом, или к электродам в
баллоне с газом приложить разность
потенциалов. Среднее время жизни
электрона на этой орбите порядка 108
секунды.
ПРИНЦИПЫ КВАНТОВОЙ МЕХАНИКИ. УРАВНЕНИЕ ШРЁДИНГЕРА.