
- •Глава 13 стационарное течение газа в трубопроводе
- •13.1. Физические свойства природного газа
- •13.2. Уравнения установившегося течения газа в трубопроводе
- •Уравнение неразрывности потока газа в трубе
- •Уравнение движения
- •Распределение давления в установившемся изотермическом течении газа в газопроводе
- •Уравнение энергии
- •Распределение температуры по длине участка газопровода
- •Расчет установившегося режима работы участка негоризонтального газопровода в общем случае
Глава 13 |
Глава 13 стационарное течение газа в трубопроводе
Природным
газом обычно
называют тот углеводородный газ, который
добывают из многочисленных газовых
месторождений в мире. Природный газ
представляет собой смесь различных
газов, причем не только углеводородных,
однако, метан (![]() )
составляет в каждой такой смеси основную
часть, как правило, более 90%. Углеводородными
составляющими природного газа являются
метан, этан, пропан, бутан и т.д., а
неуглеводородными – азот, кислород,
сероводород, углекислый газ, водород,
гелий и др. Природный газ каждого
месторождения имеет индивидуальный
состав, отличающий его от газа других
месторождений.
)
составляет в каждой такой смеси основную
часть, как правило, более 90%. Углеводородными
составляющими природного газа являются
метан, этан, пропан, бутан и т.д., а
неуглеводородными – азот, кислород,
сероводород, углекислый газ, водород,
гелий и др. Природный газ каждого
месторождения имеет индивидуальный
состав, отличающий его от газа других
месторождений.
Плотность
природного газа при атмосферном давлении
и температуре
![]() составляет
составляет
![]()
![]() ,
иными словами, природный газ легче
воздуха. Природный газ не имеет цвета
и запаха, а тот известный неприятный
запах – это запах этилмеркаптана,
специального одоранта, который добавляется
в газ на газораспределительных станциях,
для того чтобы можно было чувствовать
наличие газа в помещении.
,
иными словами, природный газ легче
воздуха. Природный газ не имеет цвета
и запаха, а тот известный неприятный
запах – это запах этилмеркаптана,
специального одоранта, который добавляется
в газ на газораспределительных станциях,
для того чтобы можно было чувствовать
наличие газа в помещении.
13.1. Физические свойства природного газа
Одно из основных свойств природного газа, отличающее его от капельных жидкостей, является свойство сжимаемости. Сжимаемость газа, т.е. изменение его объема при увеличении давления, значительно выше, чем у капельных жидкостей. Так, например, если давление в газе, находящемся при атмосферном давлении, увеличить в 50 раз, то его объем уменьшится примерно во столько же раз, в то время как объем жидкости практически не изменится.
Для
всех газов в состоянии термодинамического
равновесия существует соотношение
между давлением p,
абсолютной
температурой
![]() и плотностью
и плотностью
![]() (или удельным объемом
(или удельным объемом
![]() ):
):
![]() ,
(13.1)
,
(13.1)
называемое уравнением состояния. Физическая природа этого обстоятельства обсуждается в курсах статистической физики. В большинстве моделей, описывающих свойства газа, используется также предположение о том, что при возникновении движения соотношение (13.1) сохраняется. Фактически, это допущение эквивалентно предположению, что процессы установления термодинамического равновесия происходят намного быстрей, чем неравновесность, которую вносит в систему возникающее движение.
Конкретный
вид зависимости (13.1) устанавливается в
ходе так называемых калориметрических
измерений, однако для большинства газов
эта зависимость имеет одни и те же
характерные особенности. Геометрически
зависимость (13.1) представляется двумерной
поверхностью в трехмерном пространстве
переменных (![]() ).
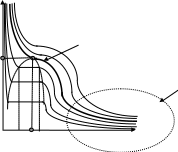
На рис. 13.1 представлены изотермы реальных
газов, т.е. сечение этой поверхности
плоскостями
).
На рис. 13.1 представлены изотермы реальных
газов, т.е. сечение этой поверхности
плоскостями
![]()
Для
всех газов существует так называемая
критическая изотерма (на рис.13.1 выделена
жирной линией), выше и ниже которой
свойства газа качественно различны.
Если
![]() ,
где
,
где
![]() критическая
температура данного газа, то газ при
любом повышении давления остается в
газообразном состоянии; если же
критическая
температура данного газа, то газ при
любом повышении давления остается в
газообразном состоянии; если же
![]() ,
то для каждой температуры
существует такое значение давления
,
то для каждой температуры
существует такое значение давления
![]() ,
при котором газ начинает переходить в
жидкую фазу, причем его удельный объем
уменьшается от значения
,
при котором газ начинает переходить в
жидкую фазу, причем его удельный объем
уменьшается от значения
![]() до значения
до значения
![]() ,
после чего получившаяся среда проявляет
уже свойства жидкости.
,
после чего получившаяся среда проявляет
уже свойства жидкости.
 p
p
![]()
pкр К
Модель
совершенного газа
![]()
![]()
Рис. 13.1. Изотермы газов.
Точка
К
называется критической
точкой данного газа при этом величины
(![]() )
отражают индивидуальные свойства газа
и являются его константами. Например,
для метана СН4,
из которого в основном состоит природный
газ,
)
отражают индивидуальные свойства газа
и являются его константами. Например,
для метана СН4,
из которого в основном состоит природный
газ,
![]() 190,55
К
и
190,55
К
и
![]() 4,641 МПа.
Это означает, что если температура газа
выше 190,55 К,
то газ ни при каком повышении давления
не может быть переведен в жидкое
состояние.
4,641 МПа.
Это означает, что если температура газа
выше 190,55 К,
то газ ни при каком повышении давления
не может быть переведен в жидкое
состояние.
Совершенный газ. Если, однако, давление в газе не слишком высокое, а температура - не слишком низкая, то изотермы всех газов подобны друг другу (см. правую часть рис. 13.1, заключенную в пунктирном овале) и с большой степенью точности приближаются гиперболами: давление р обратно пропорционально удельному объему .
При
указанных условиях взаимодействие
молекул реального газа не зависит от
формы молекул (т.е. от пространственной
конфигурации входящих в них атомов), а
определяется лишь общей массой. Образно
говоря, молекулы ведут себя подобно
шарам, отличающимся друг от друга только
массой, поэтому число параметров,
характеризующих газ, уменьшается с трех
до одного:
![]() молярной
массы.
молярной
массы.
Для характеристики термодинамического состояния газов в указанной области давлений и температур используется модель совершенного газа. Уравнение (13.1) состояния газа в этом случае имеет наиболее простой вид:
![]() или
или
![]() ,
(7.2)
,
(7.2)
где
единственная входящая в уравнение
константа
![]() называется газовой
постоянной,
причем
называется газовой
постоянной,
причем
![]() ,
,
![]() универсальная
газовая постоянная,
равная 8314 Дж/(моль
К). Таким
образом, для совершенных газов все
газовые постоянные зависят только от
молярной массы. Например, для метана (
универсальная
газовая постоянная,
равная 8314 Дж/(моль
К). Таким
образом, для совершенных газов все
газовые постоянные зависят только от
молярной массы. Например, для метана (![]() кг/кмоль):
кг/кмоль):
![]() Дж/(кг
К); для О2
- кислорода
(
Дж/(кг
К); для О2
- кислорода
(![]() кг/кмоль):
кг/кмоль):
![]() Дж/(кг
К); для СО2
-
углекислого
газа (
Дж/(кг
К); для СО2
-
углекислого
газа (![]() кг/кмоль):
кг/кмоль):
![]() Дж/(кг
К); для воздуха
(
Дж/(кг
К); для воздуха
(![]() кг/кмоль):
кг/кмоль):
![]() Дж/(кг
К) и т.д.
Дж/(кг
К) и т.д.
Уравнение (13.2), связывающее между собой плотность давление и температуру газа, называется уравнением Клапейрона - Менделеева. Модель совершенного газа достаточно эффективно работает в интервале не слишком высоких давлений и умеренных температур. В противном случае используется модель так называемого реального газа.
Реальный
газ. Из рис.
13.1 следует, что гиперболическая
зависимость (13.2) не соответствует
наблюдениям при увеличении давления
или сильном уменьшении температуры.
Поэтому в процессах, происходящих с
газом, в том числе и при его транспортировке
по трубопроводам или хранении в подземных
газохранилищах, где давление составляет
![]() МПа,
модель совершенного газа, будь она
использована в расчетах, давала бы
неправильные результаты.
МПа,
модель совершенного газа, будь она
использована в расчетах, давала бы
неправильные результаты.
Существует модель, более общая, чем модель совершенного газа - модель реального газа. В математической записи она представляется соотношением:
![]() или
или
![]() ,
(13.3)
,
(13.3)
отличающимся
от (13.2) тем, что в него входит безразмерный
коэффициент
![]() называемый
коэффициентом сверхсжимаемости,
являющийся функцией двух параметров -
приведенного
давления
называемый
коэффициентом сверхсжимаемости,
являющийся функцией двух параметров -
приведенного
давления
![]() и приведенной
температуры
и приведенной
температуры
![]() :
:
![]() ,
,
![]() ,
,
здесь
![]() и
критические
давление и температура газа, о которых
говорилось выше.
и
критические
давление и температура газа, о которых
говорилось выше.
Таким
образом, модель (13.3) учитывает не только
молекулярный вес газа (через константу
),
но и такие термодинамические постоянные,
как его критические давление и температуру.
Очевидно также, что для умеренных
давлений и температур
![]() и модель (13.3) естественным образом
трансформируется в модель (13.2) совершенного
газа. Для реального газа
и модель (13.3) естественным образом
трансформируется в модель (13.2) совершенного
газа. Для реального газа
![]() .
Графики функции
.
Графики функции
![]() представлены на рис. 13.2.
представлены на рис. 13.2.
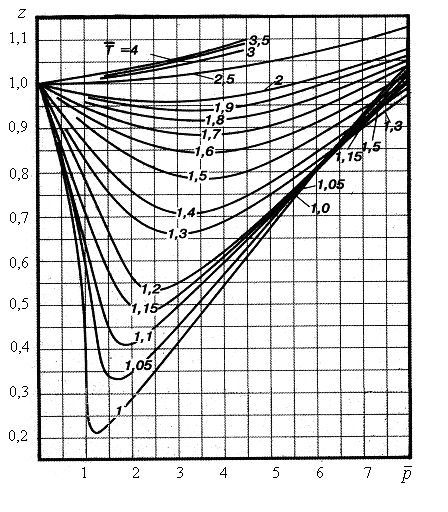
Рис. 13.2. Графики для природного газа
Пример.
Найти значение коэффициента
![]() сверхсжимаемости газа (
4,6
МПа,
190
К), находящегося при давлении 7,5 МПа и
температуре 288 К.
сверхсжимаемости газа (
4,6
МПа,
190
К), находящегося при давлении 7,5 МПа и
температуре 288 К.
Решение.
Сначала
вычисляем приведенные параметры
состояния:
![]() ;
;
![]() .
По графикам
на рис. 13.2 находим:
.
По графикам
на рис. 13.2 находим:
![]() .
.
Существует
множество аппроксимационных формул
для вычисления коэффициента
.
Фактически речь идет об аппроксимации
уравнения состояния (13.1). Однако свойства
реальных газов столь сложны, что
универсальных формул для всех газов и
во всем диапазоне изменения определяющих
параметров не существует, поэтому в
разных случаях используются различные
приближенные формулы. Например, для
газа, текущего в газопроводе, т.е. газа,
находящегося в термодинамических
условиях
![]() К
и
К
и
![]() МПа,
рекомендуется использовать формулу
МПа,
рекомендуется использовать формулу
![]() ,
(13.4)
,
(13.4)
Пример.
Найти значение коэффициента
сверхсжимаемости газа (![]() 4,6
МПа,
190
К), находящегося при давлении 7,5 МПа и
температуре 288 К (см. предыдущий пример).
4,6
МПа,
190
К), находящегося при давлении 7,5 МПа и
температуре 288 К (см. предыдущий пример).
Решение. Сначала рассчитываем значения приведенных давления и температуры:
![]() ,
,
![]() ;
;
затем
находим параметр
![]() :
:
![]() ,
,
и,
наконец, вычисляем коэффициент
![]() :
:
![]() .
.
Отсюда следует, что погрешность расчетов по формулам (13.4) не превышает 0,8%.
Молярная
масса
![]() (кг/кмоль)
и критические параметры
(кг/кмоль)
и критические параметры
![]() (МПа)
и
(МПа)
и
![]() (К)
газовой смеси допускается вычислять
по следующим аддитивным формулам:
(К)
газовой смеси допускается вычислять
по следующим аддитивным формулам:
![]() ;
;
![]() ;
;
![]() ,
(13.5)
,
(13.5)
где
![]() объемные доли компонентов, составляющих
газ;
объемные доли компонентов, составляющих
газ;
![]() соответствующие постоянные этих
компонентов.
соответствующие постоянные этих
компонентов.
Некоторые постоянные компонентов, составляющих природный газ, приведены в таблице 13.1.
Плотность
природного газа при так называемых
стандартных
условиях,
т.е. при давлении 101325 Па (760 мм.
рт.ст.) и
температуре 200С
(293 К),
составляет примерно 0,72 кг/м3,
что меньшее плотности воздуха
![]() кг/м3
при тех же условиях, последнее означает,
что природный газ легче
воздуха.
кг/м3
при тех же условиях, последнее означает,
что природный газ легче
воздуха.
Таблица 13.1.
Некоторые физические постоянные газов
Газ |
Молярная масса, кг/кмоль |
Критическое давление, МПа |
Критическая температура, К |
Метан |
16,042 |
4,641 |
190,55 |
Этан |
30,068 |
4,913 |
305,50 |
Пропан |
44,094 |
4,264 |
369,80 |
Изобутан |
58,120 |
3,570 |
407,90 |
Н – Бутан |
58,120 |
3,796 |
425,17 |
Н – Пентан |
72,146 |
3,374 |
469,78 |
Азот |
28,016 |
3,396 |
126,25 |
Кислород |
32,000 |
4,876 |
154,18 |
Сероводород |
34,900 |
8,721 |
373,56 |
Углекислый газ |
44,011 |
7,382 |
304,19 |
Водород |
2,020 |
1,256 |
33,10 |
Гелий |
4,000 |
0,222 |
5,00 |
Воздух |
28,966 |
3,780 |
132,46 |
Пример. Характеристики газовой смеси представлены в таблице 13.2.
Таблица 13.2.
Компонента газа |
Объемная доля, % |
Критическое давление, МПа |
Критическая температура, К |
Метан |
92,0 |
4,641 |
190,55 |
Этан |
4,0 |
4,913 |
305,50 |
Азот |
2,0 |
3,396 |
126,25 |
Сероводород |
1,0 |
8,721 |
373,56 |
Углекислый газ |
1,0 |
7,382 |
304,19 |
Найти значения коэффициента Z сжимаемости и плотности этой смеси при давлении 6,5 МПа и температуре +25°С.
Решение. Молярная масса смеси, критического давления и критической температуры смеси рассчитываются по формулам (13.5):
![]()
![]() кг/моль,
кг/моль,
![]()
![]() МПа,
МПа,
![]()
![]() Дж/(кг
К);
Дж/(кг
К);
Затем
определяются приведенные параметры
![]() и
газовой смеси:
и
газовой смеси:
![]() ,
,
![]() .
.
По формулам (13.4) вычисляеися :
![]()
Вычисляются
коэффициент![]()
![]()
и плотность сжатого газа:
![]() кг/м3.
кг/м3.
Ответ.
![]() ;
;
![]() кг/м3.
кг/м3.
