
- •Лабораторная работа №1
- •Лабораторная работа №2
- •Лабораторная работа №3
- •Биуретовая реакция на пептидную группу
- •2. Нингидриновая реакция на α-аминогруппу
- •3. Ксантопротеиновая реакция на ароматические аминокислоты
- •4. Реакция Адамкевича на триптофан
- •5. Реакция Фоля на аминокислоты, содержащие слабосвязанную серу
- •Лабораторная работа №4
- •Лабораторная работа №5
- •1. Осаждение белков солями тяжелых металлов
- •2. Осаждение белков концентрированными минеральными кислотами
- •3. Осаждение белков органическими кислотами
- •4. Осаждение белков органическими растворителями
- •Лабораторная работа №6
- •Лабораторная работа №7
- •1. Серебряная проба на пуриновые основания
- •2. Проба Троммера на пентозы
- •3. Молибденовая проба на фосфорную кислоту
- •4. Биуретовая реакция на белок
- •Лабораторная работа №8
- •1. Качественная реакция на эритромицин
- •2. Качественные реакции на тетрациклин
- •3. Качественная реакция на левомицетин
- •Лабораторная работа №9
- •Список литературы
Лабораторная работа №3
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА БЕЛКИ И АМИНОКИСЛОТЫ
Цель работы – закрепить знания по аминокислотному составу белков и приобрести навыки проведения цветных реакций на белки и отдельные аминокислоты.
При взаимодействии белка с отдельными химическими веществами возникают окрашенные продукты реакции. Образование их обусловлено присутствием в молекуле белка той или иной аминокислоты, имеющей в боковом радикале определенную химическую группировку. Некоторые реакции присущи не только белкам, но и другим веществам, содержащим те же химические группировки, поэтому для установления наличия белка недостаточно проведения одной какой-нибудь реакции.
Значение цветных реакций состоит в том, что они дают возможность установить белковую природу вещества и доказать присутствие некоторых аминокислот в различных природных белках. На основании цветных реакций разработаны методы количественного определения белков и аминокислот.
Исследуемый материал: сыворотка или плазма крови, 1% раствор яичного белка (белок одного куриного яйца растворяют в 20-кратном объеме дистиллированной воды, фильтруют через марлю).
Реактивы:
10% раствор NaOH.
1% раствор CuSO4.
0,1% водный раствор нингидрина.
Концентрированная азотная кислота.
Ледяная уксусная кислота.
Концентрированная серная кислота.
5% раствор ацетата свинца.
Оборудование:
Штатив с пробирками.
Пипетки.
Песчаная баня или спиртовка.
Ход работы:
Биуретовая реакция на пептидную группу
Метод основан на способности пептидных групп образовывать в щелочной среде с ионами Cu2+ комплексное соединение фиолетового цвета с красным или синим оттенком в зависимости от числа пептидных связей в белке. В сильно щелочной среде пептидные группы полипептидов переходят в енольную форму, в которой и взаимодействуют с ионом Cu2+, образуя окрашенный биуретовый комплекс. Ковалентные связи этого комплекса образованы за счет енольного гидроксила, а координационные – за счет атомов азота амино- и иминогрупп, имеющих неподеленные электронные пары:

В пробирку вносят 5 капель исследуемого раствора и прибавляют 5 капель 10% раствора гидроксида натрия и 1 каплю 1% раствора CuSO4, в результате в пробирке появляется сине-фиолетовое окрашивание.
Нельзя добавлять избыток сульфата меди, так как синий осадок гидрата окиси меди маскирует характерное фиолетовое окрашивание биуретового комплекса белка.
Биуретовая реакция положительна с пептидами, имеющими не менее двух пептидных связей. С ди- и трипептидами она неустойчива. Кроме белков биуретовую реакцию способны давать вещества, которые содержат не менее двух пептидных групп, например, биурет H2N-CO-NH-CO-N2H.
На основании биуретовой реакции разработаны методы количественного определения белков.
2. Нингидриновая реакция на α-аминогруппу
Метод основан на взаимодействии нингидрина с α-аминогруппой аминокислот, пептидов, белков с образованием окрашенного комплекса синего или сине-фиолетового цвета. В этой реакции α-аминокислоты и пептиды окисляются нингидрином и подвергаются окислительному дезаминированию, декарбоксилированию с образованием аммиака, альдегида и СО2. Нингидрин восстанавливается и связывается со второй молекулой нингидрина посредством молекулы аммиака, образуя продукты конденсации, окрашенные в синий, фиолетовый, красный, а в случае пролина – в желтый цвет. Химизм нингидриновой реакции:
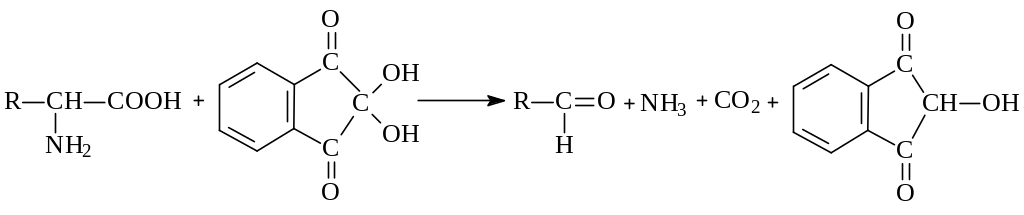
α-аминокислота нингидрин альдегид восстановленный нингидрин
 продукт
конденсации
продукт
конденсации
К 5 каплям исследуемого раствора приливают 5 капель 0,1% водного раствора нингидрина, нагревают до кипения и через 1-3 мин наблюдают появление окрашивания.
Нингидриновая реакция может быть положительна с некоторыми аминами и амидами кислот.
Нингидриновая реакция может быть использована для количественного определения α-аминокислот.
