
- •Распределение максвелла–больцмана
- •Распределение по координатам и импульсам
- •Распределение Максвелла
- •Распределение по импульсам
- •Распределение по скоростям
- •Средняя и средняя квадратичная проекции скорости
- •Распределение в сферических координатах
- •Распределение по модулю скорости
- •Наиболее вероятная энергия
- •Средняя энергия
- •Поток частиц
- •Поток импульса
- •Поток энергии
- •ВыТекание газа из отверстия сосуда в вакуум
- •Термоэлектронная эмиссия
- •Время выхода частицы из потенциальной ямы
- •Распределение Больцмана
- •Получение распределения
- •Формула Больцмана
- •Газ в центрифуге
- •Ориентационная поляризация диэлектрика
- •Термодинамические потенциалы Основные положения
- •Химический потенциал системы
- •Электрохимический потенциал
- •Внутренняя энергия
- •Равновесие двухфазной системы
- •Химический потенциал системы
- •Активность системы
- •Распределение по состояниям максвелла–больцмана
- •Термодинамический потенциал Гиббса
- •Большое каноническое распределение
- •Распределение микросостояний по фазовому пространству
- •Интеграл состояния
- •2. Распределение электронов у поверхности металла
- •3. Капля жидкости в насыщенном паре
- •4. Заряженная капля жидкости в насыщенном паре
- •Вопросы коллоквиума
- •Вопросы экзамена
Активность системы
![]()
характеризует относительную активность упорядочивающих процессов в системе в виде баланса между химическим потенциалом и тепловой энергией. Используем (2.62)
,
находим
 .
(2.62б)
.
(2.62б)
Для газа с поступательным движением частиц
 .
(2.62в)
.
(2.62в)
При повышении температуры и уменьшении концентрации частиц активность понижается.
Для гелия при нормальных условиях
,
![]()
из (2.62а) и (2.62б) получаем
![]() ,
,
![]() .
.
Классический газ соответствует высоким температурам, низким концентрациям, большим расстояниям между частицы, когда преобладают силы притяжения, поэтому химический потенциал отрицательный и активность мала
![]() ,
,
![]() .
.
Распределение по состояниям максвелла–больцмана
В
классической физике состояние совпадает
с уровнем энергии. Частицы идеального
газа на одном энергетическом уровне
отличаются проекциями импульса и
положениями в пространстве. Найдем
среднее число частиц
![]() в одном состоянии для газа с фиксированной
температурой и концентрацией.
в одном состоянии для газа с фиксированной
температурой и концентрацией.
Для
трехмерного газа среднее
число частиц в единице объема с энергией
в интервале
![]() описывается распределением Максвелла
по энергии (2.48а)
описывается распределением Максвелла
по энергии (2.48а)
 .
.
Концентрацию n выражаем через химический потенциал, используя (2.62а):
 ,
,
тогда
 .
.
Множитель
![]() выражаем через энергетическую плотность
состояний в единице объема (П.2.5)
выражаем через энергетическую плотность
состояний в единице объема (П.2.5)
 .
.
В результате распределение Максвелла получает вид
![]() ,
(П.7.6)
,
(П.7.6)
где среднее число частиц на уровне с энергией
![]() (П.7.7)
(П.7.7)
называется распределением по состояниям Максвелла–Больцмана, где
![]() – активность
системы.
– активность
системы.
Из (П.7.7) находим
![]() ,
,
активность
равна среднему числу частиц в состоянии
с
![]() .
.
Распределение по состояниям представляем наглядно на рисунке. Ось энергии направляем вертикально, уровни энергии изображаем горизонтальными линиями, частицы – точками. Из (П.7.7) следует:
Чем выше уровень энергии, тем меньше на нем частиц;
При повышении температуры заполненность верхних уровней повышается, нижних уровней понижается за счет переходов частиц снизу вверх.
При низкой температуре заполнены лишь нижние уровни.
4. Площадь под кривой пропорциональна температуре
 .
.


Среднее число частиц в единичном интервале энергии около
![]() (П.7.8)
(П.7.8)
равно произведению числа состояний в единичном интервале энергии на число частиц в одном состоянии.
Для He при , ранее получено
, .
Из
 (П.2.5)
(П.2.5)

для
He
с
![]() при
при
![]() ,
,
![]()
находим
![]() ,
,
![]() ,
,
![]() .
.
Термодинамический потенциал Гиббса
Для описания системы с переменным числом частиц используется термодинамический потенциал Гиббса и омега-потенциал.
Определяем потенциал Гиббса
![]() .
(2.64)
.
(2.64)
Используем (2.61)
,
находим
![]() ,
(2.65)
,
(2.65)
тогда
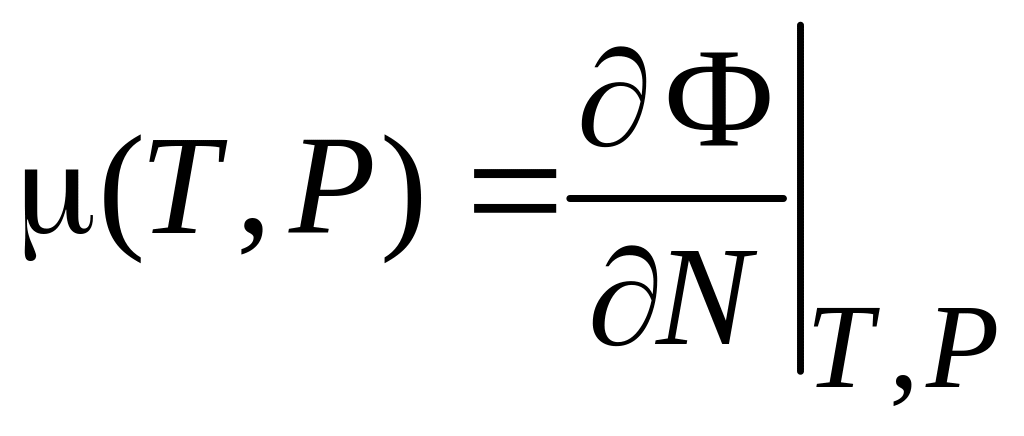 .
.
При фиксированных P и T из (2.65) получаем
![]() .
.
Интегрируем по N
![]() .
(2.66)
.
(2.66)
Здесь
и далее число частиц является
характеристикой макросостояния, поэтому
![]() .
Термодинамический
потенциал Гиббса равен химическому
потенциалу, умноженному на среднее
число частиц системы.
.
Термодинамический
потенциал Гиббса равен химическому
потенциалу, умноженному на среднее
число частиц системы.
Из (2.64)
и (2.66) получаем
![]() .
(2.67)
.
(2.67)
-потенциал
Определяем
![]() ,
(2.68)
,
(2.68)
где учтено (2.67). Следовательно, Ω-потенциал не зависит явно от числа частиц системы
![]() .
.
Дифференцируем (2.68)
![]() ,
,
подставляем (2.61)
,
получаем
![]() ,
,
откуда
 ,
,
 ,
,
 .
(2.69)
.
(2.69)
В результате уравнение состояния системы
![]() .
.
Получим выражение для Ω-потенциала через статистические характеристики системы.
