
Лабораторна робота № 8 Рефрактометричний метод дослідження
8.1 Мета роботи: Оволодіти рефрактометричними методами дослідження для ідентифікації ре-човини за значенням його показника заломлення і молекулярної рефракції та вивчити залежність показника заломлення від концентрації речовини.
8.2 Короткі теоретичні відомості
Рефрактометрія знайшла широке застосування для визначення складу і структури речовин, а також для контролю якості і складу різних продуктів у хімічних, фармацевтичних, харчовій і багатьох інших галузях промисловості. Достоїнства рефрактометрических методів хімічного кількісного аналізу -швидкість вимірів, мала витрата речовини і висока точність.
Рефрактометричний метод аналізу базується на вимірюванні показника заломлення. Промінь світла, який проходить із одного прозорого середовища в інше під нахилом до поверхні розподілу фаз, змінює свій початковий напрямок, тобто заломлюється.
Заломлення світла (рефракція) обумовлена різною швидкістю поширення світла в різних середовищах. Відношення синуса кута падіння (а) до синуса кута заломлення ((3) дорівнює відношенню швидкості поширення світла в середовищах і є постійною величиною для певних двох середовищ:
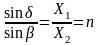 (8.1)
(8.1)
де n - показник заломлення середовища 1 (по відношенню до середовища 2).
Показник заломлення розчину залежить від природи речовини, температури, довжини хвилі світла і концентрації.
При пониженні температури показник заломлення збільшується, при підвищенні — зменшується. Вимірюють показник заломлення при постійній температурі, частіше всього при 20° С. Якщо температура інша, то вносять поправку, розраховуючи її за формулою:
n1 = n20 + (20 - t) 0.0002 (8.2)
де - температура, при якій здійснювалось вимірювання.
Показник заломлення при даній температурі і довжині хвилі є важливою фізико-хімічною константою, яка характеризує ідентичність і чистоту речовини. Показник заломлення дозволяє робити розрахунок густини і концентрації. При кількісному рефрактометричному аналізі концентрацію визначають за графіком залежності показника заломлення від концентрації розчину. У деяких випадках за виглядом кривих показників заломлення можна робити висновки про характер взаємодії речовин і утворення сполук. Визначення показника заломлення здійснюють за допомогою рефрактометрів.
Важливою характеристикою для ідентифікації речовини є молярна рефракція.
Якщо яку-небудь речовину помістити у зовнішнє електричне поле, тоді атоми , молекули чи іони цієї речовини під дією поля піддаються тим чи іншим змінам , які об'єднуються під загальною назвою - поляризація (Р).
> = Рея + /'„,„ + Рор (8-3)
де Реп — електронна поляризація - зміщення електронів відносно ядра атома;
Рат - атомна поляризація - зміщення самих атомів, що утворюють молекулу;
РОр— орієнтаційпа поляризація — орієнтація полярних молекул у просторі у відповідності з напрямком поля.
Здатність молекул до поляризації характеризується поляризуємостю (а), яка дорівнює сумі електронної, атомної і орієнтаційної поляризуємості:
а - аа і аш„ + аор (8.4)
Електронна і атомна поляризуємості не залежать від температури. Орієнтаційна поляризуємість обернено пропорційна абсолютній температурі,
оскільки хаотичний тепловий рух молекул порушує орієнтацію
Поляризація діелектрика розраховується за рівнянням Дебая:
\
є-
М
(8.5)
ґ =
х; є-2 р
де є- діелектрична проникність;
М- молярна маса;
р- густина речовини. Залежність поляризації від температури описується рівнянням:
(8.6)
де
Л^ = 6,024-10 - число Авогадро; /и - дипольний момент молекули, Кл-м (раніше вимірювався у дебаях, Ю = І/3-Ю'29 Кл-м);
к =1,38-10 Дж/град - постійна Больцмана.
При зміні напрямку зовнішнього електричного поля відбувається переорієнтація полярних молекул і зміна напрямку вектора наведеного диполя. При підвищенні частоти електричного поля спочатку відпадає орієнтаційна поляризація. Полярні молекули не встигають за зміною напрямку електричного поля. При подальшому збільшенні частотні відпадає атомна поляризація. Електронна ж поляризація зберігається навіть у змінному електричному полі частотою 10 сек" , що відповідає частоті електромагнітних коливань видимого світла. Таку поляризацію називають молярною рефракцією:
Ям = Рел
Вона визначається на підставі'показника заломлення і залежить від довжини хвилі світла.
При нескінченно великій довжині хвилі діелектрична проникність діелектрика буде:
(8.7)
де її* - показник заломлення світла при X = °о З рівняння (8.7) витікає, що:
де Км - молярна рефракція, м3/кмоль;
п - показник заломлення променя видимого світла; М— молярна маса речовини;
р.- густина речовини при температурі вимірювання показника заломлення.
Молярна рефракція не залежать від агрегатного стану речовини і від температури.
Фізичний зміст: молярна рефракція дорівняв сумі об'ємів молекул І моля речовини.
*.»» Об'єм має властивості адитивності, тобто об'єм цілого дорівнює сумі
ЗО
об'ємів його складових частин:
Ям= 2тЯат + ЕтЯциа +2тЯкрат„.ж (8.9)
де Яат - атомна рефракція; :,
Яцшп - рефракція циклів; \-■;,;
Ккратн.зв. - рефракція зв'язків; %,;'*"
т — число атомів, циклів, кратних зв'язків. ' *
За молярною рефракцією можна встановити структуру молекули. При цьому підбирають таку структурну формулу, для якої обчислена молярна рефракція за рівнянням (8.7) дорівнює експериментально одержаному значенню.
Наприклад. Визначити структуру молекули хлорбензолу та її об'єм, якщо відомо, що Т = 293,2 К , коефіцієнт заломлення п = 1;4455 і густина р=
і,іо62-іо3 кг/м3. „::;
Розв'язування. Визначають молярну рефракцію: ,, : Н
п2-\ М 1,44552-1
"С-СІ
112,563
~р ~1,44552+2Х 1106,2 : мо де М— молярна маса хлорбензолу.
Визначають молярну рефракцію за атомними рефракціями і інкрементами зв'язку.
Таблиця 8.1 |
-Атомні
рефракції |
|
|
|
|
|
Атоми і зв'язки |
Н |
С |
СІ |
о гідрокс |
О карбон. |
О ефірн. |
С=С |
с=с |
N |
Р |
1,100 |
2,418 |
5,967 |
1,525 |
2,211 |
1,643 |
1,733 |
2,398 |
2,62 |
К = 6КС + 5КН + Ка+ ЗК = (6-2,418 + 5-1,100 + 5,967 + 3-1,733) -КГ3 =
=31,174-10"3м3/кмоль:
Збіг розрахованого за правилом адитивності і експериментально знайденого значення молярної рефракції задовільний.
Об'єм однієї молекули:
К 31,174x10"
6,024x1026
Рефракція, віднесена до молярної маси речовини, називається питомою рефракцією {ту.
пг-
, см3/г або м3/кг
Питома рефракція використовується при вивченні властивостей розчинів. Для розчину речовини А у розчиннику В можна записати:
гл,в = гАх + гв(\~х), (8.11)
де гА^н, гА, гв - питомі рефракції розчину, розчиненої речовини і розчинника;
х - масова частка розчиненої речовини А. Згідно рівнянням (8.8) і (8.9) витікає:
„2 1 2
.-1
п2, -\ х пі-І 1-х
(8.12)
рА+н п2А+2 р
-^ X 1 * X .
Рн
+2
де пА, пв, пА., д — показники заломлення речовин А, В і розчин> АА Іі; Раї Ріь Ра\в — густина речовин А, В, і розчину; х - масова частка речовини А у розчині.
