
- •Глава 1. Номенклатура и изомерия органических соединений.
- •Теория строения органических соединений а.М. Бутлерова.
- •Свойства вещества определяются не только их качественным и количественным составом, но и порядком соединения атомов в молекуле, т.Е. Химическим строением вещества.
- •Свойства органических соединений зависят не только от состава вещества и порядка соединения атомов в его молекуле, но и от взаимного влияния атомов и групп атомов друг на друга.
- •Основы строения и реакционной способности органических соединений Общая характеристика и классификация органических соединений
- •1.2.1. Заместительная номенклатура
- •Некоторые характеристические группы, обозначаемые только префиксами
- •Порядок старшинства характеристических групп, обозначаемых префиксами и суффиксами
- •Номенклатуре
- •Радикально-функциональная номенклатура
- •Глава 2. Электронное строение органических молекул.
- •Понятие о взаимном влиянии атомов в молекуле и электронные эффекты
- •Системы с замкнутой цепью сопряжения.
- •Кислотно-основные свойства органических соединений. Типы кислот и оснований.
- •Льюисовская кислотность и основность органических соединений.
- •Концепция жестких и мягких кислот и оснований (принцип жмко)
- •Глава 3. Механизмы реакций органических соединений.
- •Классификация органических реакций и их компонентов.
- •Реакции электрофильного присоединения, электрофильного замещения.
- •Реакции нуклеофильного замещения, нуклеофильного присоединения (присоединения-отщепления).
- •Глава 4. Оксосоединения (альдегиды и кетоны).
- •Общая характеристика реакционной способности
- •Альдегиды и кетоны
- •Альдегиды и их производные
- •Лабораторный практикум
- •Ход работы.
- •Глава 5. Карбоновые кислоты. Вопросы к занятию.
- •Строение, номенклатура и физико-химические свойства карбоновых кислот
- •Химические свойства предельных кислот и их производных
- •Декарбоксилирование
- •Кислотно-основные свойства
- •Карбоновые кислоты как ацилирующие реагенты
- •Производные карбоновых кислот, их свойства и взаимные превращения.
- •Функциональные производные карбоновых кислоты
- •Сложные эфиры, имеющие приятный аромат
- •Дикарбоновые кислоты
- •Некоторые дикарбоновые кислоты, их названия и кислотные свойства
- •Ненасыщенные карбоновые кислоты
- •Содержание высших ненасыщенных кислот в растительных маслах, % по массе
- •Лабораторный практикум.
- •Инструкция по технике безопасности.
- •Ход работы.
- •Глава 6. Гетерофункциональные соединения.
- •Поли- и гетерофункциональные соединения, участвующие в процессах жизнедеятельности.
- •Классификация
- •Общая характеристика реакционной способности.
- •Специфические реакции.
- •Аминоспирты.
- •Гидроксикарбоновые кислоты
- •Оксокарбоновые кислоты
- •Отдельные представители фенолокислот
- •Лабораторный практикум.
- •Ход работы.
- •Глава 7. Биологически-активные гетероциклические соединения.
- •Азотосодержащие ароматические гетероциклические соединения
- •Лабораторный практикум.
- •Ход работы.
- •Глава 8. Амиокислоты, пептиды, белки.
- •Строение и свойства аминокислот и пептидов
- •Физиологическая роль и применение в медицине некоторых аминокислот
- •Контрольные вопросы
- •1. Каталитическая функция
- •7. Защитная функция
- •Лабораторный практикум.
- •Ход работы:
- •Глава 9. Углеводы.
- •Строение и свойства углеводов
- •Гетерополисахариды
- •Функции углеводов и их обмен
- •Контрольные вопросы
- •Глава 10. Нуклеиновые кислоты, их структура и свойства. Вопросы к занятию:
- •Нуклеотидный состав и структура днк и рнк.
- •Биологические функции нуклеиновых кислот.
- •Контрольные вопросы
- •Глава 11. Омыляемые и неомыляемые липиды. Стероиды и стероидные гормоны.
- •Липиды. Строение и классификация липидов
- •Простые липиды
- •Константы некоторых жиров животного и растительного происхождения
- •Температура плавления (застывания) некоторых жиров
- •Терпены
- •Стериды. Стероиды и стероидные гормоны.
- •Стероидные гормоны
- •Сложные липиды
- •Лабораторная работа
- •II. Некоторые свойства скипидара.
- •III. Качественные реакции на холестерин и жёлчные кислоты.
- •IV. Качественная реакция на витамин d2 (кальциферол).
- •Глава 12. Адсорбция на подвижной границе раздела фаз.
- •12.1. Поверхностная энергия и поверхностное натяжение.
- •Поверхностное натяжение жидкостей на границе с воздухом (298 к)
- •2. Изотерма Ленгмюра:
- •§7.Лабораторный практикум
- •Ход работы.
- •Глава 13. Адсорбция на неподвижной границе раздела фаз. Изотерма адсорбции уксусной кислоты на угле.
- •Адсорбционные равновесия и процессы на подвижной и неподвижной границах раздела фаз. Влияние различных факторов на величину адсорбции.
- •Контрольные вопросы
- •§7. Лабораторный практикум.
- •Ход работы.
- •Глава 14. Физикохимия дисперсных систем
- •По размерам частиц дисперсной фазы
- •По агрегатному состоянию дисперсной фазы и дисперсионной среды:
- •По характеру взаимодействия дисперсной фазы с дисперсионной средой:
- •Получение и устойчивость дисперсных систем
- •Лабораторный практикум.
- •Ход работы.
- •Литература основная литература
- •Дополнительная литература
Лабораторный практикум.
”Гетерофункциональные соединения”.
Цель: сформировать знания специфических химических свойств гетерофункциональных соединений, как основу для понимания их метаболических превращений в организме, а также имеющих лекарственное значение.
Ход работы.
Опыт 1. Качественная реакция на молочную кислоту (реакция Уфельмана).
В пробирку взять 3 – 4 капли фенола, добавить 1 каплю хлорида железа (III). К полученному феноляту железа добавить 1 каплю молочной кислоты. Какое окрашивание наблюдается? Написать уравнения химических реакций.
Опыт 2. Декарбоксилирование салициловой кислоты и обнаружение продуктов реакции.
В сухую пробирку насыпать немного салициловой кислоты (прикрыть дно пробирки), надеть газоотводную трубку, конец трубки опустить в пробирку с 5 каплями известковой воды Ca(OH)2 . нагреть салициловую кислоту. Что наблюдается? Написать уравнения реакций.
Разобрать прибор, снять газоотводную трубку, капнуть в пробирку 2 капли FeCl3. Какое наблюдаете окрашивание? Почему?
Опыт 3. Обнаружение кислотных свойств ацетоуксусного эфира.
Смешайте в пробирки 2 – 3 капли воды и 1 каплю фенолфталеина и прибавьте 1 каплю 2Н NaOH. Раствор при этом окрасится в красный цвет. Добавьте 2 – 3 капли ацетоуксусного эфира – окраска исчезнет.
Опыт 4. Кетонное расщепление ацетоуксусного эфира.
В пробирку с газоотводной трубкой налейте 2 мл ацетоуксусного эфира в 1 мл 2Н H2SO4 и нагрейте. Трубку опустите в пробирку с несколькими каплями баритовой воды, при появлении мути перенесите отводную трубку в пробирку с раствором I2, KI, обеспеченным 2Н NaOH – выделяется желтоватый осадок йодоформа.
Опыт 5. Доказательства наличия двух карбоксильных групп в винной кислоте.
В пробирку поместите 1 каплю 15% раствора винной кислоты, 2 капли 5 % раствора KOH, встряхните! Охладите под струёй воды. Что наблюдаете? Добавьте ещё в пробирку 4 – 5 капель KOH.
Запишите уравнения реакций получения кислой и средней солей винной кислоты.
Глава 7. Биологически-активные гетероциклические соединения.
Вопросы к занятию.
Понятие о гетероциклических соединениях и их классификация по количеству гетероатомов, их виду и размеру цикла.
Пятичленные гетероциклы с одним гетероатомом. Кислотно-основные свойства атома азота на примере пиррола.
Химические свойства и строение пиррола, индола и их производных. Биороль порфинов.
Пятичленные гетероциклы с двумя атомами азота (азолы), строение и номенклатура. Бироль строений этого типа.
Шестичленные гетероциклы с одним гетероатомом и их химические свойства на примере пиридина, хинолина. Никотиновая кислота и её амид. Соединения хинолина в медицине.
Шестичленные гетероциклы с двумя гетероатомами (пиримидин).
Пурин и его производные (аденин, гуанин, ксантин). Кофеин, теофиллин, теобромин.
Азотосодержащие ароматические гетероциклические соединения
Гетероциклическими называют органические соединения, в состав цикла которых помимо атомов углерода входят один или несколько атомов других элементов — гетероатомов. Наиболее важное значение имеют гетероциклы, содержащие атомы N, О и S. Включение этих гетероатомов вместо групп —СН=СН—, —СН= или —СНз— в циклическую систему не очень сильно изменяет общую геометрию молекулы и мало влияет на напряжение в цикле. Особый интерес вызывает обширная группа гетероциклов, имеющих циклические сопряженные системы кратных связей, в которых может принимать участие неподеленная электронная пара гетероатома, находящаяся на р-орбитали. Такого рода гетероциклы напоминают своей устойчивостью бензол и получили название ароматические гетероциклы. Именно эти соединения, содержащие в цикле один или несколько атомов азота, и будут объектом нашего рассмотрения.
Пятичленные гетероциклы. Пятичленные гетероциклические соединения можно рассматривать как продукт замещения в бензольном цикле одной группировки —СН=СН— на гетероатом с неподеленной парой электронов. Внимание будет уделено пирролу, индолу и имидазолу, поскольку эти азотсодержащие соединения или их производные составляют основу многих природных биологически активных веществ и лекарственных средств.
Пиррол. Молекула пиррола содержит систему сопряженных связей, включая неподеленную пару электронов атома азота:
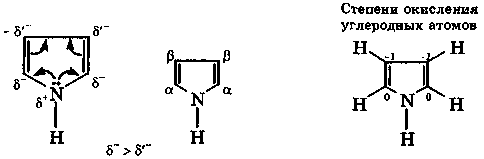
Четыре атома углерода молекулы пиррола находятся в sp2-coстоянии, а атом азота — в sp2-I состоянии, соответственно все σ-связи между ними расположены в одной плоскости. Неподеленная электронная пара атома азота находится на р-орбитали и участвует в сопряжении с π-электронами соседних двойных связей (рис. 10).
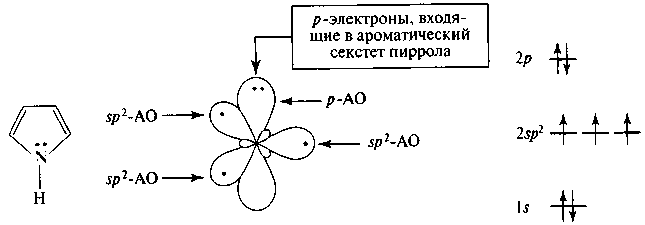
Рис. 10. Распределение электронов пиррольного атома азота по орбиталям
Энергия делокализации электронов в π-системе пиррола составляет 110 кДж/моль, следовательно, он имеет ароматический характер. Атом азота является донором электронной пары для π-системы, поэтому на углеродных атомах цикла плотность π-электронов увеличена, причем в α-положении больше, чем в β-положении. Это делает пиррол электроноизбыточным гетероциклом, благодаря чему он легче вступает в реакции электрофильного замещения по сравнению с бензолом и легко окисляется.
Пиррол - бесцветная жидкость (т. кип. 131 °С) с запахом хлороформа, практически нерастворимая в воде и быстро темнеющая на воздухе из-за окисления. Молекула пиррола содержит полярную связь N—Н и является очень слабой NH-кислотой (рКа = 17,5). При взаимодействии со щелочными металлами пиррол образует соли, устойчивые в отсутствие воды:
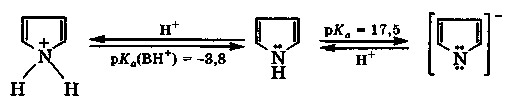
неустойчив, легко полимеризуется
Поскольку неподеленная электронная пара атома азота де-локализована, то пиррол является очень слабым основанием. В сильнокислой среде ароматическая система пиррола нарушается вследствие протонирования, и он легко полимеризуется с образованием темной смолы. Поэтому пиррол называют ацидофобным, т. е. не выдерживающим присутствия кислот.
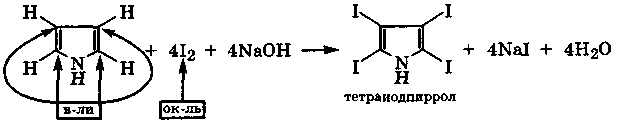
Реакция сопровождается окислением углеродных атомов пиррола и восстановлением атомов иода.
Наиболее реакционноспособно к электрофильному замещению в пирроле α-положение. Так, конденсацией пиррола с муравьиной кислотой можно получить порфин:
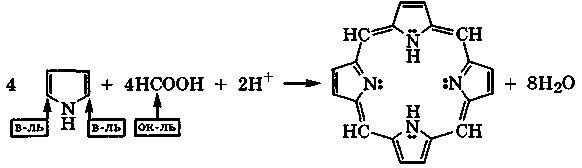
порфин
Эта конденсация, естественно, тоже сопровождается окислением α-углеродных атомов пиррола и восстановлением углеродных атомов муравьиной кислоты.
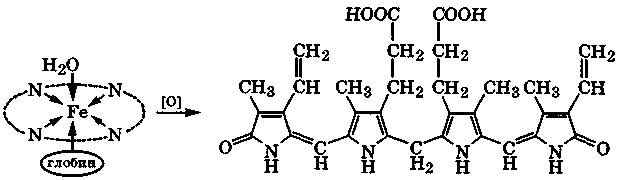
Плоский макроцикл порфина является ароматической сопряженной системой, π-электронное облако которой содержит 26 электронов (22 электрона одиннадцати двойных связей и две неподеленные электронные пары двух атомов азота). Это соответствует правилу ароматичности 4n+2, где п = 6. Порфины, частично или полностью замещенные в пиррольных циклах, называются порфиринами. Это активные хелатообразующие четы-рехдентатные лиганды, входящие в состав важных природных комплексных соединений: гемоглобина, цитохромов, хлорофилла (разд. 10.4).
При биологическом окислении в печени гемоглобина и других порфиринсодержащих метаболитов образуются билирубиноиды, содержащие линейную тетрапиррольную систему. Наиболее важный из них - билирубин имеет оранжевую окраску.
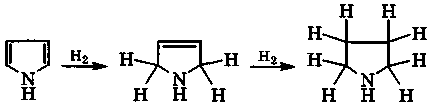
пиррол пирролин пирролидин
При этом ароматическая система пиррола разрушается и атом азота переходит в sр3-состояние. В результате основность полученных соединений намного выше, чем основность пиррола (рKа(ВН+) = -3,8). Так, для пирролидина рКа(ВН+) = 11,3. Пиррол идиновое кольцо входит в состав α-аминокислот (пролин, гидроксипролин), а также алкалоидов (никотин):
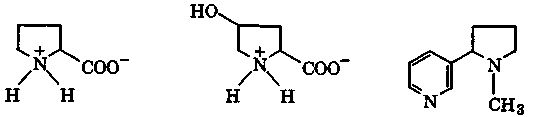
пролин 4-гидроксипролин никотин
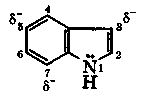
Индол (бензопиррол) является конденсированным гетероциклическим соединением, состоящим из бензольного и пиррольного ядра. Индол имеет циклическую сопряженную систему, содержащую 10 электронов. В индоле электронодонорное действие атома азота проявляется в повышении электронной плотности на углеродных атомах, особенно в положениях 3, 5 и 7. В отличие от пиррола, в индоле электрофильные реагенты прежде всего атакуют углеродный атом в положении 3, что обусловлено влиянием бензольного цикла. Индол, подобно пирролу, практически не обладает основными свойствами, ацидофобен, ведет себя как слабая NH-кислота (рКа = 17), легко окисляется, из-за чего быстро темнеет на воздухе.
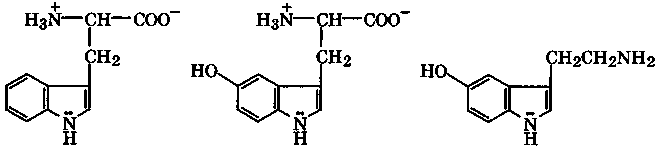
Среди биологически активных производных индола прежде всего следует отметить α-аминокислоту — триптофан. В организме триптофан гидроксилируется в 5-гидрокситриптофан, который в результате декарбоксилирования превращается в се-ротонин. Серотонин играет исключительно важную роль в обмене веществ у высших млекопитающих, регулируя передачу импульсов в нервных тканях и кровяное давление.
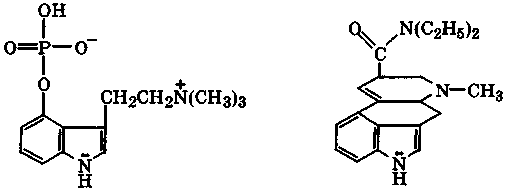
Производными индола являются наиболее сильные галлюциногены: псилоцибин и диэтиламид лизергиновой кислоты (ЛСД). Последний — наиболее сильнодействующий наркотик, его действующая доза около 10-3 мг. Эти галлюциногены — антагонисты серотонина, поэтому их применение нарушает концентрацию серотонина в мозге, что приводит к отклонению от нормального психического состояния.
Имидазол. Это достаточно высокоплавкое и высококипящее вещество (т. пл. 90 "С, т. кип. 256 °С) представляет собой пятичленный гетероцикл с двумя атомами азота, находящимися в 1-м и 3-м положениях кольца. Один из этих атомов аналогичен атому азота в пирроле и ответствен за слабокислотные свойства имидазола, другой похож на пиридиновый атом
азота и обусловлавливает слабоосновные свойства имидазола. Таким образом, имидазол является амфотерным соединением; он способен образовывать соли с сильными кислотами и щелочными металлами.
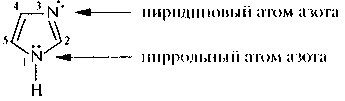
имидазол
Наличие в молекуле имидазола NH-кислотной группировки и основного атома азота —N= служит причиной образования молекулярных ассоциатов за счет водородных связей.
![]()
Следствием такой ассоциации является быстрый межмолекулярный водородный обмен, который приводит к прототропной таутомерии – таутомерии азолов – у некоторых гетероциклов, в частности имидазола, пиразола и их производных.
Прототропная таутомерия между димерами имидазола приводит к тому, что его производные, имеющие одинаковые заместители в разных положениях 4 и 5, неразличимы, поскольку они являются быстровзаимопревращающимися (менее 0,1 с) таутомерами, т. е. фактически одним и тем же веществом.
Имидазол и его производные, являясь, подобно молекуле воды, одновременно и донорами и акцепторами протонов, обладают исключительной способностью катализировать электрофильно-нуклеофильные реакции. Это обусловлено их способностью одновременно и согласованно воздействовать на электрофильные и нуклеофильные центры взаимодействующих соединений. Такое свойство имидазола играет важную роль в механизме действия гидролитических ферментов, способствующих гидролизу сложных эфиров, амидов и пептидов.
Высокая поляризуемость имидазола и его производных и повышенная нуклеофильность атома N-3 делают эти соединения активными лигандами по отношению к катионам d-металлов. Поэтому во многих металлопротеидах связь белка с катионом металла осуществляется через атом N-3 имидазольного заместителя α-аминокислоты гистидина.
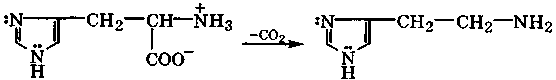
гистидин гистамин
Пиразол – является изомером имидазола. Атомы азота в цикле пиразола расположены рядом. В химическом поведении этих двух изомерных пятичленных гетероциклов имеется много общего. Подобно имидазолу пиразол амфотерен и склонен к образованию ассоциатов. Для монозамещенных производных пиразола также характерна прототропная таутомерия.
пиразол
Производные пиразола в природе не обнаружены. Наиболее известным производным пиразола является пиразолон-5, для которого практически обнаружены четыре изомерные формы — две гидрокси- и две оксо-формы, между которыми имеет место таутомерное равновесие.
Пиразолон-5
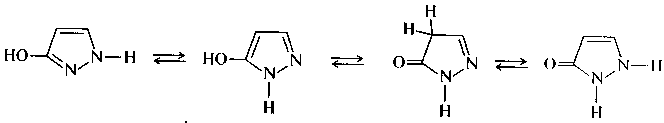
гидроксиформы оксоформы
На основе пиразолона-5 созданы известные лекарственные средства — антипирин, амидопирин, анальгин. Они являются производными оксоформы, которая показана последней.
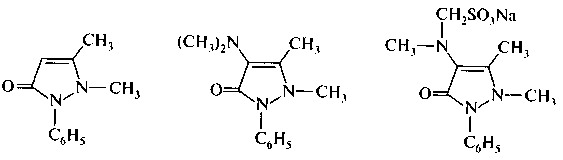
антипирин амидопирин анальгин
2,3 – диметил -1-фенил- 2,3 – диметил -1- фенил-
– пиразолон -5 4 – диметиламинопиразолон - 5
Антипирин является одним из первых синтетических жаропонижающих, болеутоляющих и успокаивающих средств. До недавнего времени использовался и амидопирин. Анальгин, по активности и быстроте действия превосходящий амидопирин и антипирин, является сульфопроизводным амидопирина.
Шестичленные гетероциклы. Среди шестичленных азотсодержащих гетероциклов рассмотрим пиридин, пиримидин и их производные.
Пиридин - бесцветная жидкость, хорошо смешивается с водой и органическими растворителями, имеет неприятный характерный запах. Пиридин токсичен, поражает центральную нервную систему.
Степени окисления углеродных атомов в пиридине
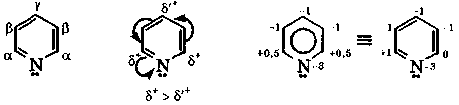
Пиридин является ароматическим соединением. Атомы углерода пиридинового кольца находятся в sp-гибридном состоянии, а атом азота - в состоянии sp2-II. В образовании циклической π-сопряженной системы участвуют шесть p-электронов (по одному от каждого атома цикла, включая гетероатом) (рис. 11).
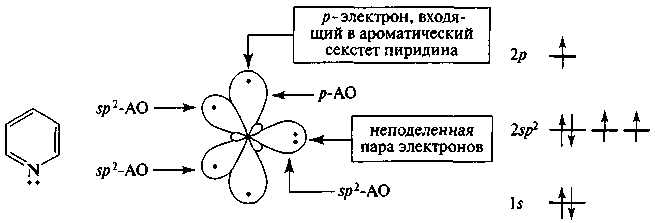
Рис. 11. Распределение электронов пиридинового атома азота по орбиталям
Поскольку электроотрицательность атома азота по сравнению с углеродом больше, то азот стягивает к себе π-электронное облако, понижая электронную плотность ароматического кольца. Из-за этого пиридин является электронодефицитным соединением и труднее, чем бензол, вступает в реакции электрофильного замещения. В пиридине электронная плотность неравномерно распределена по атомам углерода, что подтверждается расчетными и экспериментальными (спектральными) данными. Степени окисления его α-углеродных атомов выше, чем у других углеродных атомов кольца.
В отличие от пиррола, у пиридина неподеленная пара электронов атома азота не участвует в образовании ароматического секстета. Благодаря наличию свободной электронной пары у атома азота пиридин и его производные являются основаниями. С кислотами они образуют соли пиридиния.
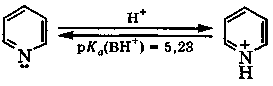
Основность пиридина (рКа(ВН+) = 5,23) несколько больше, чем у анилина (рКа(ВН+) = 4,60), но значительно меньше основности алифатических аминов (рКа(ВН+) ≈ 10).
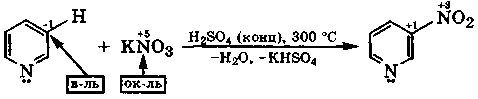
пиридин 3-нитропиридин
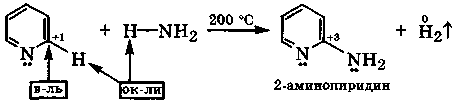
Рассмотренные реакции замещения являются одновременно реакциями межмолекулярного окисления-восстановления.
Каталитическое гидрирование пиридина водородом протекает постепенно и трудно, а приводит в итоге к пиперидину:
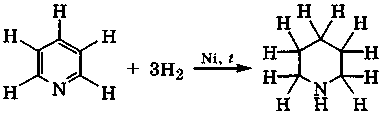
Реакция сопровождается восстановлением атомов углерода кольца, а также переходом всех его атомов, включая атом азота, в электронное состояние sp3. Поэтому основность азота возрастает: рКа(ВН+) = 11,0.
Атом азота в пиридине является нуклеофилом и способен алкилироваться с образованием четвертичных алкилпиридиниевых солей:
![]()
При этом электронодефицитность пиридиниевого ядра повышается из-за появления положительного заряда на атоме азота.
Производные пиридина. Многие природные соединения: витамины, коферменты, алкалоиды и большое число лекарственных препаратов - являются производными пиридина.
Никотин - бесцветное масло с табачным запахом, его содержание в листьях табака доходит до 8 %. Соединение очень ядовито, летальная доза для человека - 40 мг. Воздействует на вегетативную нервную систему и сужает кровеносные сосуды. Не исключено, что это является следствием изменения состояния воды внутри клеток соответствующих тканей из-за проникновения в них никотина - гидрофобного соединения (разд. 11.3 и 11.4).
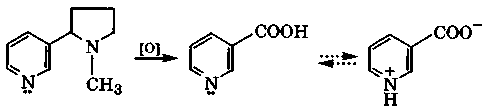
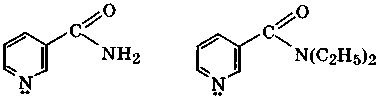
Одним из продуктов окисления никотина в жестких условиях является никотиновая кислота (β-пиридинкарбоновая кислота), которая имеет амфотерные свойства: рКа(СООН) = 2,07, рКа(ВН+) = 4,73. Подобно α-аминокислотам она в кристаллическом состоянии и отчасти в растворах существует в виде таутомера с биполярно-ионной структурой. Никотиновая кислота - провитамин, поскольку ее амид — никотинамид — является витамином PP. Недостаток этого витамина вызывает заболевание кожи, называемое пеллагрой. Диэтиламид никотиновой кислоты - кордиамин используется как эффективный стимулятор центральной нервной системы.
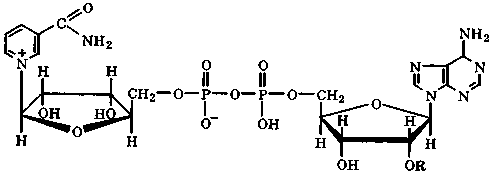
НАД+ (R=H)
НАДФ+ (R= -РО(ОН)2)
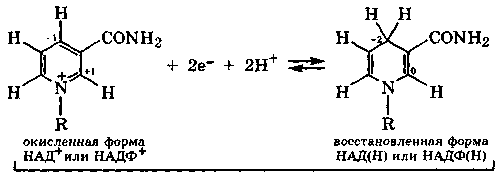
сопряженная окислительно-восстановительная пара
НАД+
![]() =
-
0,320 В НАДФ+
=
-
0,324 В
=
-
0,320 В НАДФ+
=
-
0,324 В
Все окислительно-восстановительные превращения биосубстратов под действием никотинамиднуклеотидов являются реакциями межмолекулярной дисмутации за счет углеродных атомов участников реакции. При переходе окисленной формы коферментов в восстановленную происходит накопление энергии, выделяемой при окислении субстрата. Накопленная восстановленной формой энергия затем расходуется в других эндэргонических процессах с участием этих коферментов (разд. 9.3.3).
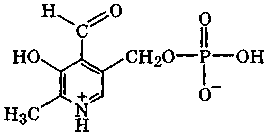
пиридоксальфосфат
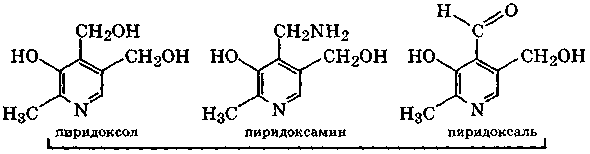
Сочетание трех индивидуальных веществ: пиридоксола, пиридоксамина и пиридоксаля – рассматривают как витамин В6 (пиридоксин), так как в организме они все способны перейти в пиридоксальфосфат, участвующий в химических реакциях, связанных с деятельностью данного витамина. Отсутствие в пище витамина В6 сопровождается резким нарушением обмена белков и липидов, что ведет к развитию атеросклероза, различных дерматитов и нарушению кроветворения.
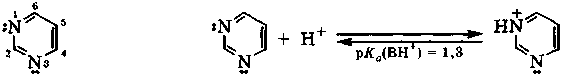
Основность пиримидина резко понижена по сравнению с пиридином (рКа(ВН+) = 5,2) из-за электроноакцепторных свойств второго атома азота, находящегося в ядре. Протонизация одного атома азота настолько понижает основность другого атома азота, что дальнейшее солеобразование в естественных условиях не происходит.
Большое значение в химии нуклеиновых кислот имеют следующие оксо- и аминопроизводные пиримидина: урацил, тимин и цитозин:
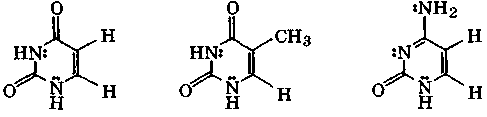
лактимный лактамный
таутомер таутомер
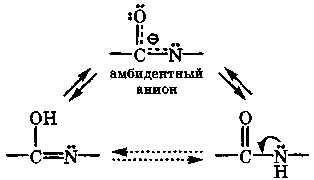
У таутомеров имеется общий амбидентный анион, отрицательный заряд которого делокализован между атомами, участвующими в таутомерии. Последнее обстоятельство объясняет двойственную реакционную способность рассмотренных соединений, т. е. способность образовывать и О- и N-производные. Исследования кислотно-основных свойств и спектральных характеристик указанных оксопиримидинов и родственных им соединений свидетельствуют, что и в кристаллах, и в растворах для них характерна только лактамная форма, а их ионы амбидентны.
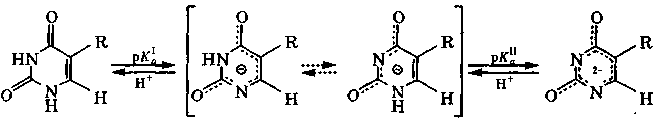
смесь таутомеров моноаниона дианион
рК рК
урацил (R=H) 9,4 13,9
тимин (R=СН3) 9,9 13,9
Таким образом, в биологических средах с рН<7,5 урацил и тимин существуют в молекулярной форме.
Цитозин - амфолит: он протонируется по атому N-1, имеющему свободную от участия в сопряжении электронную пару, а за счет депротонирования атома N-3 проявляет слабые кислотные свойства:
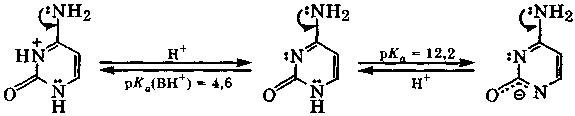
цитозина цитозина цитозина
В биологических средах с рН = 3÷6 цитозин существует в виде смеси катионов и молекул, а при рН ≈ 7 - в молекулярной форме.
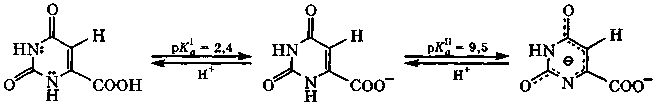
оротоновая кислота
Оротат калия - стимулятор обменных процессов в организме.
Для барбитуровой кислоты характерна кето-енольная таутомерия с преобладанием кетотаутомера ( ≈ 98 %). Барбитуровая кислота - достаточно сильная СН-кислота. Лактимная форма для этой кислоты не обнаружена.
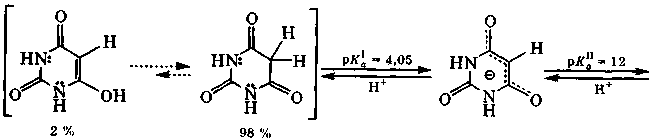
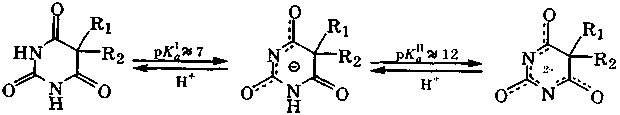
барбитал (веронал) R1=R2=С2Н5
фенобарбитал (люминал) R1= С2Н5; R2= С6Н5
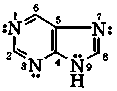
пурин
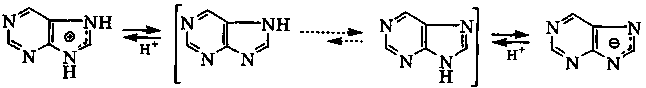
катион пурина таутомер N7Н таутомер N9Н анион пурина
рКа(ВН+) = 2,4 молекула пурина рКа = 9,9
Оксо- и аминопроизводные пурина — аденин и гуанин входят в состав нуклеиновых кислот. В молекуле аденина у трех атомов азота N-l, N-3 и N-7 неподеленные электронные пары не участвуют в сопряжении, находясь на sр2-орбиталях, у двух других атомов азота неподеленные электронные пары, находясь на р-орбиталях, активно участвуют в сопряжении. Для аденина, как и для пурина, наблюдается прототропная таутомерия за счет миграции протона между N-7 и N-9. Обычно аденин изображают с протоном у атома N-9, хотя в его водных растворах содержание таутомера N7H в 2,5 раза выше. Аденин является амфолитом, способным, в зависимости от кислотности среды, или присоединять протон к пиримидиновому атому азота, образуя катион, или отщеплять протон от имидазольного атома азота с образованием аниона:
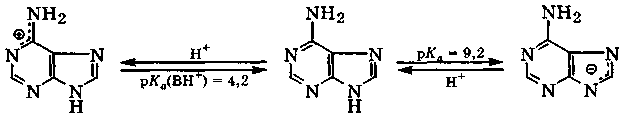
В биологических средах с рН ≈ 7 аденин находится в основном в виде молекул, а в кислых средах (рН = 3÷6) — в виде смеси молекул и катионов. Аденин входит в состав некоторых коферментов, аденозинтрифосфорной кислоты (АТФ) и ее производных АДФ и АМФ.
Для гуанина характерна лактамная форма, поэтому неподеленная электронная пара атома N-1 находится на р-орбитали и активно участвует в сопряжении. В соответствии с кислотно-основными свойствами гуанин, в зависимости от рН-среды, в водных растворах может находиться в форме катиона, молекулы, моно- или дианиона:
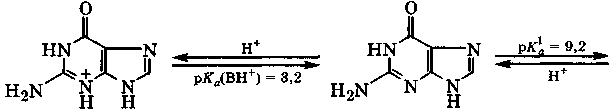
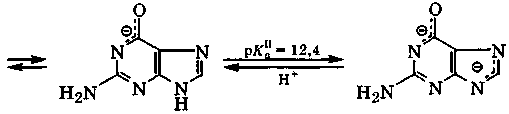
анион гуанина дианион гуанина
В биологических средах с рН = 3÷6 гуанин находится в виде смеси молекул и катионов, а при рН = 7÷9 - молекул и моноанионов. Таким образом, из всех азотистых оснований нуклеиновых кислот наиболее сильные основные свойства проявляет аденин.
В условиях организма цитозин и гуанин - слабые основания, а урацил и тимин - слабые кислоты. Для всех этих гетероциклических соединений характерно образование водородных связей, при котором они выступают одновременно и как доноры, и как акцепторы протонов. Эта их способность реализуется при построении нуклеиновых кислот.
Следует обратить внимание, что в имидазольном кольце производных возможна имин-иминная таутомерия , которая на примере гипоксантина может быть показана следующим образом:
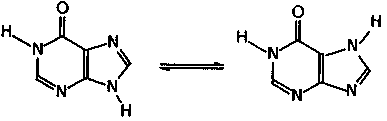
гипоксантин
Превращение аденина в гипоксантин легко осуществляется ферментативным способом, поэтому гипоксантин обнаружен во многих тканях растений и животных.
Как и аденин, гуанин в организме дезаминируется с образованием 2,6-диоксипурина, именуемого ксантином.
Ксантин представляет собой важное промежуточное звено азотистого обмена. Следует обратить внимание на то, что окисление гипоксантина приводит к ксантину, а из него, в свою очередь, при окислении возникает мочевая кислота.
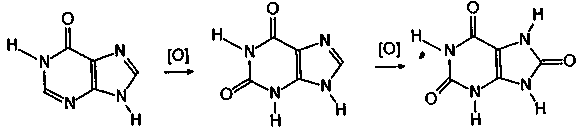
гипоксантин ксантин мочевая кислота
Мочевая кислота - продукт обмена веществ в живых организмах. В значительных количествах встречается в экскрементах птиц (≈ 25 %) и особенно змей (≈ 90 %). Мочевая кислота является двухосновной NH-кислотой (рК = 5,4, а рК = 11,3) и образует два ряда солей-уратов, большинство из которых, как и сама мочевая кислота, плохо растворяются в воде.
Важными природными производными ксантина являются алкалоиды теофиллин, теобромин и кофеин, обнаруженные в чае, какао и кофе.
Они представляют собой метильные гомологи ксантина, а именно, теофиллин - это 1,3-диметилксантин, теобромин представляет собой 3,7-диметилксантин, а кофеин - 1,3,7-триметилксантин.
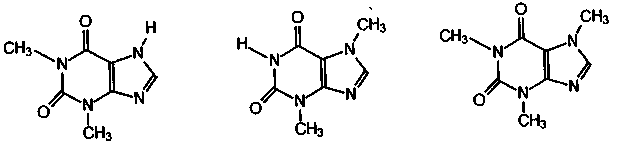
1,3-диметилксантин 3,7-диметилксантин 1,3,7-триметилксантин
теофиллин теобромин кофеин
Искусственным путем теобромин и кофеин, оказывающие стимулирующее действие на центральную нервную систему, можно получить из ксантина.
