
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ ОТКРЫТЫЙ УНИВЕРСИТЕТ
имени В.С. Черномырдина»
Губкинский институт (филиал)
![]()
Физика Механика
«Определение отношения теплоемкостей
для воздуха методом адиабатического расширения»
Методические указания к лабораторной работе №11а для направления подготовки
специалистов: |
130400.65 |
- Горное дело |
|
190109.65 |
- Наземные транспортно-технологические средства |
бакалавров: |
080200.62 |
- Менеджмент |
|
140400.62 |
- Электроэнергетика и электротехника |
|
220400.62 |
- Управление в технических системах |
|
270800.62 |
- Строительство |
|
190600.62 |
- Эксплуатация транспортно-технологических машин и комплексов |
Губкин, 2011
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ ОТКРЫТЫЙ УНИВЕРСИТЕТ
имени В.С. Черномырдина»
Губкинский институт (филиал)
УТВЕРЖДЕНО
Директором Губкинского
института (филиала) МГОУ
Физика Механика
«Определение отношения теплоемкостей
для воздуха методом адиабатического расширения»
Методические указания к лабораторной работе №11а для направления подготовки
специалистов: |
130400.65 |
- Горное дело |
|
190109.65 |
- Наземные транспортно-технологические средства |
бакалавров: |
080200.62 |
- Менеджмент |
|
140400.62 |
- Электроэнергетика и электротехника |
|
220400.62 |
- Управление в технических системах |
|
270800.62 |
- Строительство |
|
190600.62 |
- Эксплуатация транспортно-технологических машин и комплексов |
Губкин, 2011
УДК 53
Ф 50
Физика. Часть 1. Определение отношения теплоемкостей для воздуха методом адиабатического расширения: Методические указания к лабораторной работе №11а / Сост. А.Н. Ряполов, Н.В. Ряполова; Рец. к.т.н., доцент кафедры физики КГТУ А.А. Чернышова, к.т.н., зав.кафедрой теоретической и прикладной механики ГИ (филиала) МГОУ доцент И.С. Булгаков. - Губкин.: ГИ МГОУ, 2011.- 13с.
Методические указания включают рекомендации и указания по выполнению лабораторной работы, в которой определяется отношение теплоемкостей для воздуха методом адиабатического расширения.
Указания содержат краткую теоретическую часть; описание экспериментальной установки, порядок выполнения работы, контрольные вопросы и указана литература по теории.
Предназначены для студентов технических специальностей вузов.
© Губкинский институт (филиал) Московского государственного открытого университета, 2011.
© А.Н. Ряполов, Н.В. Ряполова, 2011.
Лабораторная РАБОТА №11-а
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕМКОСТЕЙ ДЛЯ ВОЗДУХА МЕТОДОМ АДИАБАТИЧЕСКОГО РАСШИРЕНИЯ
Цель работы: определить коэффициент Пуассона для воздуха экспериментальным путем, расширить и углубить представление о первом начале термодинамики, законах идеального газа.
Приборы и принадлежности: лабораторный комплекс ЛКТ–2А №14.
КраткОЕ теорЕТИЧЕСКОЕ ВВЕДЕНИЕ
Коэффициент
Пуассона
![]() ,
,
где Ср - молярная теплоемкость газа при постоянном давлении,
Сv - молярная теплоемкость газа при постоянном объеме.
Теплоемкость газов зависит от условий нагревания. Выясним эту зависимость, воспользовавшись уравнением состояния одного моля газа
![]() ,
(1)
,
(1)
где р- давление,
V - объем,
Т - термодинамическая температура газа,
R - молярная газовая постоянная.
Первое начало термодинамики имеет вид
![]() ,
(2)
,
(2)
где dU- элементарное изменение внутренней энергии газа,
dQ- элементарное количество теплоты, переданное газу,
dA- элементарная работа, совершаемая газом над внешними телами.
Теплоемкость тела равна количеству теплоты, которую нужно сообщить телу, чтобы нагреть его на 1 кельвин.
По определению теплоемкости имеем
![]() или с учетом (2)
или с учетом (2)
![]() (3)
(3)
Работа, совершаемая газом над внешними телами равна
![]() (4)
(4)
Из уравнения (З) видно, что теплоемкость газа может иметь разные значения при различных способах нагревания.
Рассмотрим основные процессы, которые могут совершаться с газами.
1. Изохорический процесс - процесс, происходящий при постоянном объеме (V=const). Тогда dV=0, dA=рdV, т.е. dQ=dU
С учетом этого из (З) следует
![]() , (5)
, (5)
где Сv - молярная теплоемкость при постоянном объеме.
2. Изобарический процесс - процесс, происходящий при постоянном давлении (р=const).
Из (3) и (4) имеем
![]() , (6)
, (6)
где Ср - молярная теплоемкости при постоянном давлении.
Для установления зависимости между Сv и Ср воспользуемся уравнением (1), почленно дифференцируя которое, имеем:
![]() (7)
(7)
Так как для изобарического процесса р = const, т.е. dр = 0 то (7) примет вид
![]() (8)
(8)
Интегрируя (8) получим
![]()
Отсюда видно, что молярная газовая постоянная численно равна работе по расширению одного моля газа при нагревании его на ΔΤ=1К в условиях постоянного давления (физический смысл молярной газовой постоянной).
Подставив в уравнение (6) значения из уравнений (5) и (8), получим уравнение Майера
![]() (9)
(9)
3.
Изотермический процесс - процесс,
происходящий при постоянной температуре,
Т=const,
dT=0.
Так как
![]() ,
то dU=0
,
то dU=0
В этом случае (2)
будет иметь вид dQ
= dA,
т.е. все подводимое тепло расходуется
на работу по расширению газа. Молярная
теплоемкость при постоянной температуре
![]() .
.
4. Адиабатический процесс - процесс, протекающий без теплообмена с окружающей средой, dQ = 0.
В этом случае уравнение (2) примет вид dU + dA = 0 или dA = -dU т.е. работа совершается газом за счет убыли его внутренней энергии. Так как dQ=0, то теплоемкость при этом процессе также равна нулю.
Адиабатический процесс описывается уравнением Пуассона
![]() ,
(10)
,
(10)
где
![]() -
коэффициент Пуассона.
-
коэффициент Пуассона.
Из молекулярно-кинетической
теории известно, что внутренняя
энергия одного моля газа равна
![]() ,
,
где i - число степеней свободы данного газа. Число степеней свободы определяет число независимых координат, полностью описывающих положение молекулы газа в пространстве. Для идеального одноатомного газа необходимы три координаты, описывающие поступательное движение такой молекулы в пространстве. Следовательно, ему приписывают три степени свободы.
Молекула двухатомного идеального газа рассматривается как совокупность двух материальных точек-атомов, жестко связанных недеформируемой связью. Эта система кроме трех степеней свободы поступательного движения имеет еще две степени свободы вращательного движения. Таким образом, двухатомный идеальный газ обладает пятью степенями свободы. Трехатомные и многоатомные нелинейные молекулы имеют шесть степеней свободы - три поступательных и три вращательных. Естественно, что жесткой связи между атомами не существует. Поэтому для реальных молекул необходимо учитывать также степени свободы колебательного движения.
![]() .
.
Подставляя это выражение в (5), получим
![]() .
(11)
.
(11)
С учетом (11) выражение (9) примет вид
![]() (12)
(12)
С учетом (11) и (12) получим теоретическое значение коэффициента
Пуассона
![]() (13)
(13)
ОПИСАНИЕ ЭКСПЕРИМЕНТАЛЬНОЙ УСТАНОВКИ
Для
реализации классического эксперимента
Клемана-Дезорма по нахождению отношения
![]() используется модуль 05 "автоклав-манометр"
с ввернутым в него блоком дросселей 6
(рис.1).
используется модуль 05 "автоклав-манометр"
с ввернутым в него блоком дросселей 6
(рис.1).
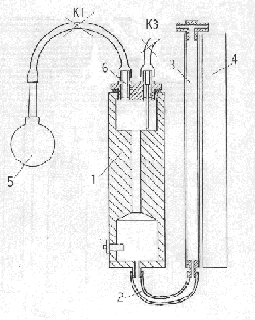
Рис.1.Автоклав – манометр.
Полость автоклава 1 соединена шлангом 2 с мерной трубкой (правое колено манометра) 3, расположенной вдоль линейки 4, по которой отсчитывают уровни жидкости (превышение давлений над атмосферным давлением). Разность давлений определяется по смещению уровня воды в мерной трубке.
Через кран К1 система соединена с грушей-помпой 5. Через кран К3 система соединена с атмосферой.
ВНИМАНИЕ! При заливании в систему сырой воды результат будет искажен растворенным в воде воздухом.
Перед выполнением работы проверить уровень воды в колене манометра. Он должен соответствовать начальному уровню ho = 0.
Изобразим в р-V координатах диаграмму процесса определения коэффициента Пуассона для воздуха методом адиабатического расширения.
Для описания состояния воздуха воспользуемся уравнением Менделеева-Клапейрона
![]() ,
,
где m - масса воздуха в баллоне,
M-молярная масса воздуха.
Преобразуем это
уравнение, разделив правую и левую
часть его на m. Учитывая, что
![]() ,
где V'
- объем
занимаемый единицей массы воздуха
и называемый удельным объемом,
окончательно получим
,
где V'
- объем
занимаемый единицей массы воздуха
и называемый удельным объемом,
окончательно получим
![]() (14)
(14)
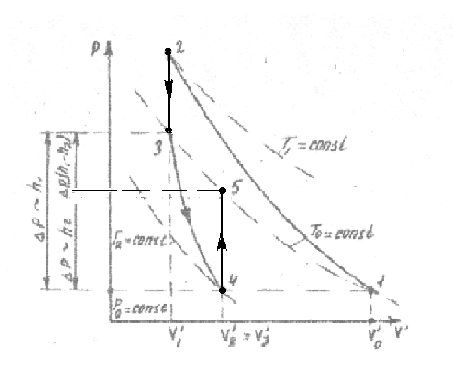
Рис.2. Диаграмма процесса.
Начальному состоянию
воздуха с параметрами ро,
To,
Vo
на рис. 2 соответствует точка (1). Исходно
выпускной кран закрыт. Накачиваем воздух
в баллон насосом. Изменение состояния
воздуха в баллоне при этом есть процесс
с переменной массой (кривая 1-2, рис. 2).
Увеличение давления воздуха в конце
накачивания определяется как ростом
его температуры до значения Т1
>
Т0
за счет работы насоса, так и увеличением
массы газа (или концентрации его молекул)
в соответствии с формулой
![]()
Сразу после накачивания состояние газа в точке 2 рис. 2 . определяется параметрами р1, V1, T1. После накачивания воздух постепенно охлаждается при постоянном объеме (переход 2-3 изохора). На графике (рис.2) этот переход изобразится прямой, параллельной оси ординат, при этом состояние газа в точке З определяется параметрами р2, V1, Tо.
где То - температура окружающей среды. О том, что температура воздуха стала равна температуре окружающей среды То , можно судить по прекращению изменения давления р2. Давление р2 представим как
![]() ,
(15)
,
(15)
где ∆р1-превышение давления воздуха в балконе над атмосферным,
-плотность воды, налитой в U- образный манометр,
g-ускорение свободного падения,
h1- разность уровней U -образном манометре.
Затем быстро открывают на некоторое время кран, соединяющий баллон с атмосферой. При небольшой избыточной массе воздуха в баллоне и достаточно большом отверстии в кране, соединяющем баллон с атмосферой, расширение воздуха в баллоне будет происходить достаточно быстро, практически без теплообмена с окружающей средой, т.е. по адиабате (кривая 3-4, рис. 2). При адиабатическом расширении давление воздуха, находящегося в баллоне, будет падать за счет того, что уменьшается концентрация молекул воздуха и его температура будет понижаться, так как воздух совершает работу. Эта работа идет на увеличение кинетической анергии вытекающего газа и его проталкивание в атмосферу. В конце адиабатического расширения (точка 4 рис. 2) воздух в баллоне будет иметь атмосферное давление ро, удельный объем V2 и температуру Т2 < То.
После закрытия крана по истечении некоторого времени в результате теплообмена через стенки баллона с окружающей средой воздух в баллоне снова нагревается до комнатной температуры То. О том, что температура в баллоне стала равной температуре окружающей среды То, можно судить по прекращению изменения давления в сосуде. Воздух перейдет в состояние 5 (переход 4-5 рис. 2). Данный процесс будет изохорическим, так как удельный объем воздуха при этом переходе постоянен. В состоянии 5, воздух имеет параметры р3, V2, То. Давление р можно выразить формулой
![]() ,
(16)
,
(16)
где ∆р3 - превышение давления воздуха в баллоне над атмосферным,
h2 - конечная разность уровней в U - образном манометре.
Значение параметров состояния газа в точках 1-5 занесем в табл. I.
Таблица 1.
Точка 1 рo , Vo ,То
Точка 2 р1 , V1 ,Т1
Точка 3 р2 , V1 ,То
Точка 4 рo , V2 ,Т2
Точка 5 р3 , V2 ,То
Как видно из табл. 1 газ в точках 3 к 5 имеет одну и ту же температуру То, что согласно (I4) дает возможность записать
![]() (17)
(17)
Соотношение (17) можно также получить из закона Бойля-Мариотта.
Переход воздуха из состояния 3 в состояние 4 адиабатический. Для этого перехода, согласно (10) имеем:
![]() (I8)
(I8)
с учетом (I5) и (16) уравнения (17) и (I8) примут вид
![]() (19)
(19)
![]() (20)
(20)
Логарифмируя (I9) и (20), получим соответственно
![]()
![]()
Преобразуя каждое из этих уравнений получим

![]() (21)
(21)
![]()
Решая систему уравнений (21) относительно γ получим

Учитывая, что ρgh < po и используя то, что ln(1+х) ≈ х если х < 1, получим
![]()
Сокращая на ρg
в первом сомножителе и полагая второй
сомножитель
![]() (в силу того, что ρgh2
< pо)
окончательно получим
(в силу того, что ρgh2
< pо)
окончательно получим
![]() (23)
(23)
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
На передней панели установки (рис.3) открыть кран К1 груши - помпы (Г-П), и закрыть кран К3 (горизонтальное положение рукоятки).

Рис.3 Передняя панель установки.
С помощью груши-помпы (Г-П) накачивать воздух в систему до тех пор, пока уровень воды в мерной трубке не поднимется на 150-200 мм.
Закрыть кран груши-помпы и кран К1.
Выждав 1-2 мин., зарегистрировать избыточное давление h1 (в мм водяного столба). Результат занести в таблицу 2.
Открыть кран К3, и в тот момент, когда уровень воды в мерной трубке станет равен ho, закрыть его.
Выждав 1-2 мин, зарегистрировать перепад давления h2 (в мм водяного столба). Результат занести в таблицу 2.
Открыть кран груши-помпы, и кран К1.
Повторить эксперимент 5 раз, начиная с пункта 2 и заканчивая пунктом 7. Результаты занести в таблицу 2.
Обработка результатов опыта
1. По формуле (23) вычислить значение γ по данным, полученным в каждом опыте. Результат занести в таблицу 2.
2. Найти среднее
значение γ и абсолютные погрешности
каждого измерения
![]() .
Результаты записать в таблицу 2.
.
Результаты записать в таблицу 2.
3. Найти абсолютную и относительную погрешности для одного из измерений величины γ по величине приборной погрешности Δh1= Δh2=2κ где κ - цена деления по шкале манометра:
![]()
![]() (24)
(24)
Таблица 2
№ опыта |
h1, (мм) |
h2, (мм) |
|
γ |
Δγ |
γтеор. |
,% |
1. |
|
|
|
|
|
|
|
2. |
|
|
|
|
|
|
|
3. |
|
|
|
|
|
|
|
4. |
|
|
|
|
|
|
|
5. |
|
|
|
|
|
|
|
4.
Сравнить абсолютную погрешность,
найденную
по формуле
(24) с отклонением
![]() для соответствующего опыта в таблице
2,
объяснить
различие между ними, если
оно существует.
для соответствующего опыта в таблице
2,
объяснить
различие между ними, если
оно существует.
5. Вычислить теоретическое значение γтеор. по формуле (13).
Воздух более чем на 99% состоит из двухатомных молекул, для которых i = 5.
6.
Найти относительную погрешность
измерений коэффициента Пуассона γ
по формуле
![]() .
Результат записать в таблицу 2.
.
Результат записать в таблицу 2.
