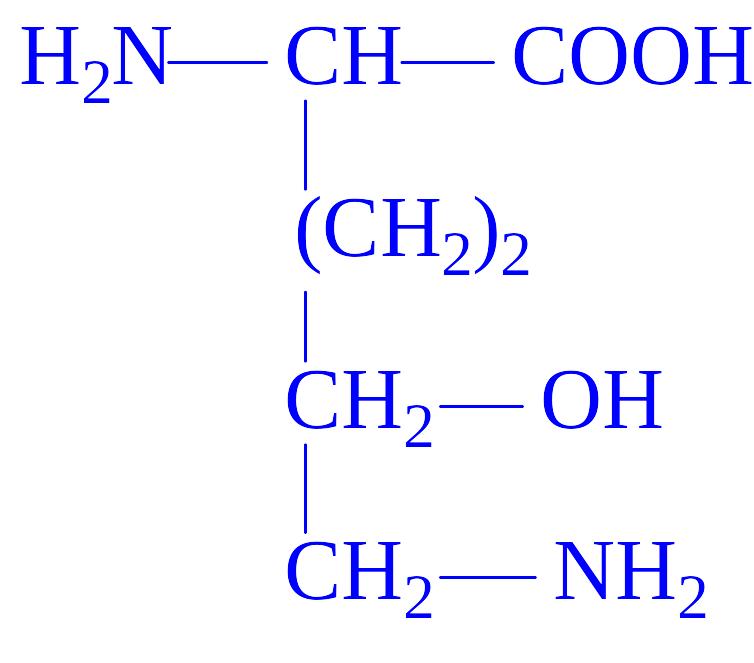- •Лекція № 4. Білки. Амінокислоти
- •Білки. Амінокислоти
- •Функції білків
- •Хімічний склад білків
- •Амінокислоти
- •Властивості аміногрупи
- •Методи визначення n-кінцевих амінокислот
- •Методи виділення та ідентифікації амінокислот
- •Будова білків
- •Характеристика конформацій поліпептидів
- •Фізико-хімічні властивості білків
- •Визначення молекулярної маси білків
- •Фракціонування білків
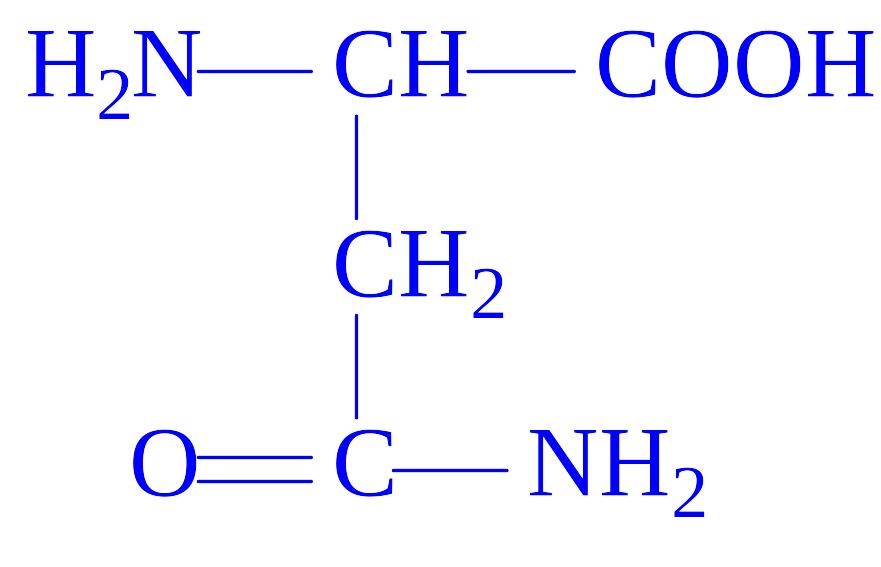
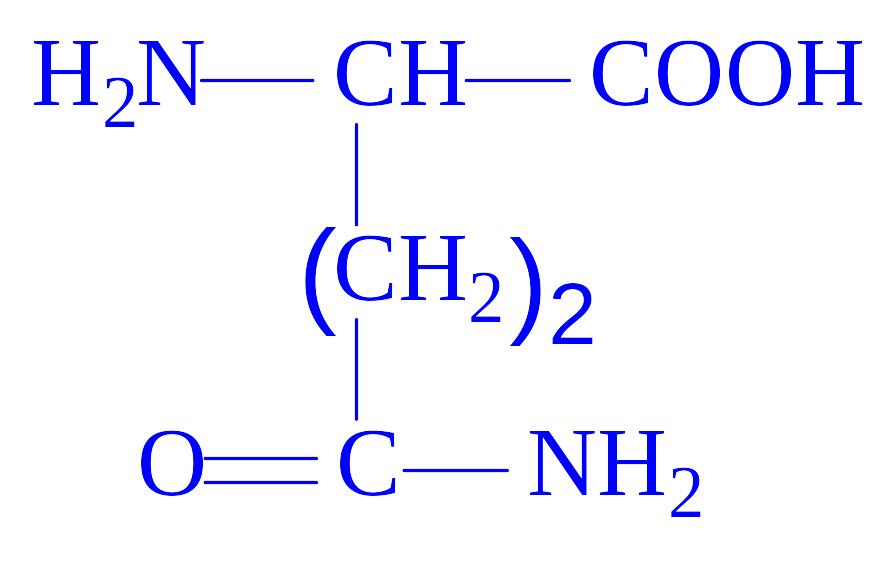
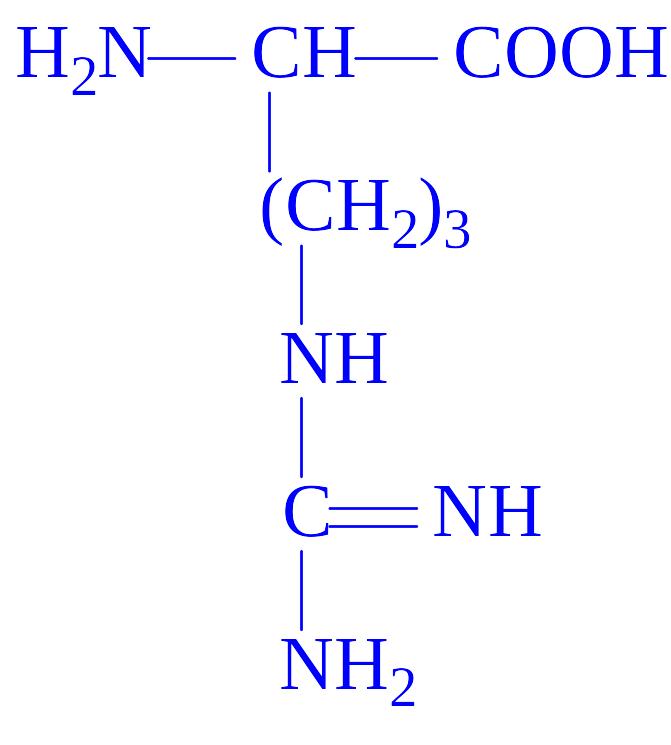
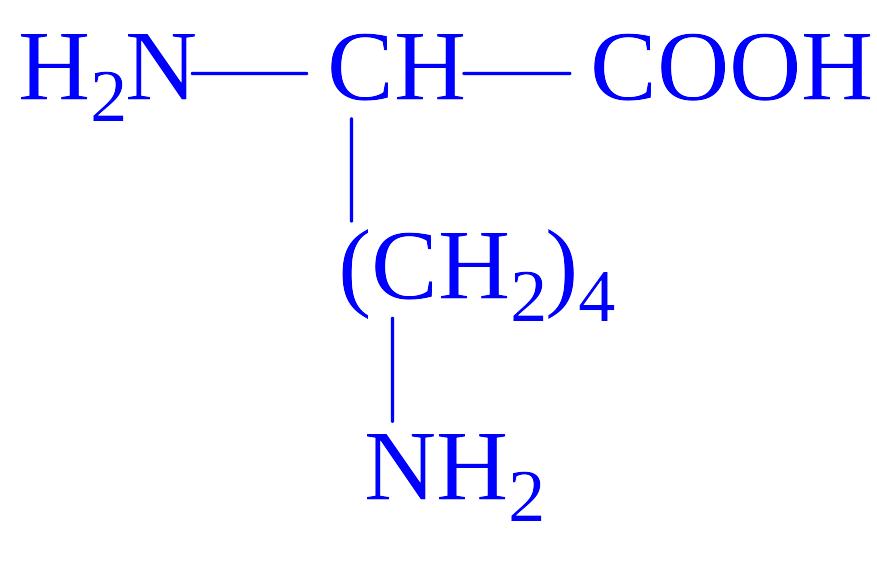
- •Класифікація білків
Хімічний склад білків
Елементний склад. Дослідження елементного складу білків розпочалось ще на початку XIX ст. Перші дані про елементарний склад білків з’явились у 1809 р. на основі досліджень Ф. Грена. У результаті хімічного аналізу білків було визначено їх важливі складові елементи та кількісне співвідношення. Так, було встановлено, що до складу білків входять, %: вуглець – 50 – 55, водень – 6,5 – 7,3, азот – 15 – 17, кисень – 21 – 23, сірка – 0,3 – 2,5. У складі білків було виявлено також фосфор, йод, залізо та інші елементи.
Амінокислотний склад. Разом з визначенням елементного складу білків було розпочато вивчення і їх будови. Спочатку вважали, що основними структурними компонентами молекул білка є пептони, які було виділено при гідролізі різних білків. Пізніше (серед продуктів розщеплення білків) дослідники звернули увагу на речовини, які довгий час розглядалися ними не як складові частини молекул білка, а як продукти дії на білкові речовини сильних хімічних реагентів.
У 1820 р. А. Браконно вперше при кислотному гідролізі білка (желатини) виділив амінокислоту – гліцин. Оскільки амінокислота була солодка на смак, то її назвали глікоколом. Дещо пізніше (у 1871 р. російським хіміком М.М. Любавіним) було доведено, що і при ферментативному гідролізі білки розкладаються на амінокислоти.
Отже, в другій половині XIX ст. було встановлено, що основними структурними компонентами білка є амінокислоти.
Амінокислоти
У живих клітинах синтезується багато макромолекул (білків, нуклеїнових кислот, полісахаридів), які відіграють роль структурних компонентів, біокаталізаторів, гормонів, рецепторів або в них зосереджена генетична інформація. Ці макромолекули представляють собою біополімери, які побудовані з мономерних одиниць, або структурних блоків. В нуклеїнових кислотах мономерними одиницями є нуклеотиди, в складних полісахаридах – цукри і їх похідні, а в білках – L-a-амінокислоти.
Білки, крім того можуть містити й інші компоненти, однак трьохвимірна структура, а відповідно, й їх біологічне значення визначається в основному амінокислотним складом, порядком чергування амінокислот в поліпептидному ланцюзі і як наслідок їх взаємним просторовим розміщенням.
Амінокислоти в клітинах виконують багато важливих функцій; деякі з біологічно важливих сполук, які утворюються із амінокислот наведені в таблиці 3.
Біологічне значення. Амінокислоти являючись будівельними блоками пептидів і білків, виконують і ряд інших важливих функцій. Деякі з них, мабуть приймають участь у передачі нервових імпульсів; прикладами служать гліцин і глютамінова кислота. В їжі повинні міститися незамінні амінокислоти, оскільки організм людини не здатен синтезувати їх в кількостях, достатніх для росту. В результаті метаболізму амінокислот утворюється багато сполук, які мають важливе біологічне значення. Наприклад, при декарбоксилуванні деяких амінокислот утворюються відповідні аміни, і деякі з них (гістамін, g-аміномасляна кислота (ГАМК)) виконують важливі біологічні функції. Ряд аномальних процесів, які виникають в організмах, пов’язані з порушенням транспорту амінокислот до клітин.
Амінокислоти містять в якості функціональних груп аміногрупу і карбоксильну групу. В a-амінокислотах обидві вони зв’язані з одним і тим же (a) вуглецевим атомом:

У природі існує близько 300 амінокислот, однак в білках виявлено тільки 20 з них. У результаті повного гідролізу білків вивільняється 20 L-a-амінокислот (табл. 1). Одні і ті ж 20 амінокислот присутні в білкових молекулах всіх форм життя – рослин, тварин і мікроорганізмів. Чому це так – ми зрозуміємо пізніше, коли будемо обговорювати універсальну природу генетичного коду. Однак, у ряді білків зустрічаються похідні деяких амінокислот, які утворюються вже після включення звичайних амінокислот в молекулу білка (табл. 3).
За виключенням гліцину, у якого R – це атом гідрогену, у всіх амінокислот чотири групи, зв’язані з a-вуглецевим атомом, різні. Дякуючи тетраедричному розміщенню чотирьох різних груп відносно a-вуглецевого атома амінокислота володіє оптичною активністю (здатністю обертати площину поляризації плоскополяризованого світла). Одні амінокислоти, що входять до складу білків, є (при рН=7,0) правообертаючими, а інші – лівообертаючими, однак всі вони мають абсолютну конфігурацію L-гліцеральдегіду і тому є L-a-амінокислотами.
Іонні форми амінокислот. Амінокислоти несуть по крайній мірі дві слабоіонізуючі кислі групи, –СООН і –NH3+. У розчині ці групи знаходяться у двох формах, зарядженій і незарядженій, між якими підтримується протонна рівновага:
R–СООН Û R–СОО- + Н+ і R–NН3+ Û R–NН2 + Н+.
Групи R–СООН і R–NН3+ є протонованими партнерами, тобто кислотами, а R–СОО- і R–NН2 – спряженими основами, тобто акцепторами протонів відповідних кислот. При значеннях рН, характерних для плазми крові і міжклітинної рідини (7,4 і 7,1 відповідно), карбоксильні групи знаходяться виключно у формі карбонілатних іонів, R–СОО-. При цих же значеннях рН більша частина аміногруп знаходиться переважно у асоційованій формі, R–NН3+. Однак в багатьох рівняннях краще використовувати не дисоційовані форми молекул амінокислот, наприклад при обговоренні питання про хімізм реакцій.
Повний сумарний заряд (алгебраїчна сума всіх позитивних і негативних зарядів) амінокислоти залежить від рН середовища, тобто від концентрації протонів гідрогену в розчині. Заряд амінокислоти або її похідного можна змінити, варіюючи значенням рН середовища; це полегшує фізичне розділення амінокислот, пептидів, білків.
Значення рН, при якому сумарний заряд молекули амінокислоти дорівнює нулю, називається ізоелектричною точкою (рІ), саме тому вона не переміщується в постійному електричному полі. Значення ізоелектричної точки знаходиться між найближчими значеннями рК дисоціюючих груп по різні сторони від рІ.
Структура амінокислот. Амінокислоти, які входять до складу білків, є можливість розбити на дві великі групи на основі того, якими є R–групи, зв’язані з атомом a-вуглецю, – полярними і неполярними (табл. 2).
Усі амінокислоти, які виявлено в складі білків, синтезуються в рослинних організмах. В організмі людини і тварин синтезується лише частина протеїногенних амінокислот, а деякі з них утворюються в недостатній кількості для нормального синтезу. В зв’язку з цим усі їх поділяють на три групи: замінні, напівзамінні і незамінні (табл. 2). Останні дві групи в організмі синтезуються в недостатній кількості або не синтезуються взагалі, і тому вони повинні надходити до організму ззовні, в основному з їжею.
Таблиця 1
L-a-амінокислоти, які входять до складу білків1)
№ |
Назва |
Скорочене позначення |
Структурна формула |
З аліфатичними боковими ланцюгами |
|||
1 |
Гліцин |
Глі Gly G |
|
2 |
Аланін |
Ала Ala A |
|
3 |
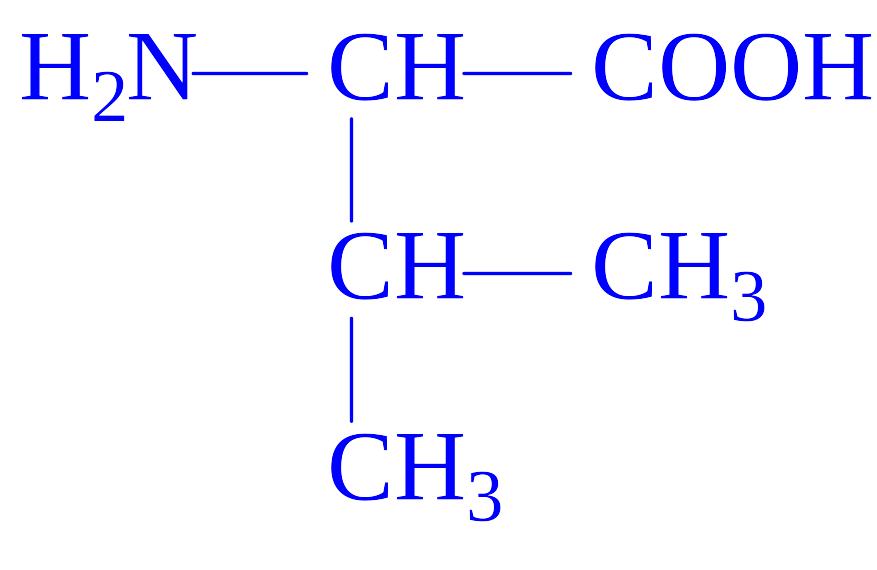
Валін |
Вал Val V |
|
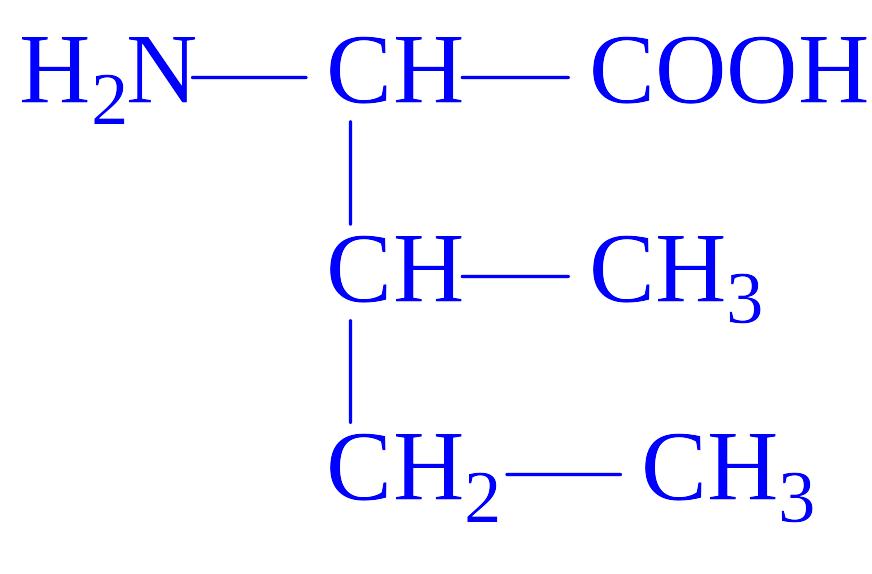
4 |
Лейцин |
Лей Leu L |
|
5 |
Ізолейцин |
Іле Ile I |
|
З боковими ланцюгами, які містять гідроксильні (ОН) групи |
|||
6 |
Серин |
Сер Ser S |
|
7 |
Треонін |
Тре Thr T |
|
8 |
Тирозин |
Тир Tyr Y |
див. нижче |
З боковими ланцюгами, які містять атоми сірки |
|||
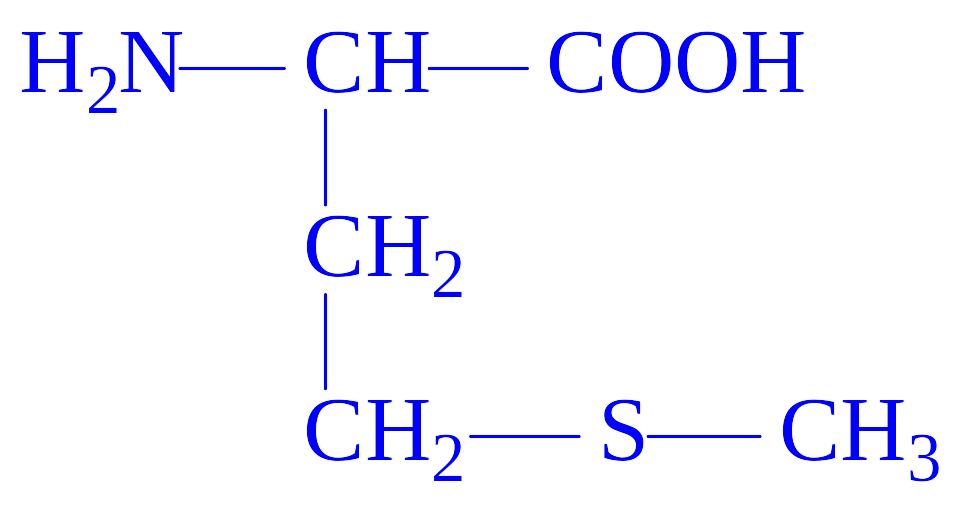
9 |
Метіонін |
Мет Met M |
|
10 |
Цистеїн2) |
Цис Cys C |
|
Імінокислоти |
|||
11 |
Пролін |
Про Pro P |
|
З боковими ланцюгами, які містять кислі групи і їх аміди |
|||
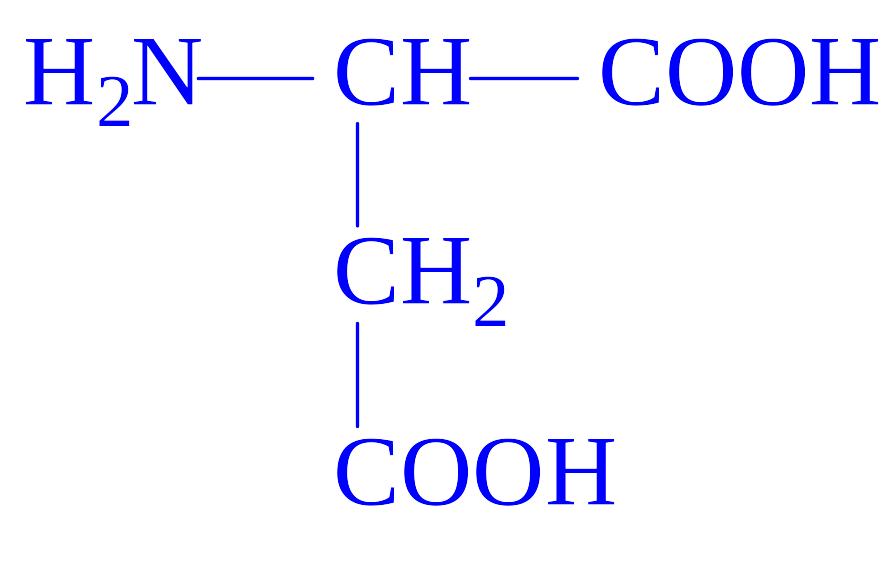
12 |
Аспарагінова кислота |
Асп Asp D |
|
13 |
Аспарагін |
Асн Asn N |
|
14 |
Глютамінова кислота |
Глу Glu E |
|
15 |
Глютамін |
Глн Gln Q |
|
З боковими ланцюгами, які містять основні групи |
|||
16 |
Аргінін |
Арг Arg R |
|
17 |
Лізин |
Ліз Lys K |
|
18 |
Гістидин |
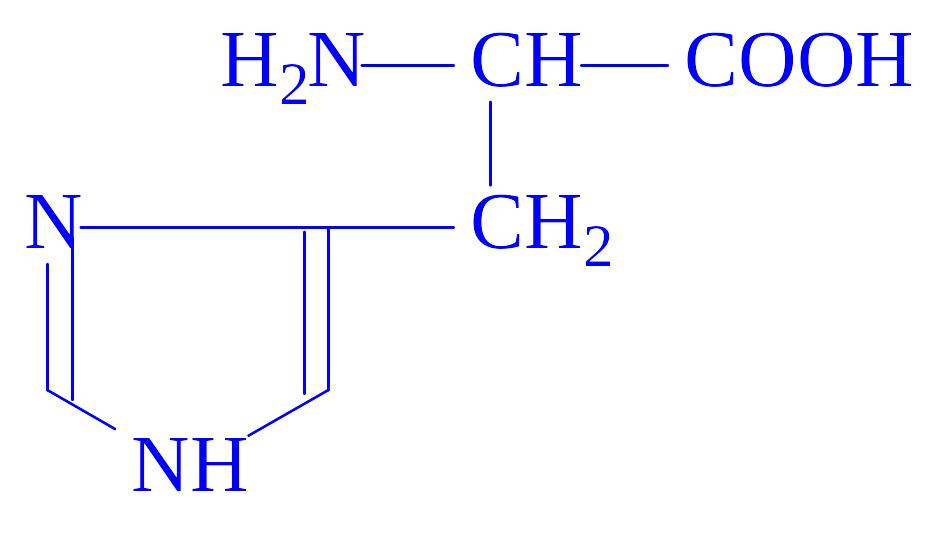
Гіс His H |
|
|
|||
Амінокислоти, які містять ароматичні кільця |
|||
19 |
Гістидин |
Гіс His H |
див. вище |
20 |
Фенілаланін |
Фен Phe F |
|
21 |
Тирозин |
Тир Tyr Y |
|
22 |
Триптофан |
Три Trp W |
|
1) За виключенням гідроксилізину і гідроксипроліну, які включаються до молекул білків у вигляді лізину та проліну, а потім гідроксилюються, для всіх перерахованих в таблиці амінокислот є специфічні тРНК, тому їх включення в білок здійснюється під прямим генетичним контролем.
2) Цистин складається із двох молекул цистеїну, з’єднаних дисульфід ним зв’язком:

У таблиці 1 наведені трьохбуквенні і однобуквені позначення амінокислот, які широко використовуються в біохімії. Однобуквені позначення застосовуються для запису досить довгих амінокислотних послідовностей (наприклад, повних амінокислотних послідовностей білків).
Таблиця 2
Класифікація L-a-амінокислот, які входять до складу білків,
основана на полярності їх R–груп
Неполярні |
Полярні |
Аланін Валін* Ізолейцин* Лейцин* Метіонін* Пролін Триптофан* Фенілаланін* |
Аргінін** Аспарагін Аспарагінова кислота Гістидин** Гліцин Глютамін Глютамінова кислота Лізин* Серин Тирозин** Треонін* Цистеїн |
* - незамінні амінокислоти; ** - напівзамінні амінокислоти. |
|
Амінокислоти, які знаходяться у вільному стані або які входять до складу інших сполук (не білків), виконують важливі функції в багатьох метаболічних процесах (табл. 3). Наприклад, амінокислоти орнітин, цитрулін і аргініносукцинат беруть участь у метаболізмі сечовини. В природних об’єктах виявлено більше 20 D-амінокислот. До їх числа належить D-аланін, D-глутамат, які входять до складу клітинних стінок деяких бактерій; ряд D-амінокислот входить до складу антибіотиків.
Таблиця 3
Деякі амінокислоти, які не входять до складу білків, але відіграють важливу
роль в метаболізмі організму
Назва |
Роль |
Структурна формула |
Гідроксилізин |
Входить до складу колагену та желатини |
|
Гідроксипролін |
Входить до складу колагену та желатини |
|
Орнітин |
Проміжна сполука в метаболізмі треоніну, аспарагінової кислоти і метіоніну. |
|
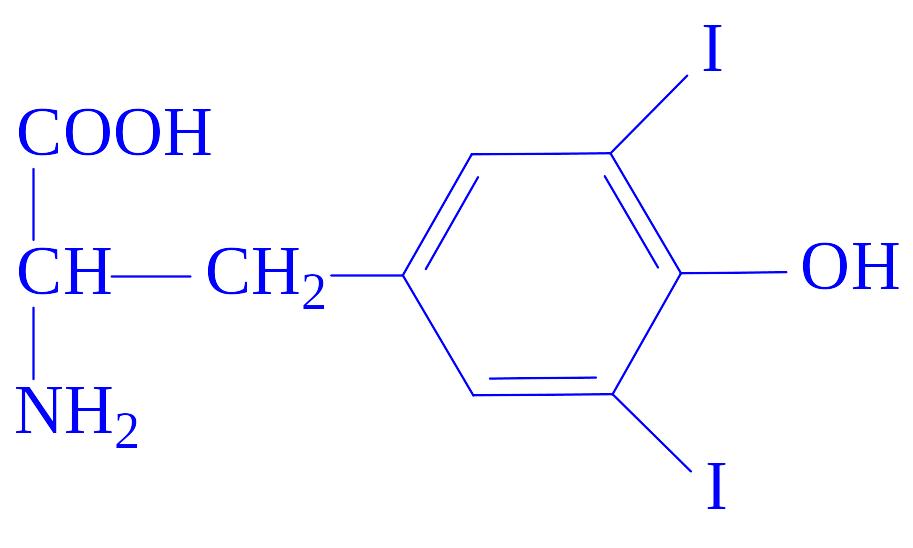
3,5-дийодтирозин |
Попередник тиреоїдних гормонів |
|
Гомоцистеїн |
Проміжна сполука в біосинтезі цистеїну |
|
Гомосерин |
Проміжна сполука в метаболізмі треоніну, аспарагінової кислоти і метіоніну. |
|
Цитрулін |
Проміжна сполука в біосинтезі сечовини |
|
b-аланін |
Складова частина коферменту А і вітаміну пантетеїну |
|
Таурин |
Знаходиться у жовчі в складі кон’югатів жовчних кислот |
|
g-аміномасляна кислота (ГАМК) |
Нейромедіатор, який утворюється із глутамату в тканинах мозку |
|
Розчинність амінокислот. Амінокислоти містять по декілька заряджених груп, тому вони легко піддаються сольватації і добре розчиняються в полярних розчинниках (вода, етанол) і не розчиняються в неполярних розчинниках (бензол, гексан, ефір). Температура плавлення амінокислот досить велика (> 200°C). Це теж обумовлено присутністю в них заряджених груп.
Загальні хімічні властивості амінокислот, які визначаються властивостями карбоксильної і аміногруп
Властивості карбоксильної групи
Як і всі інші сполуки, що містять карбоксильну групу, амінокислоти при взаємодії з основами утворюють солі, а в результаті реакцій із спиртами і амінами утворюють, відповідно, ефіри і аміди.
Важливу роль в біохімії відіграє реакція декарбоксилування амінокислот, в результаті якої карбоксильна група зникає і залишається тільки аміногрупа:

Методи визначення С-кінцевих амінокислот. Для вивчення С-кінцевих амінокислот часто використовують метод гідразинолізу, розроблений японським ученим Ф. Акабборі, який грунтується на гідролізі поліпептидного ланцюга білкової молекули гідразином. При цьому С-кінцева амінокислота відщеплюється у вільному стані, а всі інші амінокислоти – у вигляді сполук з гідразином:

Гідролізат потім обробляють 2,4-динітрофторбензолом, у результаті чого гідразиди перетворюються на ДНФ-гідразиди, а С-кінцева амінокислота – на ДНФ-амінокислоту (див. нижче).
Після цього ДНФ-гідразиди екстракцією (оцтово-етиловим ефіром) відділяють від ДНФ-амінокислот.
Для визначення С-кінцевої амінокислоти застосовують також ферментативний метод, використовуючи панкреатичні карбоксипептидази.
Так, карбоксипептидаза А відщеплює від білка або пептиду лише той амінокислотний залишок, який має вільну карбоксильну групу.
Інформацію про послідовність С-кінцевих амінокислот у ланцюгу можна отримати під час визначення швидкості відщеплення кожного наступного С-кінцевого залишку амінокислоти. Необхідно відзначити, що карбоксипептидаза А малоактивна до залишків С-кінцевих амінокислот лізину, аргініну і проліну. Тому залишки цих амінокислот досліджують з використанням карбоксипептидази В.